腺病毒介导的鼠IL-10基因对非肥胖型糖尿病小鼠胰岛β细胞的保护作用
2013-09-05陈燕燕张芳萍乔凌燕徐爱晶陈志红
陈燕燕,张芳萍,宋 青,乔凌燕,刘 栋,田 飞,徐爱晶,陈志红,李 堂
(1青岛大学医学院附属医院,山东 青岛 266003;2青岛市妇女儿童医疗保健中心;3靖江市人民医院;4广州市儿童医院)
1型糖尿病是一种自身免疫性疾病,是由炎性细胞和细胞因子等介导的胰岛β细胞不断破坏所致[1]。越来越多的研究认为,这种免疫破坏反应的致病机理是以1型T辅助细胞(Th1)免疫反应为基础的。Th1细胞活性和产生的细胞因子能上调促炎因子不断破坏胰岛β细胞,导致1型糖尿病发生;而2型T辅助细胞(Th2)能下调Th1细胞活性,防止1型糖尿病发生。因此,Th1和Th2细胞亚群失衡是1型糖尿病发病的关键,Th2细胞因子(尤其是IL-10)被认为是一种针对1型糖尿病治疗的有效细胞因子[2,3]。本课题组前期已经证实,腺病毒介导的IL-10基因转导入动物和人类胰腺的可行性[4],并证实IL-10可以预防1型糖尿病的发生[5]。由于临床上很难早期发现糖尿病,一旦发现往往已经有大量的胰岛β细胞破坏,因此迫切期待一种可以替代胰岛素长期皮下注射、应用于临床发病期的治疗方法。2011年10月~2012年5月,我们观察了腺病毒介导的鼠IL-10(Ad-rIL-10)基因转移体对非肥胖型糖尿病(NOD)小鼠1型糖尿病发病早期残余胰岛β细胞的保护作用,旨在为其临床治疗提供新思路。现报告如下。
1 材料与方法
1.1 材料 SPF级、雌性NOD/Lt小鼠 46只,4~5周龄,体质量19~24 g,购自中国医学科学院实验动物研究所,生产许可证号:SCXK(京)2009-0004,在无病理条件下饲养于青岛大学医学院附属医院动物房,自由进食、水。人胚肾293细胞由青岛大学医学院罗兵教授惠赠。含Ad-rIL-10和空载体(Ad-eGFP)的重组腺病毒液由青岛大学医学院附属医院陈志红副教授惠赠,其病毒滴度分别为1.0×109、8.0×108pfu/mL,培养293细胞并扩增腺病毒。环磷酰胺:德国ASTA Medica AG公司。荧光显微镜:日本Olympus公司。二氧化碳孵育箱:美国Forma Scientific公司。快速腺病毒感染性滴度检测试剂盒:北京本元正阳公司。小鼠 IFN-γ、IL-4、IL-10、C 肽ELISA试剂盒:美国R&D公司。血糖仪:美国强生稳豪型。DAB显色试剂盒:福州迈新生物技术开发有限公司。
1.2 方法
1.2.1 动物分组及动物模型制备 随机将小鼠分为4组:生理盐水对照组10只、糖尿病对照组12只、空载体对照组12只、Ad-rIL-10组12只。糖尿病对照组、空载体对照组、Ad-rIL-10组分别在第1、14天腹腔注射环磷酰胺200 mg/(kg·次)诱导糖尿病发生[6]。每周检测体质量1次,注射环磷酰胺后第3、7天及以后每周检测小鼠尾静脉随机血糖1次,观察小鼠毛发光泽度及有无体质量下降、多饮、多尿、多食现象,连续 2次随机血糖大于 16.7 mmol/L即可确定糖尿病早期模型。
1.2.2 动物处理及标本制备 成模后,立即给予空载体对照组含Ad-eGFP的重组腺病毒液0.1 mL、Ad-rIL-10组含Ad-rIL-10的重组腺病毒液0.1 mL、其他组等量生理盐水,腹腔注射1次。每周检测小鼠体质量、血糖。3周后处死所有小鼠,死前摘眼球留取血液标本,3000 r/min离心10 min,获取血清标本,并立即提取胰腺,10%中性甲醛固定,获得胰腺标本。
1.2.3 胰岛炎症浸润程度的评估 胰腺标本石蜡包埋,切片并HE染色,光镜观察。胰岛炎症浸润程度由专业病理人员采用双盲法判定,分为以下4级:G0:胰岛完整,无淋巴细胞浸润;G1:淋巴细胞浸润胰岛的周边或<25%的胰岛面积受累;G2:25% ~50%的胰岛面积受累;G3:>50%的胰岛面积受累。按上述标准每组观察5个×200倍镜下胰腺切片。
1.2.4 胰腺IL-10局部表达情况 胰腺标本采用免疫组化SABC法观察IL-10基因在胰腺局部的表达情况。细胞质中呈棕黄色颗粒的为阳性细胞,计算阳性细胞百分比和染色强度。阳性细胞百分比:<1%为0分,1% ~10%为1分,11% ~50%为2分,51% ~80%为3分,>80%为4分;颗粒着色强度:无着色0分,淡黄色1分,黄色2分,棕黄色3分。阳性细胞百分比和染色强度相乘,积为免疫组化得分,0分(-),1~4分(+),5~8分(++),9~12分(+++)。
1.2.5 残余胰岛β细胞功能的检测 血清C肽水平可以反映胰岛β细胞分泌胰岛素的能力。采用酶联免疫吸附方法(ELISA)测定血清标本中C肽光密度(OD)值,根据OD值计算实际血清C肽含量。
1.2.6 血清 IL-10、IL-4及 IFN-γ 水平检测 采用ELISA法检测小鼠血清IFN-γ、IL-4及IL-10 OD值,根据 OD值计算实际血清 IFN-γ、IL-4及 IL-10水平,了解机体是否存在Th亚群失衡。
1.2.7 统计学方法 采用SPSS17.0统计软件,计量资料以表示,多组间两两比较采用SNK检验,对等级分组资料进行H检验统计学分析。P≤0.05为差异有统计学意义。
2 结果
2.1 IL-10对成模后小鼠血糖、体质量的影响 糖尿病对照组、空载体对照组、Ad-rIL-10组腹腔注射环磷酰胺后,小鼠毛发光泽度逐渐下降,并出现血糖升高、体质量下降、饮食饮水量增多、尿量增多等现象。生理盐水对照组未出现死亡,成模后糖尿病对照组、Ad-rIL-10组各死亡4只,空载体对照组死亡3只。各组体质量、血糖变化见表1、2。
2.2 IL-10在胰腺的局部表达情况 各组胰腺标本切片IL-10免疫组化分析显示,Ad-rIL-10组胰腺标本光镜下细胞内棕黄色颗粒多、着色深,免疫组化得分为(4.75 ±1.49)分,高于生理盐水对照组(2.10±1.10)、糖尿病对照组(2.63 ±1.19)、空载体对照组(2.89 ±1.05)(P 均 <0.05)。
表1 各组成模前后体质量变化(g,)

表1 各组成模前后体质量变化(g,)
注:与生理盐水对照组比较,*P<0.05
组别 n 成模前 成模后1周 2周 3周生理盐水对照组 1022.64 ±1.7923.78 ±0.44 24.32 ±1.00 24.46 ±1.06糖尿病对照组 823.05 ±0.9921.94 ±1.50*21.85 ±1.49*21.62 ±1.20*Ad-rIL-10 组 822.65 ±0.7622.24 ±0.70*22.67 ±1.35*21.47 ±1.02*空载体对照组 922.46 ±2.5522.35 ±0.90*22.65 ±1.12*22.04 ±0.95*
表2 各组成模前后血糖变化(mmol/L,)
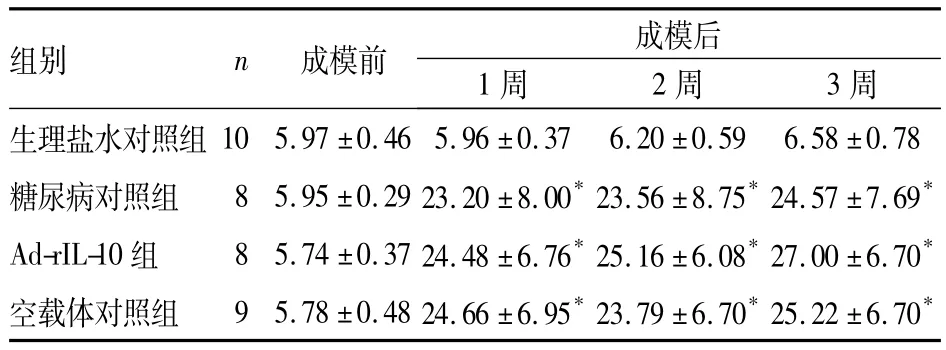
表2 各组成模前后血糖变化(mmol/L,)
注:与生理盐水对照组比较,*P<0.05
组别 n 成模前 成模后1周 2周 3周生理盐水对照组10 5.97 ±0.465.96 ±0.37 6.20 ±0.59 6.58 ±0.78糖尿病对照组 8 5.95 ±0.2923.20 ±8.00*23.56 ±8.75*24.57 ±7.69*Ad-rIL-10 组 8 5.74 ±0.3724.48 ±6.76*25.16 ±6.08*27.00 ±6.70*空载体对照组 9 5.78 ±0.4824.66 ±6.95*23.79 ±6.70*25.22 ±6.70*
2.3 IL-10对胰岛炎症程度的影响 生理盐水对照组小鼠胰岛炎以G0、G1级为主,而其他组胰岛炎以G2、G3级为主,镜下可见胰腺细胞形态紊乱,胰岛以及胰岛周围炎细胞浸润明显,以淋巴细胞浸润为主,胰岛小,数量少。
2.4 各组血清 C 肽、IL-4、IL-10、IFN-γ 水平比较见表3。
表3 各组血清 C 肽、IL-4、IL-10、IFN-γ 水平比较()

表3 各组血清 C 肽、IL-4、IL-10、IFN-γ 水平比较()
注:与生理盐水对照组比较,*P<0.05
组别 n C 肽(ng/mL) IL-4(pg/mL) IL-10(pg/mL) IFN-γ(pg/mL)生理盐水对照组 10 5.108 ±0.739 86.90 ±14.93 260.10 ±55.16 253.35 ±22.84糖尿病对照组 8 3.840 ±0.243* 55.75 ± 8.88* 174.62 ±23.36* 353.36 ±28.82*Ad-rIL-10 组 8 4.050 ±0.195* 56.88 ± 8.37* 212.04 ±32.75* 374.00 ±17.39*空载体对照组 9 3.848 ±0.288* 58.22 ±10.21* 195.61 ±30.84* 354.46 ±40.40*
3 讨论
环磷酰胺是一种具有细胞毒性的化疗药物,适应于淋巴细胞白血病、淋巴瘤和一些实体瘤的治疗,同时也是一种免疫调节剂。研究表明,环磷酰胺可以加强免疫反应,加速 NOD小鼠糖尿病的发病[6,7]。Yasunami 等[6]研究发现,分别给予两组NOD小鼠腹腔注射环磷酰胺,第1组腹腔注射环磷酰胺1次,第2组第1、14天腹腔注射小剂量环磷酰胺各1次,结果显示,第1组小鼠第2周糖尿病的发病率为63.7%、4周后发病率为55.1%,而第2组小鼠第1次注射环磷酰胺2周糖尿病的发病率为72.7%,第2次注射2周发病率为100%。提示1次小剂量环磷酰胺可能在短期内促进NOD小鼠发生1型糖尿病,但这种反应为可逆的,而2次小剂量环磷酰胺可提高小鼠1型糖尿病的发病率。本实验中,小剂量环磷酰胺成功地诱导了NOD小鼠1型糖尿病发生,且诱发成功率较高,使本实验小鼠发病时间同一化。
1型糖尿病的发病过程大致可归纳为以下3个阶段:即Th细胞失衡阶段、炎性细胞募集阶段及效应阶段。“免疫调节失衡学说”认为,Th1/Th2细胞亚群失衡和免疫功能紊乱是1型糖尿病的发病原因[8]。Th1 型细胞因子,如 IL-2、IFN-γ 和 TNF-β等,能上调促炎因子不断破坏胰岛β细胞;而Th2型细胞因子,如 IL-4、IL-10等,能下调 Th1细胞活性,防止1型糖尿病的发生[9]。
IL-10是一种重要的免疫调节因子,它可以抑制炎症过程中的抗原提呈、炎性细胞激活和细胞因子分泌等环节,具有较强的免疫抑制作用[10]。IL-10不仅能抑制体内外TNF-α、IL-1及氧自由基产物的形成,还能通过抑制抗原提呈细胞产生的IL-12来抑制Th1细胞产生的IFN-γ的释放。但外源性IL-10在体内的相对半衰期较短,需要不断重复给药,这就限制了重组IL-10蛋白的应用。结合转基因技术,本课题组前期已经成功构建了腺病毒介导的鼠IL-10基因转移体,在体外感染胰岛素分泌细胞系,可以在该细胞内有效表达,在高糖刺激下仍具有分泌胰岛素的功能,并且可以保护胰岛β细胞免受促炎因子的破坏,表明这种转移体并不影响细胞功能,具有较高的基因转导效率,可以持续、稳定的表达基因,安全性较高[3~5]。后期将其分别应用于4周龄和9周龄NOD小鼠的体内试验中发现,IL-10可以降低糖尿病的累积发病率、减轻胰岛炎症程度,延缓甚至防止1型糖尿病的发生。但是在临床上很难早期发现糖尿病,一旦发现,往往胰岛炎症浸润较重,残余胰岛β细胞较少。
本研究使用4~5周龄的NOD小鼠,胰岛炎症还未发生或处于胰岛炎症早期阶段,采用环磷酰胺加速糖尿病发生,此时小鼠机体正处于Th细胞失衡阶段,发病后立即给予IL-10基因转移体,观察IL-10是否能够逆转Th细胞亚群失衡、保护残存胰岛β细胞免受免疫破坏,从而阻止疾病的进展。结果显示,与生理盐水对照组比较,采用环磷酰胺诱导后小鼠出现血糖升高、体质量下降、毛色无光泽、多饮、多尿、多食、激惹等现象,而且出现Th1/Th2细胞亚群失衡(IFN-γ水平升高,血清 IL-4、IL-10水平降低)、胰岛素前体C肽水平降低,这些均表明环磷酰胺诱导了1型糖尿病早期成模,并且成模率较高。虽然Ad-rIL-10组胰腺局部高表达IL-10,但与其他模型组比较,IL-10在控制血糖、体质量及胰岛炎症浸润方面无明显作用,不能增加C肽的分泌,未能逆转机体免疫失衡状态,这些结果提示,IL-10对于残余胰岛β细胞无明显保护作用。尽管有研究认为,IL-10基因转移体能在胰腺高表达,可下调Th1样细胞因子活性,起到调节机体免疫微环境的作用,进而阻止糖尿病的进展。但我们的实验结论与之不符,考虑原因可能为:环磷酰胺诱导糖尿病发病后,相当于临床发病早期,此时机体早已经出现严重的免疫代谢紊乱,已有大量的胰岛β细胞破坏,通过单一因素IL-10进行免疫干预,不足以逆转此免疫紊乱,而残余胰岛β细胞继续进行性破坏。
在本实验环磷酰胺加速NOD小鼠发病的过程中,存在小鼠死亡的现象,除了血糖过高的原因外,是否与环磷酰胺的细胞毒性作用对NOD小鼠机体打击过大有关,有待进一步明确环磷酰胺加速NOD小鼠发病的安全性。
[1]Atkinson MA,Eisenbarth GS.Type 1 diabetes:new perspectives on disease pathogenesis and treatment[J].Lancet,2001,358(9277):221-229.
[2]Prud’homme GJ.Gene therapy of autoimmune diseases with vectors encoding regulatory cytokines or inflammatory cytokine inhibitors[J].Gene Med,2000,2(4):222-232.
[3]Zhang YC,Pileggi A,Agarwal A,et al.Adeno-associated virusmediated IL-10 gene therapy inhibits diabetes recurrence in syngeneic islet cell transplantation of NOD mice[J].Diabetes,2003,52(3):708-716.
[4]徐爱晶,李堂.应用AdEasy腺病毒载体系统构建鼠白细胞介素10基因重组腺病毒[J].中国组织工程研究与临床康复,2008,12(7):1277-1280.
[5]Xu AJ,Zhu W,Tian F,et al.Recombinant adenoviral expression of IL-10 protects beta cell from impairment induced by pro-inflammatory cytokine[J].Mol Cell Biochem,2010,344(1-2):163-171.
[6]Yasunami R,Bach JF.Anti-suppressor effect of cyclophosphamide on the development of spontaneous diabetes in NOD mice[J].Eur J Immunol,1988,18(3):481-484.
[7]Brode S,Raine T,Zaccone P,et al.Cyclophosphamide-induced type-1 diabetes in the NOD mMouse is associated with a reduction of CD4+CD25+Foxp3+Regulatory T cells[J].J Immunol,2006,177(10):6603-6612.
[8]石昌红,管庆波,高聆,等.成人隐匿性自身免疫性糖尿病患者CD4+CD25+T细胞的变化研究[J].中国免疫学杂志,2006,22(8):771-774.
[9]徐筱玮,张德宪.糖胰康改善成人隐匿性自身免疫性糖尿病胰岛β细胞功能的临床研究[J].中国中西医结合杂志,2008,28(10):882-885.
[10]王慧,吴长有.白细胞介素10免疫调节功能的研究进展[J].国际免疫学杂志,2010,33(4):315-319.
