NQO1基因C609T、C465T多态性与子宫内膜癌易感性的关系
2013-09-05高会影杨威威程建新
李 利,高会影,杨威威,李 方,程建新
(河北医科大学第四医院,石家庄 050011)
子宫内膜癌为女性生殖道常见恶性肿瘤之一,近年来发病率呈上升趋势。一般认为,长期持续的无孕激素拮抗的雌激素暴露是子宫内膜癌的病因之一。然而,随着对雌激素研究的深入,人们逐渐发现雌激素的代谢产物与肿瘤的发生、发展关系密切。醌氧化还原酶1(NQO1)是真核细胞内普遍存在的一类黄素蛋白酶,其定位于人类染色体16p22。该酶催化醌双电子还原反应,对醌及其衍生物有解毒作用[1],且能够解除醌类物质对细胞的毒害,从而起到保护细胞的作用,是人体内一种重要的化学致癌物代谢酶。NQO1第六位外显子(C609T)、第四位外显子(C465T)为非同义编码单核苷酸多态,可引起蛋白质编码氨基酸序列改变从而导致蛋白质功能的改变,进而影响肿瘤的发生、发展。本研究观察分析了NQO1基因C609T、C465T单核苷酸多态性与子宫内膜癌易感性的关系。现报告如下。
1 资料与方法
1.1 临床资料 选取2006~2008年河北医科大学第四医院经病理学检查确诊的子宫内膜癌患者209例(观察组),年龄(54.21 ±8.84)岁;其中子宫内膜透明细胞癌2例,子宫内膜腺棘细胞癌5例,子宫内膜鳞状细胞癌1例,未分化癌1例,其余均为子宫内膜腺癌;采用2000年国际妇产科联盟(FIGO)的手术病理分期,Ⅰ期150例,Ⅱ期49例,Ⅲ期10例。另选同一地区的健康女性个体209例(对照组),年龄(53.40±9.76)岁。两组均为汉族人,且均无烟酒嗜好,无妇科肿瘤阳性家族史,绝经后妇女无激素替代治疗史。两组一般资料无统计学差异,具有可比性。
1.2 NQO1基因C609T、C465T多态性检测 抽取研究对象外周静脉血5 mL,以枸橼酸钠抗凝,采用蛋白酶K-氯化钠盐析法提取白细胞DNA。采用聚合酶链反应—限制性内切酶片段长度多态性(PCRRFLP)方法对NQO1 C609T和C465T进行基因分型。扩增 NQO1C609T特异性:5'-TCTTACTGAGAAGCCCAGACCAACT-3',5'-CTCCAGGCGTTTCTTCCATCC-3',212 bp。扩增 NQO1 C465T 特异性:5'-TATCTAGCTTTACTCGGACCCACTC-3', 5'-CATTCAGAACCATCCACCTACCC-3',380 bp,20 μL。其中模板DNA 100 ng,10×PCR(含 MgCl215 mM)缓冲液2.4 μL,染料 2.0 μL,Taq DNA 聚合酶 1.0 U,dNTPs 200 μM和上、下游引物各250 nM。反应条件:94℃预变性5 min,然后94℃变性45 s、59℃(NQO1 C609T)或60℃(NQO1 C465T)退火45 s、72℃延伸45 s,35个循环后,72℃继续延伸7 min。2个多态位点的扩增产物分别经 HinfⅠ(NQO1 C609T)和 MspⅠ(NQO1 C465T)限制性内切酶于37℃和55℃消化过夜后,分别进行4%与5%琼脂糖凝胶电泳分析基因型。NQO1 C609T的野生型C/C型为212 bp,突变型T/T型为129 bp和83 bp,杂交型C/T型为212 bp、129 bp和83 bp。NQO1 C465T的野生型C/C型为356 bp和24 bp,突变型T/T型为380 bp,杂交型T/C型为380 bp、356 bp 和24 bp。
1.3 统计学方法 采用SPSS11.5统计软件。对照组基因型频率分布行χ2检验做Hardy-Weinberg平衡分析。两组年龄差异采用t检验,两组等位基因及基因型分布的差异用χ2检验分析,以非条件Logistic回归方法计算表示相对风险度的比值比(OR)及其95%可信区间(CI)。采用EH软件分析NQO1基因单体型频率,2LD软件分析连锁不平衡状态。P≤0.05为差异有统计学意义。
2 结果
2.1 NQO1 C609T基因型及等位基因频率分布结果见表1。
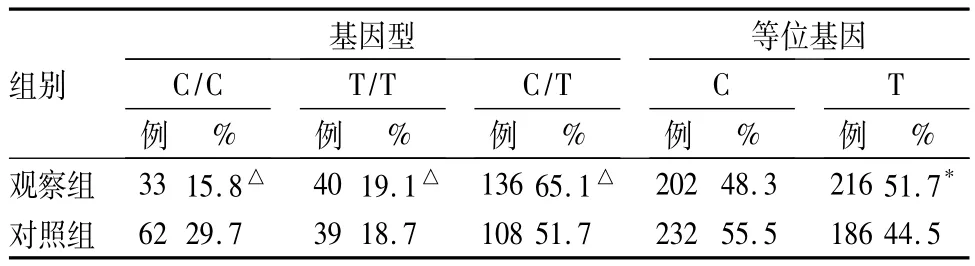
表1 NQO1 C609T基因型及等位基因频率分布(n=209)
2.2 NQO1 C465T基因型及等位基因频率分布结果见表2。由表2可知,各组基因型及等位基因比较,P 均 >0.05。
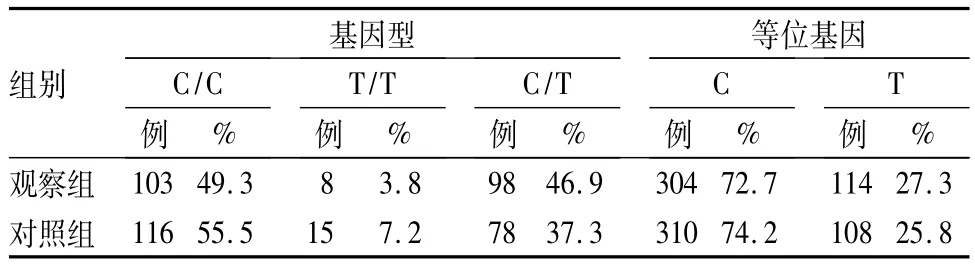
表2 NQO1 C465T基因型及等位基因频率分布(n=209)
2.3 两组不同初潮年龄者 NQO1 C609T、NQO1 C465T基因型分布 结果见表3。
2.4 两组不同绝经情况者 NQO1 C609T、NQO1 C465T基因型分布 结果见表4。
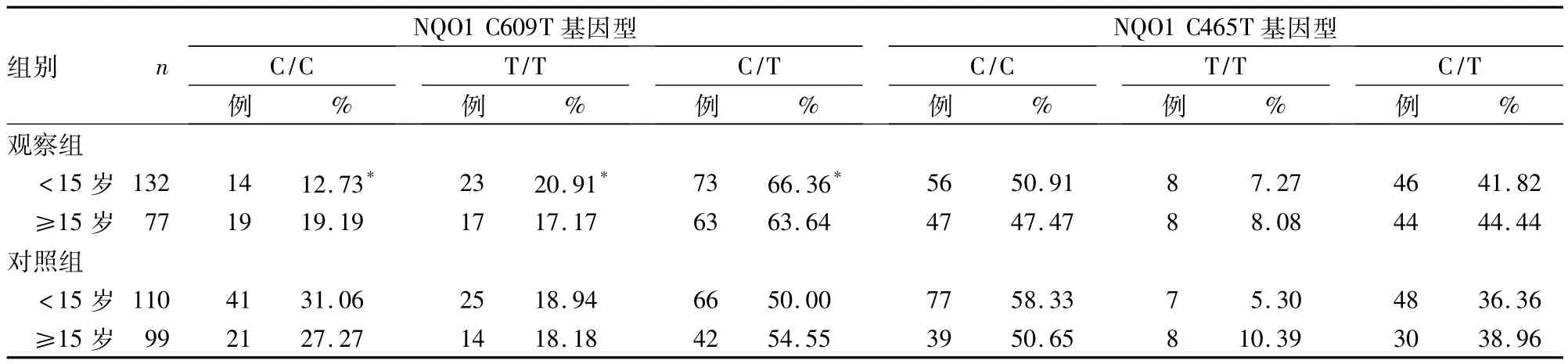
表3 不同初潮年龄NQO1 C609T、NQO1 C465T基因型分布

表4 不同绝经情况NQO1 C609T、NQO1 C465T基因型分布
3 讨论
本研究探讨了NQO1 C609T和NQO1 C465T单核苷酸多态与子宫内膜癌发病风险的关系,结果显示NQO1 C609T单核苷酸多态与子宫内膜癌的遗传易感性相关,C/T、T/T基因型可能是子宫内膜癌发病的潜在危险因素。而NQO1 C465T单核苷酸多态与子宫内膜癌的遗传易感性未见明显关联。
研究表明,NQO1具有抑制肿瘤发生的作用。其机制可能为:①NQO1是一种黄素酶,能够催化醌还原为亲电子的水溶性醌,避免了亲核性醌损伤DNA。②研究发现,转染并表达NQO1活性的乳腺癌系MCF-7在TNF-α作用下凋亡敏感性明显增加,此过程可能与NQO1增加呼吸链电子流量,增加TNF-α的凋亡效应产物的生成有关。③NQO1对P53蛋白稳定性有调节作用,特别当细胞处于氧化应激状态时,这种对P53蛋白的稳定作用更加突出,从而能使受损的细胞及时停止生长进行修复或调节发生凋亡[2]。目前发现,人的NQO1基因序列中,引起蛋白质编码氨基酸序列改变的非同义编码单核苷酸多态有3个,其中包括位于第四位外显子的C465T和第六位外显子的C609T,分别引起所编码的139位氨基酸由色氨酸变为精氨酸,187位氨基酸由脯氨酸变为丝氨酸。这些蛋白质编码氨基酸序列的改变,可能导致了个体中此酶活性的降低或缺失,减弱了NQO1对醌类化合物的解毒作用及改变肿瘤对特定原癌基因及抑癌基因功能的影响,从而使机体患肿瘤的可能性增加[3]。
近年来,人们对于NQO1 C609T的研究越来越深入,不同人群NQO1 C609T基因多态性的研究结果存在一定差异[4]。已有研究表明,纯和野生基因型C/C具有完全的NQO1酶活性,杂合基因型C/T的酶活性较纯和野生型降低3倍,纯和突变基因型T/T的酶活性则完全丧失[5]。因此,具有突变纯合子的人群是肿瘤高危易感人群。据报道,NQO1 C609T基因多态性与多种肿瘤如白血病、肺癌、大肠癌等发生有关联[6~8]。Smith 等[9]用 PCR-RFLP 方法在研究成人白血病与NQO1的关系时发现,低NQO1活性[具有C/T或T/T基因型]可增加患白血病的危险性。本研究发现,NQO1 C609T单核苷酸多态与子宫内膜癌的遗传易感性相关,C/T、T/T基因型可能是子宫内膜癌发病的潜在危险因素。当然也有不同的报道,认为携带T/T、C/T基因型者并没有显著增加肿瘤的发病风险[10~13]。
以往,对于NQO1 C465T研究尚不多见,其与子宫内膜癌的研究鲜有报道。文献报道,不同人群NQO1 C465T等位基因频率较低,高加索人群为5%,加拿大人群为 1%[14]。本研究发现,NQO1 C465T单核苷酸多态与子宫内膜癌的遗传易感性未见明显关联。应考虑到该位点的突变率较低,导致多态性改变与子宫内膜癌发生的关系不显著。
总之,NQO1 C609T多态与子宫内膜癌的发病存在关联,携带T等位基因可能增加子宫内膜癌的发病风险。
[1]代恩勇,卢振霞.NQO1与肿瘤[J].国外医学:遗传学分册,2003,26(3):141-144.
[2]代恩勇,卢振霞,史洁坪,等.NQO1基因多态性与大肠癌遗传易感性[J].中国肿瘤临床,2004,31(2):89-91.
[3]Nioi P,Hayes JD.Contribution of NAD(P)H:quinine oxidoreductase1 to protection against carcinogenesis,and regulation of its gene by the Nrf-2 basic-region leucine zipper and the arylhydrocarbon receptor basic helix-loop-helix transcription factors[J].Mutat Res,2004,555(1-2):149-171.
[4]吴春玲,陈艳,李桂兰,等.NQO1酶与苯中毒及相关疾病遗传易感性的关系[J].中华劳动卫生职业病杂志,2003,21(2):137-138.
[5]Moran JL,Siegel D,Ross D.A potential mechanism underlying the increased susceptibility of individuals with a polymorphism in NAD(P)H:quinone oxidoreductase 1(NQO1)to benzene toxicity[J].Proc Natl Acad Sci USA,1999,96(14):8150-8155.
[6]Rudant J,Menegaux F,Leverger G,et al.Childhood hematopoietic malignancies and parental use of tobacco and alcohol:the ESCALE study(SFCE)[J].Cancer Causes Control,2008,19(10):1277-1290.
[7]Lawson KA,Woodson K,Virtamo J,et al.Association of the NAD(P)H:quinine oxidoreductase(NQO1)609C→T polymorphism with lung cancer risk among male smokers[J].Cancer Epidemiol Biomarkers Prev,2005,14(9):2275-2276.
[8]van der Logt EM,Bergevoet SM,Roelofs HM,et al.Role of epoxide hydrolase,NAD(P)H:quinine oxidoreductase,cytochrome P4502E1 or alcohol dehydrogenase genetypes in susceptibility to colorectal cancer[J].Mutat Res,2006,593(1-2):39-49.
[9]Smith MT,Wang Y,Kane E,et al.Low NAD(P)H:quinone oxidoreductase 1 activity is associated with increased risk of acute leukemia in adults[J].Blood,2001,97(5):1422-1426.
[10]Saldivar SJ,Wang Y,Zhao H,et al.An association between a NQO1 genetic polymorphism and risk of lung cancer[J].Mutation Res,2005,582(1-2):71-78.
[11]Chan EC,Lam SY,Fu KH,et al.Polymorphisms of the GSTM1,GSTP1,MPO,XRCC1,and NQO1 genes in Chinese patients with non-small cell lung cancers:relationship with aberrant promoter methylation of the CDKN2A and RARB genes[J].Cancer Genet Cytogenet,2005,162(1):10-20.
[12]Sørensen M,Autrup H,Tjønneland A,et al.Genetic polymorphisms in CYP1B1,GSTA1,NQO1 and NAT2 and the risk of lung cancer[J].Cancer Lett,2005,221(2):185-190.
[13]Yang M,Choi Y,Hwangbo B,et al.Combined effects of genetic polymorphisms in six selected genes on lung cancer susceptibility[J].Lung Cancer,2007,57(2):135-142.
[14]Phillips RM,Basu S.Biological and clinical sigificance of polymorphisms in NAD(P)H:quinone oxidoreductase1(NQO1)[J].Current Pharmacogenomics,2004,2(1):75-82.
