雷公藤内酯醇对弥漫性大B淋巴瘤细胞株凋亡的影响及其机制探讨
2013-09-05师宪平蓝晓莹温创宇刘焕亮
师宪平,蓝晓莹,温创宇,陈 鑫,刘焕亮
(1广州医学院免疫研究所,广州 510182;2中山大学胃肠病学研究所;3中山大学附属第六医院)
弥漫性大B细胞淋巴瘤(DLBCL)是常见的成人非霍奇金淋巴瘤(NHL),治疗棘手。传统化疗药物效果不理想,患者5年生存率较低[1]。雷公藤俗名断肠草,系卫矛科雷公藤属木质藤本植物,生长于山地林缘阴湿处,治疗类风湿性关节炎、慢性肾炎、红斑狼疮和银屑病效果显著。研究显示,雷公藤除具有抗炎和抗移植排斥反应外,还有较强的抗肿瘤作用[2],可抑制白血病细胞增殖和诱导细胞凋亡[3];可使人胃腺癌细胞株MGC80-3异种移植小鼠的肿瘤体积缩小90%[4]。雷公藤内酯醇(TPL)为雷公藤中提取的一种含有3个环氧基的二萜内酯活性化合物,有显著的抗肿瘤、抗炎症等作用[5]。2011年11月~2012年11月,我们观察了TPL对DLBCL的抑制作用,现分析结果并探讨其可能的作用机制。
1 材料与方法
1.1 材料 弥漫性大B淋巴瘤细胞株SU-DHL-4购自中国医学科学院血液学研究所;MTS、碘化丙啶(PI)、细胞凋亡双染检测试剂盒、吐温-20(Tween-20)、二甲基亚砜(DMSO)购自Sigma-Aldrich公司;抗半胱氨酸天冬氨酸蛋白酶-8(Pro-caspase8)、半胱氨酸天冬氨酸蛋白酶-3(Pro-caspase3)、磷酸化蛋白激酶B(P-AKT)、蛋白激酶B(AKT)、磷酸化细胞外调节蛋白激酶(P-ERK)、细胞外调节蛋白激酶(ERK)为Cell Signaling公司产品;抗二磷酸腺苷核糖多聚酶(PRAP)为BD Biosciences PharMingen公司产品;抗X连锁凋亡抑制蛋白(XIAP)、髓样细胞白血病-1(Mcl-1)抗体购自Santa Cruze公司;抗3-磷酸甘油醛脱氢酶(GAPDH)、磷酸化信号传导与转录活化因子(P-STAT5)、信号传导与转录活化因子(STAT5)抗体购自Upstate Technology公司,辣根过氧化物酶(HRP)-抗鼠/兔Ig抗体为Pierce Biotechnology公司产品。
1.2 实验方法
1.2.1 细胞培养 将 SU-DHL-4细胞置于 RPMI 1640培养液(含10%胎牛血清,100 U/mL青霉素、100 μg/mL链霉素)于37℃、5%CO2饱和湿度条件下培养,取对数生长期细胞进行实验。
1.2.2 TPL干预及细胞增殖活性检测 取生长良好的SU-DHL-4细胞置于96孔板,15000个/孔,分别采用 0、0.03125,0.0625、0.125、0.25 及 0.5 μmol/L(μM)的TPL作用72 h。于实验各孔分别加MTS试剂20 μL,37℃继续孵育4 h,采用酶联免疫检测仪测定各孔490 nm波长处的吸光度值(A值)。以TPL浓度为横坐标,细胞增殖活性为纵坐标绘制SU-DHL-4细胞增殖活性抑制率曲线。
1.2.3 TPL干预及细胞凋亡率测定 取生长良好的SU-DHL-4细胞(2×105个/管),分别采用 0、0.1、0.2、0.3 μM 的 TPL 处理 36 h。处理后收集细胞,1 ×binding buffer洗涤,AnnexinV 工作液 100 μL室温孵育15 min,采用AnnexinV/PI双标记法流式细胞术(能区分正常细胞、早期凋亡细胞、晚期凋亡细胞及坏死细胞)测定细胞凋亡率。检测前每管加PI 1 μL上机。按照Sigma-Aldrich公司提供的试剂说明书操作,实验重复3次,取均值。双变量流式细胞仪的散点图上右下象限代表晚期凋亡细胞,右上象限代表早期凋亡细胞,其总和计为凋亡细胞。
1.2.4 TPL干预及细胞凋亡相关蛋白、增殖相关蛋白表达检测 采用 0、0.1、0.2、0.3 μM 的 TPL 处理细胞36 h,再用0.2 μM 的 TPL 处理12、24、36 h(对照组不予TPL处理)。收集细胞,加入蛋白裂解液充分裂解细胞提取蛋白,用Bio-Rad蛋白浓度试剂盒在酶标仪中选750 nm波长定量蛋白浓度;100~130 V恒压电泳约90 min,100 V恒压转膜约90 min,5% 牛奶室温封闭1 h,一抗4℃过夜,次日曝光,对定性结果进行分析,在保证蛋白上样质量一致的情况下(管家基因所表达的GAPDH条带深浅一致),观察各蛋白所对应条带的深浅,采用Western blot法测定细胞凋亡蛋白及增殖蛋白表达。凋亡蛋白包括 PARP 、Pro-caspase3、Pro-caspase8、XIAP、Mcl-1,增殖蛋白包括 AKT、ERK、STAT5。
1.3 统计学方法 采用GraphPad Prism 4.0软件行统计学处理。细胞凋亡率和细胞抑制率比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞增殖活性 TPL达0.125 μmol/L时,细胞增殖出现明显抑制(P<0.05),随TPL剂量增加,细胞抑制率明显增高(图1)。TPL对细胞增殖的半数抑制浓度(IC50)为0.131 μM。
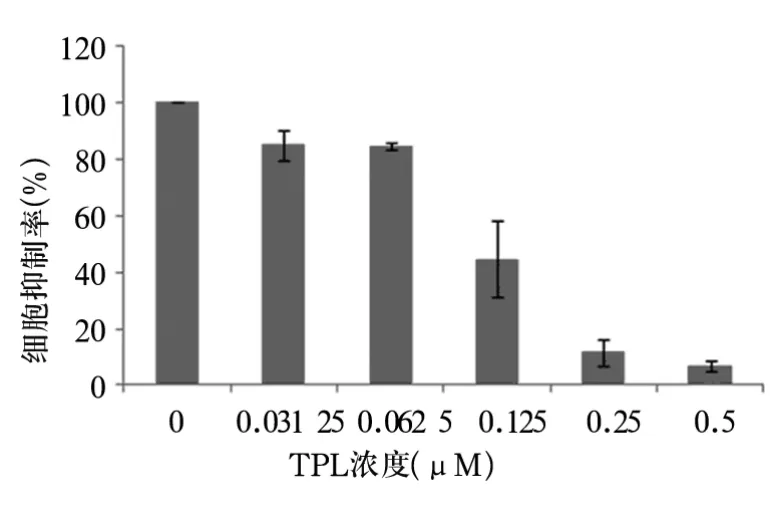
图1 TPL对SU-DHL-4增殖活性的影响
2.2 细胞凋亡率 与对照组比较,各TPL干预组早期和晚期凋亡细胞均明显增加(图2),P<0.05。
2.3 凋亡相关蛋白表达 见图3。PARP呈TPL剂量与时间依赖性切割,Pro-caspase3、Pro-caspase8呈剂量与时间依赖性降低,而凋亡抑制蛋白XIAP与Mcl-1表达随TPL浓度升高和作用时间延长而降低。

图2 TPL对SU-DHL-4凋亡的影响

图3 TPL对SU-DHL-4凋亡相关蛋白表达的影响
2.4 增殖相关蛋白表达 见图4。结果显示TPL对增殖相关蛋白AKT、ERK和STAT5及其磷酸化形式的表达,具有剂量与时间依赖性下调作用。

图4 TPL对SU-DHL-4增殖相关蛋白表达的影响
3 讨论
DLBCL是成人恶性淋巴瘤最常见的类型之一,在形态学和临床表现上均具有显著的异质性,传统化疗药物治疗预后差,筛选新的能有效杀伤DLBCL细胞的小分子化合物是近年来研究的热点。TPL是中草药雷公藤主要活性成分的提取物,其衍生物PG490-88作为一种水溶性的衍生物,目前已经用于黑色素瘤等实体瘤的一期临床试验[6]。
本研究结果显示,TPL可抑制SU-DHL-4细胞增殖并诱导其凋亡,随着药物浓度增加,细胞的增殖抑制率明显增加,凋亡细胞增多,证实TPL具有抗DLBCL的活性。分析其作用机制可能为:①抑制抗凋亡蛋白表达,活化 Caspase级联反应[7~14]。本研究结果显示,TPL干预后相关抗凋亡蛋白XIAP和Mcl-1表达均呈浓度及时间依赖性降低;与凋亡密切相关的Caspase级联反应中的Pro-caspase8、Procaspase3表达亦呈浓度和时间依赖性降低;具有DNA损伤修复作用的Caspase3的底物PARP呈剂量与时间依赖性切割。②抑制增殖相关信号通路蛋白表达。研究发现,PI3K-AKT,MEK/ERK和JAKs/STATs信号转导通路与细胞增殖、分化及凋亡关系密切,通路的异常活化可导致细胞异常增殖和恶性转化[15~17],本研究结果显示,TPL 干预后 P-AKT、PERK、P-STAT5表达水平下调与其总体蛋白水平的下调相比发生较早,提示这些信号通路活化受到TPL的抑制,进而导致细胞增殖抑制。关于这些通路是否与细胞凋亡蛋白表达直接相关以及TPL在体抗DLBCL生长的作用如何,还需进一步探讨与研究。
分析本研究结果,TPL可通过对凋亡相关蛋白及PI3K-Akt,MEK/ERK和JAKs/STATs信号转导通路的影响,抑制SU-DHL-4细胞生长,诱导其凋亡。本研究为DLBCL的治疗提供了新的策略与思路。
[1]Plosker GL,Figgitt DP.Rituximab:a review of its use in non-Hodgkin 's lymphoma and chronic lymphocytic leukaemia[J].Drugs,2003,63(8):803-843.
[2]Tao X,Schulze-Koops H,Ma L,et al.Effects of Tripterygium wilfordii hook F extracts on induction of cyclooxygenase 2 activity and prostaglandin E2 production[J].Arthritis Rheum,1998,41(1):130-138.
[3]Carter BZ,Mak DH,Schober WD,et al.Triptolide induces caspase-dependent cell death mediated via the mitochondrial pathway in leukemic cells[J].Blood,2006,108(2):630-637.
[4]Yang S,Chen J,Guo Z,et al.Triptolide inhibits the growth and metastasis of solid tumors[J].Mol Cancer Ther,2003,2(1):65-72.
[5]袁红.雷公藤内酯醇研究进展[J].中医药信息,2004(6):15-18.
[6]Fidler JM,Li K,Chung C,et al.PG490-88,a derivative of triptolide,causes tumor regression and sensitizes tumors to chemotherapy[J].Mol Cancer Ther,2003,2(9):855-862.
[7]Buggins AG,Pepper C,Patten PE,et al.Interaction with vascular endothelium enhances survival in primary chronic lymphocytic leukemia cells via NF-kappaB activation and de novo gene transcription[J].Cancer Res,2010,70(19):7523-7533.
[8]Gu L,Zhu N,Zhang H,et al.Regulation of XIAP translation and induction by MDM2 following irradiation[J].Cancer Cell,2009,15(5):363-375.
