钛表面制备多孔氧化物陶瓷层的实验设计
2013-09-04尤德强
尤德强,王 泽,张 鹏,李 卫
(暨南大学材料科学与工程系,广东广州510628)
0 引言
金属钛具有良好的力学性能、低致敏性和优良的耐腐蚀性能,是目前骨、关节、牙齿等硬组织替换中应用最多的材料。但是钛本身不具有生物活性,植入人体后不能促进新生骨在其表面的形成,与新生骨之间只能形成简单的机械固定而非骨性结合,此外,钛的弹性模量也远远高于人体自然骨,生物力学相容性差,因此植入人体后易松动甚至脱落,造成植入失败从而增加病人的痛苦和负担[1]。对钛植入材料进行表面改性以提高其表面的生物活性和生物相容性已经成为共识,也是目前研究的热点[2-6]。近年来,研究人员开始将微弧氧化技术应用于钛植入材料的表面改性,通过改变微弧氧化工艺条件和电解液的组成,不仅可以形成多孔的表面微观结构,同时还可以改变材料表面的化学组成,从而实现材料表面的功能设计,是一种理想的钛植入材料表面改性方法[7-9]。本实验中,以乙酸钙、β-甘油磷酸钠混合溶液作为电解液,采用微弧氧化技术制备具有多孔结构和特定组成的氧化陶瓷层,以提高材料的生物活性和生物相容性;同时将该实验技术进行材料表面改性实验教学设计并作为学生开放性实验之一,以提高学生的综合分析能力和科学研究素养。
1 实验设计
1.1 实验原理
本实验采用微弧氧化法在金属钛表面制备多孔氧化物陶瓷层。其原理为:将金属钛片放在电解质溶液中,利用电化学方法在金属钛材料表面产生火花放电斑点,在热化学、等离子化学和电化学的共同作用下引起阳极上微等离子体击穿,从而在金属钛表面形成大量微孔并同时在表面原位生长出氧化物陶瓷层[10-11]。
1.2 实验装置
实验装置如图1所示。实验选用中南民族大学等离子体研究所生产的PN-III型微弧氧化电源,设计电压0~600 V,电流0~15 A,占空比5% ~80%,频率0 ~2 kHz。
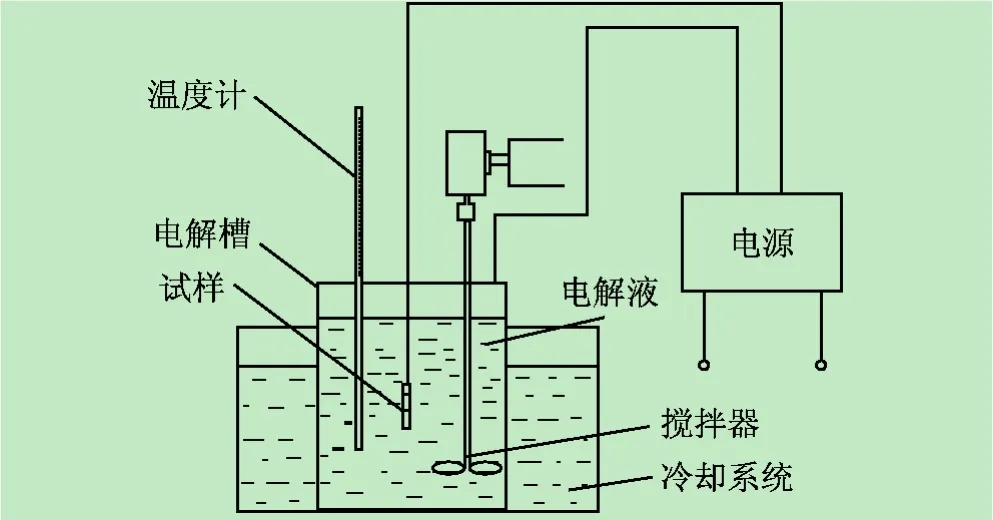
图1 实验装置示意图
1.3 实验步骤
(1)电解液的配置。向1 000 mL容量瓶中加入约800 mL去离子水,称取35.238 g乙酸钙和6.122 g β-甘油酸磷酸钠依次加入容量瓶中,溶解均匀后加去离子水和NaOH溶液定量到1 000 mL并同时使电解液体系pH值达到11。
(2)用商业纯钛丝(TA1)将金属钛试样与微弧氧化电源阳极相连,以不锈钢电解池为阴极;向电解池中加入600 mL配置好的电解液,将金属钛片置于电解液中;向冷却池中加入足够量的冰水混合物作为冷却系统,以保证整个氧化反应过程中电解液温度保持低于20℃;实验过程中采用电动搅拌器使电解质分散均匀。
(3)设定微弧氧化电源电压值为400 V,占空比15%,频率800 Hz,氧化时间10 min;氧化完成后用去离子水冲洗试样,晾干后进行性能测试。
1.4 性能测试与分析
采用日本理学D/max2400型X射线衍射仪测定实验处理后金属钛表面的相组成,扫描范围为10°~80°,步宽为 0.02°,扫描速度 8°/min,Cu 靶 Kα射线;采用日本JSM-5910扫描电子显微镜测试分析试样表面形貌;利用扫描电子显微镜附带的能谱分析仪进行氧化物陶瓷层元素组成分析。
2 实验结果与分析
2.1 试样表面物相成分分析
图2为经过实验处理后试样表面的XRD衍射图谱。从图中可以发现,经过该实验处理后,试样表面物相组成发生了变化,主晶相不再是钛,而是锐钛矿型二氧化钛,同时还有一定量的钛、金红石型二氧化钛以及CaTiO3晶相。说明通过此实验方法可以有效地在金属钛表面形成一层以锐钛矿型二氧化钛为主晶相,同时含有钛、金红石型二氧化钛以及CaTiO3晶相的氧化物陶瓷层。有研究证明[12],锐钛矿型TiO2比金红石型TiO2更有利于诱导类骨羟基磷灰石的形成;更有利于细胞的在植入材料表面的黏附和生长,但也有学者对此结论提出了质疑[13],认为金红石型TiO2比锐钛矿型TiO2更有利于诱导类骨羟基磷灰石的形成。但有一点可以肯定,在金属钛表面形成一层TiO2氧化层(无论金红石型还是锐钛矿型)都有利于提高植入材料的生物活性。

图2 实验处理后试样表面的XRD衍射图
2.2 试样表面形貌分析
图3 为经过实验处理后试样表面形貌图。从图中可以看出,经过实验处理后试样表面形成了大量的细小孔洞,孔径约为1~3μm,孔洞分布均匀。这些孔洞的形成是微弧等离子体放电使局部氧化物陶瓷层被击穿所形成的通道。表面多孔结构有利于骨诱导作用的形成,有利于新生骨组织向材料内部生长,形成新生骨与材料的犬齿结合,提高结合强度,提高材料的生物活性;同时,多孔结构也可以降低材料表面的弹性模量,提高材料的生物力学相容性[14]。

图3 实验处理后试样表面SEM图
2.3 多孔氧化物陶瓷层的元素组成分析
经过EDS分析得出的氧化物陶瓷层的元素组成分析数据(原子含量)分别为:Ti27.98%,O 55.79%,Ca 7.76%;P 4.92%,Ca/P 1.58%,C 3.55%,XRD测定的物相为钛、锐钛矿、金红石、钛酸钙。数据与XRD分析结果基本一致。陶瓷层的主要元素组成为O和Ti,说明陶瓷层的主要成分为 TiO2。除了 Ti、O外,陶瓷层还含有Ca、P和C等元素,这说明Ca、P也参与了反应,计算得出的陶瓷层的Ca/P元素比为1.58,与人体自然骨的Ca/P元素比1.67也很接近。
分析结果表明,实验处理过程中不仅使试样表面的钛发生了氧化反应,从而生成二氧化钛陶瓷层,同时也使电解液中的部分离子在高电场的作用下参与反应沉积在陶瓷层上。微弧氧化过程中,电解液中组分进入氧化层主要靠扩散和电泳两种方式。由于电解液中的Ca主要以Ca2+的形式存在,带正电荷,因而Ca2+不可能通过正负离子自发的吸附作用而沉积在阳极试样表面,而主要是依靠电泳的方式到达试样表面;而P主要以PO4
3-或者 HPO42-形式存在于电解液中,带负电荷,则主要依靠阳极对电子的吸附作用通过扩散的方式进入试样表面[15]。研究证实,含Ca、P化合物的物相,有利于磷灰石在植入材料表面的沉积,从而有利于提高植入材料的生物活性[16]。
3 结语
通过该实验方法可以成功地在金属钛试样表面形成具有多孔结构的氧化物陶瓷层,达到改进生物医用钛材料表面性能的目的。材料表面改性是材料科学发展和研究的重要方向之一,通过将科学研究相关领域的新技术、新方法转化为本科生、研究生的实验教学项目,可以使学生及时掌握相关领域的科学研究动态,提高学生的综合分析能力和科学研究素养。
[1] Hu X X,Shen H,Shuai K G,et al.Surface bioactivity modi?cation of titanium by CO2plasma treatment and induction of hydroxyapatite:In vitro and in vivo studies[J].Applied Surface Science,2011,257:1813-1823.
[2] 冯志远,刘 斌,冉海琼,等.钛合金表面介孔二氧化钛涂层的制备与表征[J].中国组织工程研究,2012,16(8):1439-1442.
[3] Neoh K G,Hu X F,Zheng D,et al.Balancing osteoblast functions and bacterial adhesion on functionalized titanium surfaces[J].Biomaterials,2012,33:2813-2822.
[4] Kado T,Hidaka T,Aita H,et al.Enhanced compatibility of chemically modified titanium surface with periodontal ligament cells[J].Applied Surface Science,2012,262:240-247.
[5] 袁松福,潘高峰,郭彩虹.纯钛表面含丹参钙磷涂层的制备及表征[J].现代口腔医学杂志,2011,25(4):271-275.
[6] Walter N,Maria V D,Maurizio S,et al.UV-resistant amorphous fluorinated coating for anodized titanium surfaces[J].Progress in Organic Coatings,2012,74:794-800.
[7] 朱瑞富,王志刚,王爱娟,等.纯钛表面微弧氧化多孔陶瓷膜的结构特性[J].材料热处理学报,2009,30(2):129-133.
[8] 王永钱,江旭东,潘春旭.钛及钛合金表面微弧氧化技术及应用[J].材料保护,2010,43(4):15-18.
[9] Cheng S,Wei D Q,Zhou Y,et al.Characterization and properties of microarc oxidized coatings containing Si,Ca and Na on titanium[J].Ceramics International,2011,37(6):1761-1768.
[10] Yerokhin A L,Nie X ,Leyland A.Plasma electrolysis for surface engineering[J].Surface and Coatings Technology,1999,122(2、3):73-93.
[11] 赵树萍.钛及其合金微弧氧化镀层的形成及性质[J].钛工业进展,2002(3):5-8.
[12] Ik-Hyun O H, Nomura N, Masahashi N, et al. Mechanical properties of porous titanium compacts prepared by powder sintering[J].Scripta Materialia,2003,49:1197-1202.
[13] Niinomi M.Mechanical biocompatibilities of titanium alloys for biomedical applications[J].Journal of the Mechanical Behavior of Biomedical Materials,2008(1):31-42.
[14] 王蓉莉,李 卫.降低医用钛合金弹性模量的方法[J].材料导报,2010,24(3):128-131.
[15] 马楚凡,李冬梅,李贺军.微弧氧化方法在钛表面注入钙磷离子及对成骨细胞早期附着的影响[J].第一军医大学学报,2005,25(1):62-65.
[16] 尤德强,夏东升,张 鹏,等.纳米羟基磷灰石对钛基生物医用材料性能的影响[J].特种铸造及有色合金,2012,32(7):650-653.
