醋酸杆菌发酵细菌纤维素及其改性研究
2013-09-04赵秋红李彦军
张 雯,赵秋红,李彦军
(陕西科技大学,陕西西安710021)
细菌纤维素(Bacterial cellulose,简称BC)是葡萄糖以β-1,4-糖苷键聚合成的高分子化合物,与自然界广泛存在的植物纤维素相比,在纯度、持水性、透气性、物理和机械性能、生物相容性及生物可降解性等方面均具有独特的优良性能。在食品、医药、轻工等行业具有广泛的应用价值[1-4]。然而,BC 干燥后即成坚硬致密的半透明干膜,不易被液体渗透,吸水量相对较少,难以恢复到最初的溶胀状态,使其优良特性被破坏,从而限制了其应用[5]。为改善BC的再溶胀能力,提高其材料性能,本研究通过两种途径对BC进行了改性:一是在发酵培养基中分别添加水溶性多糖—羧甲基纤维素、羧甲基淀粉钠、海藻酸钠发酵生产BC;二是将普通培养基中发酵生产的BC凝胶膜或干膜分别浸渍于多羟基化合物-1,3-丁二醇、N,N-二甲基甲酰胺、甘油中进行改性。从而改善了BC材料性能,促进了其开发应用。
1 材料与方法
1.1 材料与仪器
醋酸杆菌(Acetobacter xylinum)本实验室提供;固体培养基[6]蔗糖 5%,牛肉膏 1.5%,Na2HPO40.44%,柠檬酸0.08%,乙醇1.0%,pH5.0;种子培养基 蔗糖5%,牛肉膏1.5%,Na2HPO40.44%,柠檬酸0.08%,乙醇1.0%,pH 5.0;基础发酵培养基 蔗糖5%,牛肉膏1.5%,Na2HPO40.44%,柠檬酸0.08%,琼脂1.8%,乙醇1.0%,pH 5.0;改性培养基1 基础发酵培养基添加羧甲基纤维素钠(CMCNa);改性培养基2 基础发酵培养基添加羧甲基淀粉钠(CMSCNa);改性培养基3 基础发酵培养基添加海藻酸钠(AS)。
电热恒温培养箱(MG250B)、恒温振荡器(HYG-1A)上海新瑞仪器有限公司;光学显微镜(XPS-8CA)上海光学仪器有限公司;精密电子天平(BS110S)北京赛多利斯天平有限公司;全自动X-射线衍射仪 日本Rigalcu;傅立叶变换红外光谱仪 德国Brucher公司。
1.2 实验方法
1.2.1 BC的发酵改性 分别配制基础发酵培养基及改性培养基1、改性培养基2、改性培养基3,接种醋酸杆菌(接种量10%,发酵液装量200mL/500mL烧杯),30℃静态培养4d进行BC的发酵生产,发酵结束后测定产物持水率、孔隙率、透湿性及IR、XRD检测。改性培养基中多糖添加量均为6个梯度:0、0.5%、1%、1.5%、2%、2.5%,每个样品平行3份。所得改性后样品记为样品1#~样品15#,对照组记为样品0#。
1.2.2 BC的浸渍改性 配制基础培养基发酵生产BC,发酵结束后将BC凝胶膜按1.2.3所述方法进行处理,分别浸渍在蒸馏水及多羟基化合物-丁二醇、二甲基甲酰胺、甘油中24h进行改性。浸渍结束后取出BC膜用蒸馏水充分水洗,所得改性后样品记为样品16#~样品18#。测定改性后的BC持水率、孔隙率、透湿性及IR、XRD检测。
1.2.3 测定分析方法
1.2.3.1 BC膜处理 将BC膜浸泡于0.1mol/L NaOH溶液中,80℃浸泡30min,继续加热煮沸约2h,再用蒸馏水反复冲洗,直到pH为7.2[6]。
1.2.3.2 BC膜持水率、复水率及产量测定 称重法[7-8]。
1.2.3.3 BC膜孔隙率 用介质饱和法测定[7-8]。
1.2.3.4 BC膜透湿性 用水蒸汽透过率评价[7-8]。
1.2.3.5 BC鉴定及基团分析 红外光谱(样品处理:将BC膜烘干后研成粉末,与溴化钾以1∶100比例混合充分研细,然后用压片机压片,再放入红外光谱仪中进行测定)[9]。
1.2.3.6 BC膜结晶度 X-射线衍射光谱(样品处理:将BC膜烘干后研成粉末,平铺在涂有凡士林的玻璃平板上,然后将样品放入X-衍射仪中,设定参数角为 20~40°)[9]。
1.3 数据处理方法
所有数据均用三次平行实验的平均值表示,用SPSS(PASW Statistics18)软件对数据进行处理,方差分析及多重比较中p<0.05为显著差异,记为*。
2 结果与分析
通过发酵培养基中添加CMCNa、CMSCNa、AS制备了 CMCNa-BC、CMSCNa-BC、AS-BC 3 种改性 BC膜,同时利用多羟基化合物—丁二醇、甘油和二甲基甲酰胺浸渍BC得到了三种浸渍改性膜,改性前后BC膜的持水性、复水性、孔隙率、水蒸气透过率及IR、XRD检测结果如图1~图9所示。
2.1 改性对BC膜持水性及复水性的影响
由数据分析及图1、图2可知,通过向发酵培养基中添加水溶性多糖对BC进行改性后,BC的复水率显著提高,其中培养基中加入0.5%AS的改性BC膜(样品11#)复水率可达96.58%,比改性前提高了30.3%;N,N-二甲基甲酰胺浸渍改性后BC膜(样品18#)改性产物再次溶胀后的复水率可达97.40%,比未改性BC膜增加31.4%。同时,改性后的BC膜持水率也有所上升,其中培养基中加入1.5%AS(样品13#)生产的BC膜持水率最高达98.53%,比改性前提高了2%。其原因主要在于,BC可以与水溶性多糖以糖苷键的形式结合从而改变其特殊网状结构,改性BC膜通过干燥后的硬度会有所降低,因此可提高干膜再溶胀后的复水性。而多羟基化合物作为一种“膨胀剂”,可部分取代凝胶膜中持有的水分,这些“膨胀剂”在BC膜干燥时不会随水分蒸发出去,阻止了除去水分对膜微结构的破坏,使之形成一种柔韧的膜,从而使BC干膜复水时在较短时间内可以恢复到原来的状态。而其中甘油浸渍后BC膜的持水率及复水率均明显降低主要是因为多羟基化合物可以部分或全部地取代凝胶膜中持有的水分,这些“膨胀剂”在BC膜干燥时不会随水分蒸发出去。同时实验结果表明,培养基中添加2.5%AS对BC膜合成有抑制作用,不能产生BC,其原因可能是因为发酵培养基中AS浓度过高,渗透压过大,影响了细胞代谢生产BC。
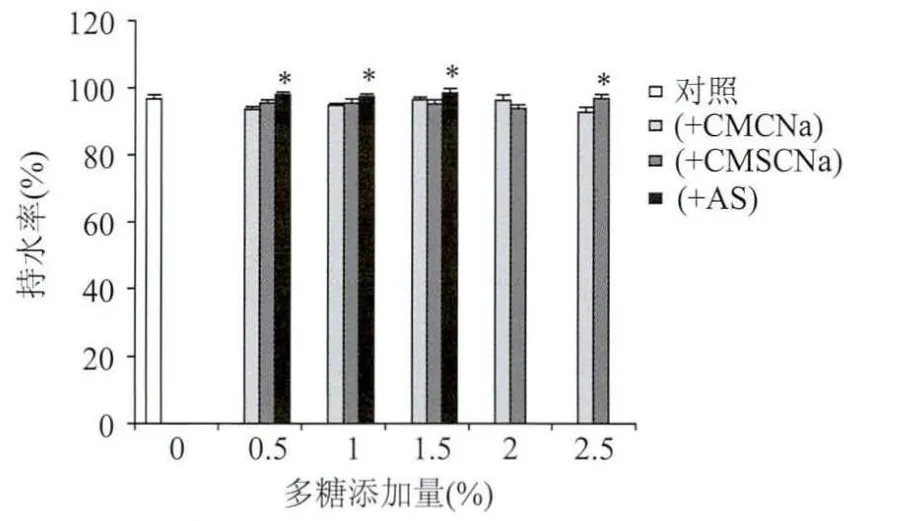
图1 发酵改性前后细菌纤维素的持水率Fig.1 Water holdup rate of bacterial cellulose before and after being modified

图2 发酵改性前后细菌纤维素的复水率Fig.2 Rehydration rate of bacterial cellulose before and after being modified
2.2 改性对BC膜孔隙率及透湿性的影响
由数据分析及图3、图4可知,培养基中加入1.5%CMCNa发酵改性的BC膜孔隙率为0.9177%,比未改性的BC膜孔隙率增加了5倍。同时,发酵改性后BC膜的水蒸气透过率均得到了不同程度的提高,培养基中加入1.0%CMSCNa发酵改性后BC膜水蒸气透过率可达8967.2g/m2×d,比未改性的BC膜水蒸气透过率增加了1倍。

图3 发酵改性前后细菌纤维素的孔隙率Fig.3 Hole rate of bacterial cellulose before and after being modified

图4 发酵改性前后细菌纤维素的水蒸气透过率Fig.4 Water vapour transmission rate of bacterial cellulose before and after being modified
2.3 改性BC膜红外光谱检测
改性前后的BC膜红外光谱图如图5~图8所示,1059cm-1左右处的吸收峰是由碳氧键的伸缩振动引起的,是纤维素分子的特征峰。在3450cm-1左右处的吸收峰,反映了分子间氢键引起的O-H基的伸缩振动。在1500cm-1和2000cm-1之间的吸收峰是由纤维素4’端的半缩醛基引起的。在1645cm-1左右处的吸收峰是由C-H键伸缩振动引起的,强度与纤维素结晶度有关。而在2920cm-1左右处的吸收峰则是由CH2-CH伸缩振动产生的,在这个区域的吸收峰是糖类的特征吸收峰。在约900cm-1的吸收峰是糖苷键的特征峰。通过红外光谱图的对比,改性后多糖的确存在于细菌纤维素中。3450cm-1处O-H、C-H吸收峰的明显增强较好地说明了羧甲基已经结合到了 BC 中。1606、1414、1645cm-1处的吸收峰,分别表明了羧甲基纤维素钠、羧甲基淀粉钠和海藻酸钠成分的存在。
2.4 改性对BC膜结晶性的影响
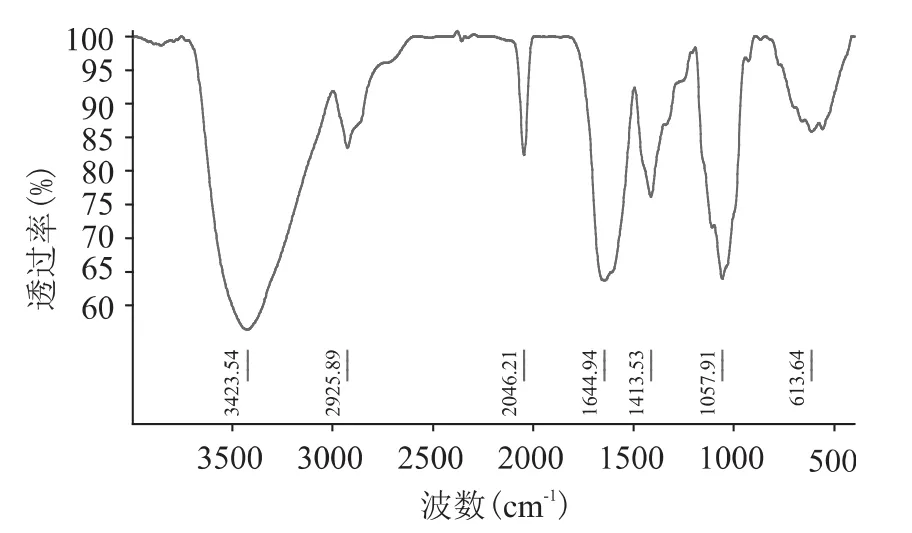
图5 改性前细菌纤维素的红外光谱图Fig.5 IR of the bacterial cellulose before being modified

图6 N,N-二甲基甲酰胺改性后细菌纤维素的红外光谱图Fig.6 IR of the bacterial cellulose after being modified by N,N-dimethylformamide

图7 培养基添加0.5%AS改性细菌纤维素的红外光谱图Fig.7 IR of the bacterial cellulose after being modified by 0.5%AS
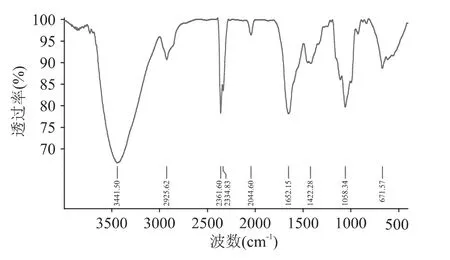
图8 培养基添加1.5%CMCNa改性细菌纤维素的红外光谱图Fig.8 IR of the bacterial cellulose after being modified by 1.5%CMCNa
改性前后的BC膜XRD光谱图如图9所示,除1,3-丁二醇浸渍改性BC膜,改性前及改性后的BC膜均能够观察到一个主峰,其对应的衍射角为22.27左右。在X-衍射中峰的比例反映了BC膜的结晶程度,由图可看出,发酵改性后峰的比例不变,强度小的变动伴随有角的改变,可知发酵培养基中添加水溶性多糖改性BC对其纤维素结晶影响不大。而1,3-丁二醇改性后BC膜XRD图谱峰的比例减弱至几乎消失,显示BC膜结晶度降低。
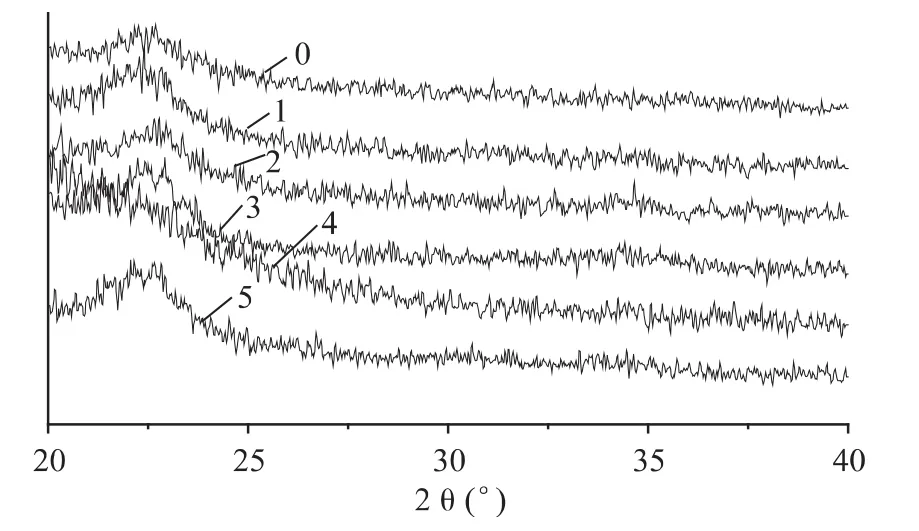
图9 改性前后细菌纤维素膜X-射线衍射光谱图Fig.9 XRD of the bacterial cellulose before and after being modified
3 结论
通过培养基中添加水溶性多糖发酵生产BC及利用多羟基化合物浸渍BC能够对BC进行改性,所得改性BC膜的持水性、复水性、孔隙率和透湿性等材料学特性均比改性前优良。培养基中添加1.5%AS所得改性BC膜持水率比改性前提高了2%;培养基中加入0.5%AS所得改性BC膜再溶胀能力比改性前提高了30.3%;N,N-二甲基甲酰胺浸渍改性所得BC膜比改性前提高了31.4%;培养基中加入1.5%CMCNa所得改性BC膜孔隙率比改性前提高了5倍;培养基中加入1.0%CMSCNa所得改性BC膜水蒸气透过率比改性前提高了1倍;发酵改性作用对细菌纤维素的结晶度影响不大。该研究为制备高性能复合BC材料、拓宽BC的应用奠定了基础。
[1]卢松华.茶水发酵法制备细菌纤维素及其相关性能研究[J].临床医学,2011,31(11):102-104.
[2]朱会霞.PVA对生物合成细菌纤维素膜拉伸性能的影响[J].高校化学工程学报,2011,25(5):822-825.
[3]Shoda M,Sugano Y.Recent advances in bacterial cellulose production[J].Biotechnol Bioprocess Eng,2005,10(1):1-8.
[4]Putra A,Kakugo A,Furukawa H,et al.Tubular bacterial cellulose gel with oriented fibrils on the curved surface[J].Polymer,2008,49(7):1885-1891.
[5]贾原媛,汤卫华,李飞,等.细菌纤维素生物医学材料的性能改进[J].天津科技大学学报,2009,24(6):17-19.
[6]张雯,齐香君.细菌纤维素生产菌株菌体细胞收集方法的研究[J].食品工业科技,2006,27(9):57-58.
[7]潘颖.细菌纤维素的制备及改性研究[D].青岛:青岛大学,2007.
[8]Putra A,Kakugo A,Furukawa H,et al.Tubular bacterial cellulose gel with oriented fibrils on the curved surface[J].Polymer,2008,49:1885-1891.
[9]Chao Y,Ishida Tsugano Y,Shoda M.Bacterial cellulose production by Acetobacter xylinum in a 50-1 internal-loop airlift reactor[J].Biotechnology Bioeng,2000,68:345-352.
