红湘莲莲皮粉提取物的抗氧化性能
2013-09-04汪江英黄师荣
王 超,汪江英,时 磊,黄师荣
(湘潭大学化工学院,湖南湘潭411105)
油脂和含油脂食品易于发生氧化反应,导致营养价值和感官品质的下降,甚至变质。添加抗氧化剂能有效地防止食品氧化而变质。近年来,合成抗氧化剂如BHA、BHT和TBHQ等由于有较大的毒副作用,现已被限制或停止使用[1-3]。许多研究表明,植物中的许多物质,尤其是多酚类物质,具有很强的抗氧化作用,可以延缓脂类氧化酸败[3-4],而且安全低毒。因而从植物材料中寻找天然抗氧化物质越来越受到人们的欢迎,对植物提取物有效成分抗氧化活性的研究和开发日益受到重视。莲皮粉是工业上生产磨皮莲子的副产物,大约占莲子重量的5%~10%。这些副产物通常被用作低效的肥料和动物饲料,或者当作垃圾直接丢弃,未能充分利用,而且会污染环境。本实验以红湘莲莲皮粉为原料,选取甲醇和乙醇作为溶剂对莲皮粉进行提取,提取液经减压浓缩后制成提取物。用操作简便、重现性较好、适应性较强、成本较低的DPPH自由基清除法和还原力法研究了两种提取物的清除自由基作用和还原能力,并用Schaal烘箱法,通过检测油脂初期氧化产物的过氧化值和共轭二烯值以及检测油脂氧化终产物的p-茴香胺值等指标全面地研究了乙醇提取物的抗菜籽油的氧化作用,旨在为莲皮粉的应用开辟新的领域。
1 材料与方法
1.1 材料与仪器
红湘莲莲皮粉 由湖南宏兴隆湘莲食品有限公司提供;菜籽油(未添加任何抗氧化剂) 湖南省长康实业有限责任公司;DPPH(1,1-二苯基-2-苦基肼)日本和光纯药工业株式会社;p-茴香胺(99%)百灵威科技有限公司;BHT(化学纯)国药集团化学试剂有限公司;Folin酚试剂 合肥博美生物科技有限公司;无水甲醇、无水乙醇、没食子酸、三氯乙酸、氯仿、冰乙酸、淀粉、异辛烷、碳酸钠、铁氰化钾、氯化铁、碘化钾、硫代硫酸钠均为分析纯。
RE-2000A旋转蒸发器 上海雅荣生化设备仪器有限公司;SPX-250B-D型振荡培养箱 上海博讯实业有限公司医疗设备厂;UV-2802SH型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;DZ-2BCⅡ真空干燥箱 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 莲皮粉提取物的制备 称取在60℃下干燥至恒重的莲皮粉20g,加入200mL无水甲醇或无水乙醇(1∶10,w/v),在振荡器上室温下提取24h,真空抽滤,得到滤液。滤渣在相同条件下再提取一次,合并两次滤液,在40℃以下用旋转蒸发仪浓缩得到提取物。
1.2.2 总酚含量测定 总酚含量按文献[5]方法测定,稍作修改,具体操作如下:在1mL浓度为1mg/mL的提取物溶液中加入2.5mL稀释10倍的福林酚试剂和2mL浓度为7.5g/100mL的碳酸钠溶液,样品在50℃下保温5min后冷却,以蒸馏水代替提取物作为对照,在760nm处测吸光度。用没食子酸做标准曲线,得到的回归方程为:A=14.286C+0.335,相关系数R2=0.9998,式中A为标准品溶液在760nm处的吸光度,C为标准品溶液的浓度(mg/mL)。实验结果表示为mg没食子酸当量/g提取物。
1.2.3 DPPH自由基清除作用的测定 按文献[6]中的方法进行测定。分别取不同浓度(0.2~5mg/mL)的提取物溶液3mL与3mL浓度为200μmol/L的DPPH乙醇溶液混合,使 DPPH的最终浓度为100μmol/L,振摇,置于暗处30min后于517nm处测吸光度,并以BHT作为阳性对照,按下式计算DPPH自由基清除率:
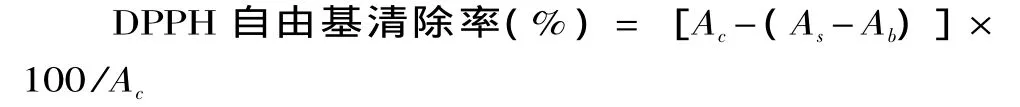
式中:Ac为3mL无水乙醇 +3mL DPPH溶液(200μmol/L)的吸光度;As为3mL提取物溶液+3mL DPPH溶液(200μmol/L)的吸光度;Ab为3mL无水乙醇+3mL提取物溶液的吸光度。
1.2.4 还原力测定 还原力测定按文献[7]的方法进行,具体操作如下:分别取1mL不同浓度的提取物,与2.5mL磷酸钠缓冲液(0.2mol/L,pH 6.6)和2.5mL 1%(w/v)的铁氰化钾溶液充分混合,于50℃水浴条件下保温20min后加入2.5mL 10%(w/v)的三氯乙酸,激烈振摇后离心10min,取上清液2.5mL与2.5mL蒸馏水和0.5mL三氯化铁(0.1%,w/v)的混合液反应30min后,于700nm波长处测吸光度。用BHT作为阳性对照。
1.2.5 莲皮粉乙醇提取物抗菜籽油氧化实验 用Schaal烘箱法进行。
1.2.5.1 油样的制备 分别称取提取物0.100、0.300g,BHT 0.020g于烧杯中,分别用3mL无水乙醇溶解,再加入菜籽油 100g,制备成 0.1%、0.3%和0.02%的混合液,空白组加3mL无水乙醇作对照。将上述所有样品于室温下在磁力搅拌器上搅拌5min,使添加物与油样混合均匀,然后将油样在40℃下真空干燥30min,以除去其中的乙醇。所得试样敞口置于(60±1)℃的电热鼓风干燥箱中避光保存。每隔一定时间充分搅拌一次并交换油样在烘箱中的位置,每3d定时取样测定油样的过氧化值、p-茴香胺值和共轭二烯值。
1.2.5.2 过氧化值的测定 按文献[1]中的方法进行测定。准确称取2.00~3.00g混匀的油样于250mL碘量瓶中,加入氯仿-冰乙酸混合液(2∶3,v/v)30mL以溶解油样,再加入1.00mL饱和 KI溶液,加塞振摇30s。在暗处放置10min后取出迅速加水100mL,摇匀后用Na2S2O3标准溶液(0.002moL/L)滴定至淡黄色,再加入0.5%(wt%)淀粉指示液1.00mL,继续用Na2S2O3标准溶液滴定至蓝色消失。平行测定3次,同时作空白实验。按下式计算样品的过氧化值(POV,meq/kg):
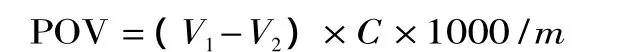
式中:V1、V2分别为样品、空白滴定时所消耗Na2S2O3标准溶液体积,mL;C为Na2S2O3标准溶液的浓度,mol/L;m为油样质量,g。
1.2.5.3 p-茴香胺值的测定 按文献[1]中的方法进行测定。准确称取油样1.000~1.500g于25mL容量瓶中,用异辛烷溶解并稀释至刻度,得油样溶液。以异辛烷作参比,用1cm比色皿在350nm波长处测定油样溶液的吸光度(Ab)。取具塞试管两支,在第一支试管中加入油样溶液5mL,在第二支试管中加入5mL异辛烷,再在两支试管中各加入1mL浓度为0.25%(w/v)的p-茴香胺冰醋酸溶液,加塞后振荡混匀。10min后,以第二支试管内的溶液作参比,用1cm比色皿在350nm处测定第一支试管内溶液的吸光度(As)。p-茴香胺值(AV)按下式计算:

式中:As为与p-茴香胺试剂反应后油脂溶液的吸光度;Ab为油脂溶液的吸光度;m为油脂的质量,g。
1.2.5.4 共轭二烯值的测定 按文献[5]报道的方法进行。称取油样0.02~0.04g,加入到25mL容量瓶中,用异辛烷定容至刻度,充分混合。用异辛烷做空白对照,在波长为234nm处测定油样溶液的吸光度(A234)。按下式计算共轭二烯值(CD):

式中:A234为油样溶液在234nm处的吸光度;L为比色皿长度,cm;C为油样溶液的浓度,g/100mL。
2 结果与讨论
2.1 提取率和总酚含量
由于具有无毒和价廉等优点,乙醇是从植物中提取抗氧化物质的常用的有机溶剂。甲醇也是广泛用于提取抗氧化物质的有效溶剂,许多研究表明[8-9],甲醇提取物的抗氧化活性最高,也最稳定。在本研究中,用甲醇和乙醇作溶剂从红湘莲莲皮粉中提取了抗氧化物质,用Folin-Ciocalteu法测定了提取物中的总酚含量。所得提取物的提取率和总酚含量如表1所示。从表中可以看出,莲皮粉的甲醇和乙醇提取物的提取率分别为16.10%±0.52%和5.97% ±0.71%,总酚含量分别为51.47±0.35、(99.7±0.88)mg没食子酸当量/g提取物。甲醇提取物的提取率是乙醇提取物的2.7倍,总酚含量却为乙醇提取物的一半左右。这一结果表明,甲醇对莲皮粉中的酚类物质提取更有效。甲醇提取物的提取率较高,可能是由于甲醇的极性比乙醇大,提取的物质相对较多的缘故。
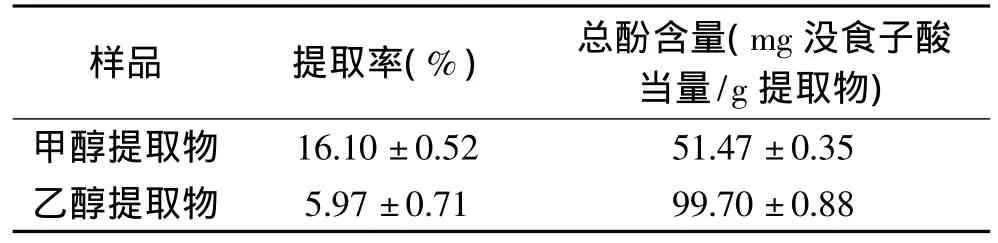
表1 莲皮粉提取物的提取率和总酚含量Table 1 Extraction yield and total phenolic content of the methanol and ethanol extracts from lotus seed peel
2.2 DPPH自由基清除作用
图1给出了莲皮粉提取物和BHT对DPPH自由基的清除作用。由图可以看出,各样品对DPPH自由基都有很好的清除作用,在一定浓度范围内对自由基的清除率随浓度增大而逐渐增大,随着浓度进一步增大,对自由基的清除率趋于平稳。浓度为0.2mg/mL时,甲醇提取物和乙醇提取物对自由基的清除率分别为85.58%和87.28%。这些结果表明,两种提取物对DPPH自由基均有显著的清除作用。但它们的清除作用比BHT的低。

图1 莲皮粉提取物对DPPH自由基的清除率Fig.1 DPPH radical scavenging activities of extracts from lotus seed peel
DPPH自由基清除作用的半抑制浓度 IC50为DPPH自由基的清除率达到50%时的样品浓度,在一定程度上反映了抗氧化性能的强弱[10]。IC50越小,对自由基清除作用越大,抗氧化性也越强。通过origin程序拟合计算得出BHT、甲醇提取物和乙醇提取物对DPPH自由基清除作用的 IC50分别为:0.014、0.078、0.073mg/mL。各试样对DPPH自由基清除作用的大小依次为:BHT>乙醇提取物>甲醇提取物。
2.3 还原力
还原力是物质抗氧化能力的一个重要指标。许多研究表明[11-12],植物提取物的抗氧化活性与其还原力存在对应关系。
图2为不同浓度的提取物的还原力。由图可以看出,所有样品的还原力均随着浓度的增加而增加,所有浓度下各样品均显示出一定程度的还原能力。常用EC50来表征还原力的大小,表示在700nm处吸光度为0.5时对应的测试样品浓度,EC50越小,样品的还原力越大,抗氧化性也越强。由图2可以得到各样品的还原力大小顺序为:BHT>乙醇提取物>甲醇提取物。
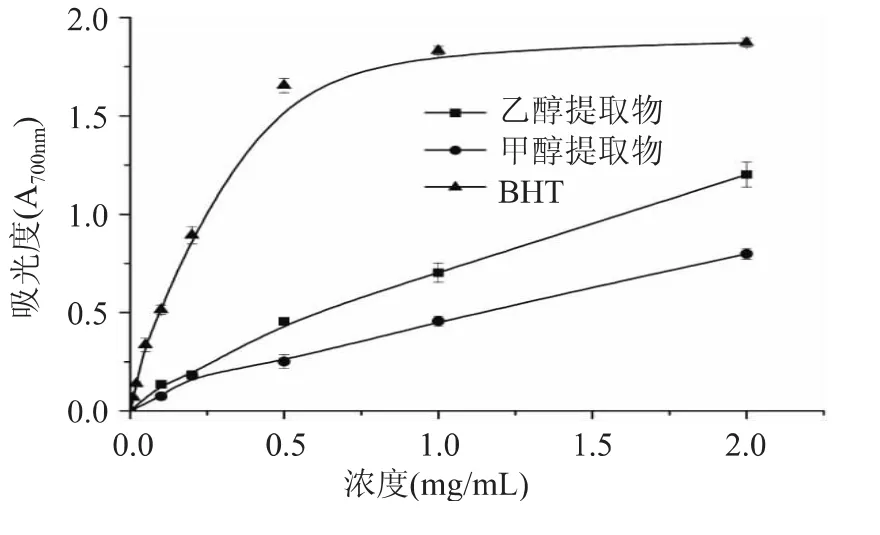
图2 莲皮粉提取物的还原力Fig.2 Reducing power of extracts from lotus seed peel
2.4 乙醇提取物抗油脂氧化效果
从上述实验结果可以看出,莲皮粉乙醇提取物的DPPH自由基清除力、总酚含量和还原力均高于甲醇提取物。考虑到乙醇价格低廉,无毒以及更适合于食品级的抗氧化提取物的制备,研究了莲皮粉乙醇提取物对菜籽油的抗氧化效果。
2.4.1 过氧化值 0.1%和0.3%的莲皮粉提取物以及0.02%的BHT对菜籽油过氧化值的影响如图3所示。由图可知,所有样品的过氧化值均随着保藏时间的延长而逐渐增加,添加莲皮粉乙醇提取物和BHT的油样的过氧化值均低于空白组且较空白组增加缓慢,表明莲皮粉提取物对菜籽油有一定的抗氧化作用。两种浓度提取物的抗氧化作用均强于0.02%的BHT。结果表明莲皮粉乙醇提取物能有效阻止菜籽油的氧化作用。

图3 油样的过氧化值随时间的变化Fig.3 Changes in peroxide value over time in rapeseed oil samples
2.4.2 p-茴香胺值 p-茴香胺值是用来评价油脂氧化终产物的一项指标,该值的大小可以直接反映油脂中醛类化合物含量的高低,进而反映油脂的酸败程度;p-茴香胺值越大,说明油脂氧化程度越高。图4给出了不同菜籽油样品的p-茴香胺值随保藏时间的变化情况。由图可以看出,所有样品的p-茴香胺值均随着保藏时间的延长而逐渐增加,添加莲皮粉乙醇提取物和BHT的油样的p-茴香胺值均比空白组的低,添加0.3%提取物的油样的p-茴香胺值比添加0.1%提取物的低,表明莲皮粉提取物能显著抑制菜籽油的次级氧化产物的形成,而且,添加0.3%提取物的效果要好于添加0.1%的,但它们的效果均优于0.02%的BHT。
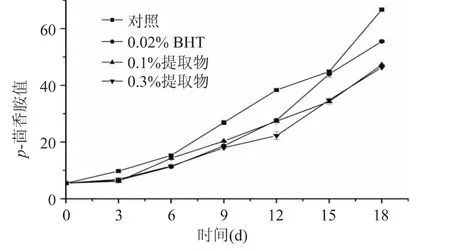
图4 油样的p-茴香胺值随时间的变化Fig.4 Changes in p-anisidine value over time in rapeseed oil samples
2.4.3 共轭二烯值 油脂在自动氧化过程中,会产生大量的共轭二烯酸,在234nm有最大吸收。共轭二烯值反映氧化早期阶段脂质氧化的程度,其值越大油脂的氧化稳定性越低。图5为各处理油样的共轭二烯值随时间的变化情况。由图可知,各样品的共轭二烯值随着保藏时间的延长而增加,其中对照样品增加的速率最大,表明莲皮粉乙醇提取物具有一定的抗油脂氧化的潜力。对照样品保藏18d后,其共轭二烯值从最初的5.27增加到21.23,显著高于其他样品的。添加两种浓度的提取物均可显著降低菜籽油样品的共轭二烯值,它们的效果均强于0.02%的BHT。

图5 油样的共轭二烯值随时间的变化Fig.5 Changes in conjugated dienes value over time in rapeseed oil samples
3 讨论与结论
许多研究表明,酚类化合物对天然植物提取物的抗氧化活性有重要贡献[13-14]。本研究发现,莲皮粉乙醇提取物的总酚含量比甲醇提取物的高,乙醇提取物的DPPH自由基清除能力和还原力也更强。这一结果表明,提取物的抗氧化活性与其中的总酚含量有一定的相关性,提取物中的总酚含量对其抗氧化活性有较大的贡献。
目前,用来评价植物和食品成分抗脂类氧化活性的测试方法种类众多,常用的包括用来检测脂类初期氧化产物的过氧化值法、共轭二烯值和硫氰酸铁法,以及用来检测脂类氧化终产物的硫代巴比妥酸测试法、p-茴香胺值法和羰基值法等。这些方法都各有其优缺点,单凭一种方法进行评价还不足以具有说服力。要全面和科学地评价抗氧化物质的对脂类的抗氧化活性,至少需要二种以上的方法进行测定[15]。本研究用过氧化值法,共轭二烯值法和p-茴香胺值法全面地评价了莲皮粉乙醇提取物对菜籽油的抗氧化作用。结果显示添加0.1%和0.3%的提取物均可以有效地减缓油脂样品过氧化值、共轭二烯值和p-茴香胺值的增加,而且效果比0.02%的BHT还强,添加0.3%提取物的效果要优于添加0.1%的。这些结果说明提取物可以有效地抑制菜籽油氧化,而且抑制能力与添加量存在剂量效应关系。
莲皮粉甲醇和乙醇提取物均具有较高的总酚含量以及较强的DPPH自由基清除能力和还原力,是有效的自由基清除剂,其中乙醇提取物的总酚含量更高,抗氧化性更强,两者间存在一定的相关性。莲皮粉乙醇提取物抗菜籽油氧化实验表明,提取物能有效地抑制油脂氧化,抑制能力与添加量具有剂量效应关系,添加0.1%和0.3%提取物的抗氧化效果比0.02%的BHT还强。本研究结果表明,莲皮粉可作为食用油脂天然抗氧化剂的潜在来源。
[1]Mohdaly AAA,Sarhan MA,Mahmoud A,et al.Antioxidant efficacy of potato peels and sugar beet pulp extracts in vegetable oils protection[J].Food Chemistry,2010,123:1019-1026.
[2]王晓波,钟婵君,刘冬英,等.火龙果皮总黄酮对油脂抗氧化作用的研究[J].食品研究与开发,2012,33(3):19-23.
[3]何童森,李媛,侯栋,等.山楂黄烷醇抗油脂氧化作用研究[J].食品工业科技,2012,33(2):97-99.
[4]张俊生,陈莉华,段琛圭,等.车前子中黄酮提取物对油脂的抗氧化活性研究[J].中国粮油学报,2012,27(2):62-67.
[5]Mariod AA,Ibrahim RM,Ismail M,et al.Antioxidant activity of the phenolic leafextractsfrom Monechma ciliatum in stabilization of corn oil[J].J Am Oil Chem Soc,2010,87:35-43.
[6]Shi J,Gong J,Liu J,et al.Antioxidant capacity of extract from edible flowers of Prunus mume in China and its active components[J].LWT-Food Science and Technology,2009,42:477-482.
[7]Dong J,Zhang M,Lu L,et al.Nitric oxide fumigation stimulates flavonoid and phenolic accumulation and enhances antioxidant activity of mushroom[J].Food Chemistry,2012,135:1220-1225.
[8]Ozen T,Demirtas I,Aksit H.Determination of antioxidant activities of various extracts and essential oil compositions of Thymus praecox subsp.skorpilii var.skorpilii[J].Food Chemistry,2011,124:58-64.
[9]Hossain MA,Rahman SMM.Total phenolics,flavonoids and antioxidant activity of tropical fruit pineapple[J].Food Research International,2011,44:672-676.
[10]周昇昇.抗氧化能力体外评价方法的进展和比较[J].卫生研究,2010,39(2):164-167.
[11]Babbar N,Oberoi HS,Uppal DS,et al.Total phenolic content and antioxidant capacity of extracts obtained from six important fruit residues[J].Food Research International,2011,44:391-396.
[12]Bursal E,Köksal E.Evaluation of reducing power and radical scavenging activities of water and ethanol extracts from sumac(Rhus coriaria L.)[J].Food Research International,2011,44:2217-2221.
[13]López A,Rico M,Rivero A,et al.The effects of solvents on the phenolic contents and antioxidant activity of Stypocaulon scoparium algae extracts[J].Food Chemistry,2011,125:1104-1109.
[14]Laura A Rosa D,Alvarez- parrilla E,et al.Phenolic compounds and antioxidant activity of kernels and shells of Mexican Pecan(Carya illinoinensis)[J].J Agric Food Chem,2011,59:152-162.
[15]张文博.植物样品成分的体外抗氧化活性方法研究进展[J].广州化工,2011,39(24):14-16.
