纳他霉素-羟丙基-β-环糊精包合物的抗菌活性及稳定性研究
2013-09-04张志敏张美丽
王 燕,毛 勇,李 飞,张志敏,张美丽,邓 媛
(陕西省微生物研究所,陕西西安710043)
纳他霉素(Natamycin)也称游链霉素、匹马菌素(Pimaricin)或海松素[1],是一种多烯烃大环内酯类的抗真菌物质,对各种霉菌和酵母菌有高度抑制能力。纳他霉素因其很难被人畜的消化道吸收,目前研究表明它对人畜无致癌、致畸和致敏等有害作用[2],所以作为一种天然的生物防腐剂已被批准用于某些乳制品、肉类、饮料、水果等许多食品的生产和保藏之中[3]。但是由于纳他霉素水溶性非常低(30~50mg/L)且不稳定,造成纳他霉素的生物利用度很低,成为它在行业中应用的限制因素,影响了其制剂的开发[4]。环糊精(cyclodextrin,简称CD)是由环状糊精葡萄糖基转移酶(CGTase)作用于淀粉得到的由6、7、8…个吡喃葡萄糖单元以α-1,4键连接的环状低聚糖,结构外形为“圆锥状花环”,空腔内部为疏水性空间,外部两侧为亲水区域,能够包合许多天然和人工合成的化合物分子,增加客体分子的稳定性和溶解性[4-5]。其衍生物羟丙基-β-环糊精(HP-β-CD),可破坏环糊精分子内氢键,在保持环糊精空腔的同时又克服了环糊精分子低水溶性的缺点,显著提高客体分子的水溶性[6]。苏柘僮等人[7]研究表明,胆酸经 HP-β-CD包合后,溶解度增加11.81倍。魏海涛等人[8]研究表明,氟苯尼考-β-环糊精包合物在水中的溶解度平均约为氟苯尼考原药的5.78倍。国外学者John L Koont Z等人[9]研究显示,经 HP-β-CD 包合后纳他霉素的溶解度增加了约152倍。国内学者熊伟等人[10]研究显示,经 HP-β-CD 包合后纳他霉素的溶解度增加了约200多倍。本研究是以HP-β-CD包合后的纳他霉素为材料,首先测定了包合物中纳他霉素在水溶液中的溶解度,然后对包合后纳他霉素的抗菌活性及生物稳定性进行研究,以期获得溶解度高、抗菌活性好且稳定性强的纳他霉素,为纳他霉素的防腐应用提供理论依据。
1 材料与方法
1.1 材料与仪器
纳他霉素-HP-β-CD包合物 实验室自制;纳他霉素(纯度90%)安泰生物科技有限公司;孟加拉红琼脂培养基 北京陆桥生物科技有限公司生产,批号为:1110182;HP-β-CD(含量98%)西安立德生物药物科技有限公司;酵母菌2.394(Saccharomycescerevisiae)、白色念珠菌 2.2086(candida Albicans)、绳状青霉 3.3872(Penicillium funiculosum)、黄曲霉3.3950(Aspergillus flavus)、黑曲霉 3.5387(Aspergillusniger)、米 曲 霉 3.2924(Aspergillusoryzae)、米 根 霉 3.2686(Rhizopus oryzae)、绿色木霉 3.2941(Trichoderma viride),镰刀菌3.2835(Fusarium)由陕西省微生物所菌种保藏中心提供。
TU1901紫外可见分光光度计 北京普析通用仪器有限公司;ZHWY-211C恒温振荡器 上海智城分析仪器制造有限公司;MJX-160/250C霉菌培养箱上海博讯实业有限公司医疗设备厂;GXZ智能光照培养箱 宁波东南仪器有限公司;GH-600ASB隔水培养箱 北京科伟永兴仪器有限公司;PHSJ-4A型实验室PH计 上海精密科学仪器有限公司;强云牌ZSZ石英紫外线杀菌灯 北京强云特种灯泡厂;二孔A电热恒温水浴锅 北京科伟永兴仪器有限公司;BS224S电子精密天平 德国塞多利斯。
1.2 实验方法
1.2.1 纳他霉素的含量测定
1.2.1.1 测定波长选择 取适量纳他霉素,加甲醇溶解,配制成一定的浓度,另取适量的羟丙基-β-环糊精用甲醇溶解配成溶液,分别用紫外分光光度计在200~400nm范围内进行扫描。寻找纳他霉素的最大吸收峰并确保羟丙基-β-环糊精在此处无吸收,以确定实验最佳检测波长。
1.2.1.2 标准曲线的绘制 精密称取1.0mg纳他霉素对照品,加入到100mL的容量瓶中,用蒸馏水定容到100mL,配制成10mg/L的纳他霉素标准品水溶液,标记为母液。将母液作相应稀释,依次配制成2.0、4.0、6.0、8.0、10.0mg/L 的纳他霉素标准品水溶液,在最佳波长处测定吸收度,以吸收度(A)对质量浓度(C)进行线性回归,得出线性回归方程。
1.2.1.3 纳他霉素含量的测定 将包合物和对照品做相应稀释后,在紫外分光光度计最佳波长处测定吸收度,利用线性回归方程,计算得出包合物和对照品中纳他霉素的含量。
1.2.2 溶解度测定 采用平衡法:分别将过量包合物和对照品加入溶剂中,25℃的恒温振荡仪,以150r/min速率进行平衡溶解,经0.45μm孔径滤膜过滤后取上清液测定303nm处吸收度,平行测量三次,取平均值。
1.2.3 包合物的抑菌性研究 此次实验采用琼脂稀释法测定在1×105cfu/mL菌液浓度下包合物和对照品的最低抑菌浓度(MIC)。通过观察平板上实验菌株的生长情况,以无菌生长的浓度为MIC,表明药物对实验菌株有抑制作用,单一菌落生长的可忽略不计。
将纳他霉素有效含量为40mg/kg的包合物溶液和对照溶液各取不同的量加入到灭菌冷却至45℃的定量孟加拉红琼脂培养基中,混合均匀,倾注平板,每个浓度倾注两个平皿。待其凝固后即为含不同纳他霉素浓度的培养基。分别接种1×105cfu/mL各菌液0.1mL,涂布,28℃培养72h,观察待测菌的生长情况。
1.2.4 纳他霉素包合物稳定性实验
1.2.4.1 紫外照射对包合物中纳他霉素稳定性的影响 将包合物和对照品分别处理配制成含相同适宜浓度的纳他霉素的水溶液,各取20mL置于无菌平皿内,同时放置在紫外光照强度20W,距离30cm处照射0、15、30、45、60、75、90min,以不处理的样品为空白对照,根据1.2.1方法测定纳他霉素相对含量。每组数据测量三次取平均值。
纳他霉素相对含量(%)=A303(纳他霉素测定)/A303(纳他霉素初始)×100
1.2.4.2 光照对包合物中纳他霉素稳定性的影响将包合物和对照品分别处理配制成含相同适宜浓度的纳他霉素的水溶液,分别取20mL加入到具塞的石英试管中,同时放置在光照培养箱(4500LX)中照射0、2、4、6、8、10d,以不处理的样品为空白对照,根据1.2.1方法测定纳他霉素相对含量。每组数据测量三次取平均值。
1.2.4.3 温度对包合物中纳他霉素稳定性的影响将包合物和对照品分别处理配制成含相同适宜浓度的纳他霉素的水溶液,分别平均分为5份,每份20mL,分别置于50、80、100、120℃条件下处理 0、30、60、90、120min,以未进行温度处理的样品做为空白对照,根据1.2.1方法测定纳他霉素相对含量。每组数据测量三次取平均值。
1.2.4.4 氧化剂对包合物中纳他霉素稳定性影响将包合物和对照品分别处理配制成含相同适宜浓度的纳他霉素的水溶液,分别加入1%双氧水搅拌均匀作用 0、15、30、45、60、75、90min,以不加入双氧水的样品为空白对照,根据1.2.1方法测定纳他霉素相对含量。每组数据测量三次取平均值。
1.2.4.5 pH对包合物中纳他霉素稳定性影响 将包合物和对照品分别处理配制成含相同适宜浓度的纳他霉素的水溶液,分别平分9份,每份20mL,分别调pH 为 2、3、4、5、6、7、8、9、10,静置 1h,以不处理的样品为空白对照,根据1.2.1方法测定纳他霉素相对含量。每组数据测量三次取平均值。
2 结果与分析
2.1 检测波长与标准曲线的确定
据1.2.1.1结果显示纳他霉素在303nm处有最大吸收峰,而羟丙基-β-环糊精在此处无吸收,故选303nm为最佳检测波长。据1.2.1.2结果显示回归方程为 A=0.1727C-0.0012,r2=0.9995,表明纳他霉素吸收度与质量浓度在2.0~10.0mg/L内呈良好的线性关系。
2.2 包合物中纳他霉素的水溶度
由表1可知:包合物中纳他霉素的最大水溶度为61.58×103mg/L,是同等条件下对照品最大水溶度(34.37mg/L)的1792倍。实验结果证明:羟丙基-β-环糊精的包合能大幅度提高纳他霉素的水溶度。

表1 包合物中纳他霉素的水溶度Table 1 The water solubility of natamycin in the inclusion complex
2.3 包合物的最小抑菌浓度(MIC)
由表2可知:在1×105cfu/mL菌液浓度下,包合物和对照品对8种常见真菌的MIC值完全相同。二者对黄曲霉的MIC值略有不同:包合物的MIC值为5mg/kg,而对照的MIC值为6mg/kg,说明包合物对黄曲霉的抑菌效果强于对照品。实验结果证明:经羟丙基-β-环糊精包合后的纳他霉素,其原本的抑菌能力没有减弱。
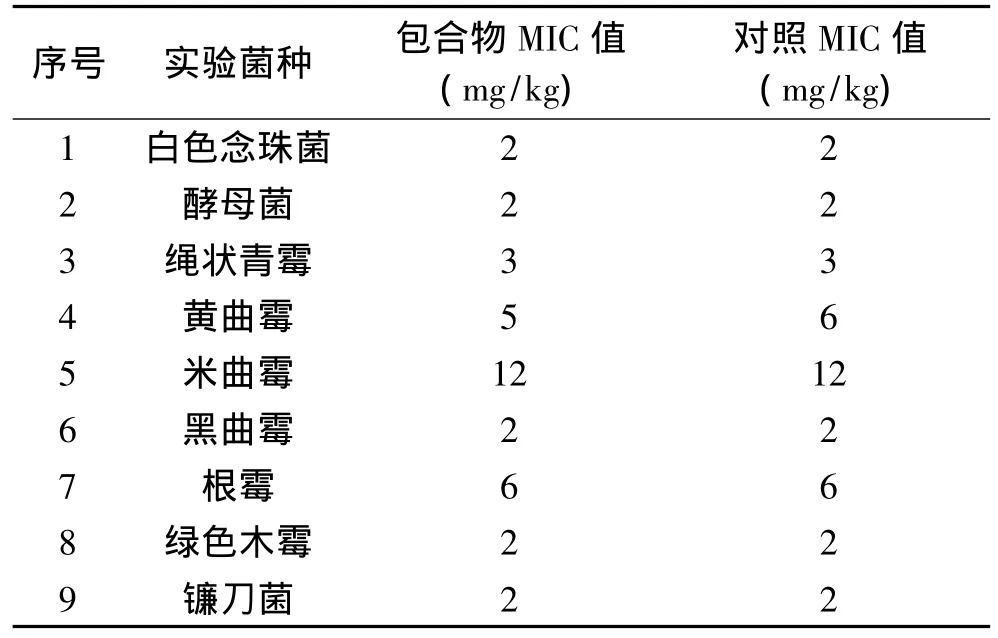
表2 包合物的最小抑菌浓度值(MIC)Table 2 The MIC of the inclusion complex
2.4 紫外照射对包合物中纳他霉素稳定性的影响
由表3可知:紫外线照射(强度20W,距离30cm处)90min对包合物和对照品中的纳他霉素相对含量影响较大:包合物中纳他霉素的相对含量由100%降低到61.90%,损失率为38.1%;对照品中纳他霉素的相对含量由100%降低到31.05%,损失率为68.95%。但是在紫外处理15~90min的整个过程中,包合物中纳他霉素相对含量值始终高于对照品。这是由于纳他霉素在紫外光下分解,失去其中的四烯结构所致稳定性变差,而羟丙基-β-环糊精的包合,增加了纳他霉素对紫外线的稳定性。
2.5 光照对包合物中纳他霉素稳定性的影响
由表4可知:光照(4500LX)处理10d对包合物和对照品中纳他霉素相对含量影响较大:包合物中纳他霉素的相对含量由100%降低到46.59%,损失率为53.41%;对照品中纳他霉素的相对含量由100%降低到34.56%,损失率为65.44%。但是在日光处理2~10d的整个过程中,包合物中纳他霉素相对含量均高于对照品。这是由于在纳他霉素的分子结构中,含有共轭不饱和的碳双键,容易自氧化,光照在一定程度上促进了这种氧化作用。而羟丙基-β-环糊精的包合,增加了纳他霉素对光照的稳定性。
2.6 温度对包合物中纳他霉素稳定性的影响
由表5 可知:当温度 50、80、100、120℃处理 30~90min时,包合物与对照品中纳他霉素相对含量均较高(大于80%);当120℃处理120min后,对照品中纳他霉素的相对含量降低到80%以下,而包合物中纳他霉素的相对含量仍高于80%。但是在整个处理过程中,包合物中纳他霉素相对含量始终高于对照品。这是由于纳他霉素具有一定的抗热处理能力,能耐受短暂高温,而羟丙基-β-环糊精的包合,增加了纳他霉素在较高温度环境中的稳定性。
2.7 氧化剂对包合物中纳他霉素稳定性的影响
由表6可知:1%双氧水处理90min,对包合物和对照品中纳他霉素相对含量影响较明显:包合物中纳他霉素的相对含量由100%降低到36.03%,损失率为63.97%;对照品中纳他霉素的相对含量由100%降低到35.79%,损失率为64.21%。但是在1%双氧水处理15~90min的整个过程中,包合物中纳他霉素相对含量始终高于对照品。可见羟丙基-β-环糊精的包合,在一定程度上增加了纳他霉素对1%双氧水的稳定性。

表3 紫外线照射对包合物中纳他霉素稳定性的影响Table 3 Effect of ultraviolet light to natamycin’s stability in the inclusion complex

表4 光照对包合物中纳他霉素稳定性的影响Table 4 Effect of fluorescent lamp to natamycin’s stability in the inclusion complex

表5 温度对包合物中纳他霉素液稳定性的影响Table 5 Effect of temperature to natamycin’s stability in the inclusion complex

表6 1%双氧水对包合物中纳他霉素稳定性的影响Table 6 Effect of hydrogen peroxide to natamycin’s stability in the inclusion complex

表7 pH对包合物中纳他霉素稳定性影响Table 7 Effect of pH to natamycin’s stability in the inclusion complex
2.8 pH对包合物中纳他霉素稳定性的影响
由表7可知:在pH4~9的范围内,包合物和对照品的抑菌活性残留率均较高(大于80%);在pH<4和pH>9时,pH对包合物和对照品的抑菌活性残留率影响均较大。但在整个pH2~10的范围内,包合物中纳他霉素的相对含量始终高于对照品。因为强酸强碱容易使纳他霉素分子结构中的共轭的不饱和双键降解,但是羟丙基-β-环糊精包合后,会使纳他霉素的稳定性有所提高。
3 结论与讨论
3.1 纳他霉素应用中存在的问题
纳他霉素作为一种抗真菌剂在医疗、青储饲料、粮储、家禽养殖等方面有较好的抗菌效果,特别是在食品原料保鲜、成品防腐方面的应用显示了良好的前景[11]。但是由于低水溶性的缺点,严重地制约了纳他霉素更广泛的开发利用。近几年各国学者对难溶分子主要通过生物转化法,在分子骨架上添加极性基团,如胆酸盐[12]、改性多糖[13-15],直接达到增溶的目的[16]。但其结果总是存在一定的缺陷:或者会显示出较低的生物活性、或者会降低生物稳定性有的甚至还会产生毒性。
3.2 羟丙基-β-环糊精的增溶效果
环糊精(CD)由于外缘亲水而内腔疏水,它能够像酶一样提供一个疏水的结合部位,作为主体包络各种适当的客体,从而有效地增加一些水溶性不良的分子在水中的溶解度和溶解速度。环糊精有多种同系物,目前应用最广泛的是 β-环糊精。羟丙基-β-环糊精是β-环糊精的衍生物之一,对许多化合物具有良好的包合作用,不仅能提高被包合物的水溶性,而且具有在生物体内提高被包络药物的释放速度和生物稳定性的作用。
3.3 纳他霉素-羟丙基-β-环糊包合物的优良性能
3.3.1 增加了纳他霉素的水溶性 包合物中纳他霉素最大水溶度为61.58×103mg/L,对照品的最大水溶度为34.37mg/L,前者的溶解度是后者的1792倍。羟丙基-β-环糊精的包合,极大地提高了纳他霉素的水溶性。
3.3.2 提高了纳他霉素的生物稳定性 经过紫外线照射15~90min、光照处理 2~10d、温度(50、80、100、120℃)处理 30~120min、1%的双氧水处理 15~90min或在pH2~10条件下作用1h后,包合物中纳他霉素的相对含量与对照品相比均有增高的趋势。羟丙基-β-环糊精的包合,提高了纳他霉素的生物稳定性。
3.3.3 保持了纳他霉素良好的抗菌性 在1×105cfu/mL菌液浓度下,包合物和对照品对8种常见真菌的MIC值完全相同,且包合物对黄曲霉的抑菌效果要优于对照品。羟丙基-β-环糊精的包合,使纳他霉素保持了良好的抗菌性。
可见纳他霉素-羟丙基-β-环糊包合物,不仅能大幅提高纳他霉素的水溶性,还能提高其生物稳定性,同时又不降低其抗菌活性,为日后纳他霉素-羟丙基-β-环糊包合物的工业化生产提供理论基础并且为纳他霉素的应用提供了更多的空间。
[1]赵宏阳.多烯类抗菌剂纳他霉素[J].河北化工,2009,32(7):47-48.
[2]尤新.功能性发酵制品[M].北京:中国轻工业出版社,2000:350-361.
[3]Davidson P M,Doan C H.Natamycin Antimicrobials in Foods[M].New York,Basel and Hongkong:Marcel Dekker Inc,1993:395-407.
[4]高玉荣,王雪萍.天然抗真菌食品生物防腐剂-纳他霉素的性质及在食品中的应用[J].农产品加工,2009(5):7-9.
[5]Martin M,Del V.Cyclodextrins and their uses a review[J].Proess Biochem,2004(39):1033-1046.
[6]陶涛.羟丙基倍他环糊精的特性及其药剂学应用[J].中国医药工业杂志,2002,33(6):304-306.
[7]苏柘僮,杨明,吴品江,等.胆酸-羟丙基-β-环糊精包合物的制备工艺及相溶解度研究[J].中成药,2009,31(3):380-382.
[8]魏海涛,宋敏,李亮华,等.氟苯尼考-β-环糊精包合物的研制[J].华南农业大学学报,2009,30(4):94-97.
[9]John L,Koontz,Joseph E,et al.Formation of natamycin:cyclodextrin inclusion complexes and their characterization [J].Agric Food Chem,2003(51):7106-7110.
[10]熊伟,扬放,李蔷薇,等.2-羟丙基-β-环糊精对纳他霉素的增溶作用[J].中国抗生素杂志,2009,34(5):53-55.
[11]岳昊博,岳喜庆,李靖,等.纳他霉素(Natamycin)的特性、应用及生产和研究状况[J].食品科技,2007(3):162-166.
[12]张琼,李林,魏东芝,等.胆酸盐/脂类混合胶束对疏水性姜黄素的增溶性能[J].华东理工大学学报,2010,36(5):639-644.
[13]王亚南,王洪权.2-羟丙基-β-环糊精对抓诺昔康的增溶作用[J].解放军药学学报,2006,22(2):147-148.
[14]王茹林,杨郁,双少敏,等.β-环糊精衍生物对黄酮类药物的增溶作用[J].应用化学,2002(1):702-704.
[15]陈圆圆,刘佳佳,唐课文,等.羟丙基-β-环糊精对萘普生的增溶及稳定性作用[J].光谱实验室,2007,24(4):632-636.
[16]方继前,郭亚军,谢练武.生物转化法定向结构改造难溶性药物[J].现代化工,2010,30(8):32-36.
