紫苏乳状液酶解破乳工艺的研究
2013-09-04张雅娜江连洲冯红霞隋晓楠
张雅娜,李 杨,2,江连洲,2,*,王 妍,张 妍,冯红霞,隋晓楠
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江省哈尔滨150030)
紫苏(perilla frutescens(Linn.)britton),别名:赤苏、红苏、黑苏、红紫苏、皱紫苏等,其种子称为苏子,其叶称为苏叶,属桃金娘科蒲桃属,系唇形科(Labiate)一年生草本植物,原产于中国,广泛分布在中国、日本、韩国、越南、土耳其和美国[1]。紫苏籽是一种独特的保健油料作物,从紫苏籽中提取的紫苏油含有丰富的α-亚麻酸,含量可达56.1%~64.8%,远远高于其他植物油[2],近年来备受国内外学者瞩目。水酶法是一种新的油脂提取技术,它具有作用条件温和、避免使用有机溶剂等优势[3]。但目前很多研究表明,在酶解过程中会形成稳定的乳化体系,是由于在乳状液中大部分油脂和蛋白紧密结合[4],阻碍油脂释放[5-6],降低油脂提取率,因此,打破乳状液的稳定性,使油脂能够充分的释放出来,已经成为水酶法在提油工艺中的瓶颈问题。目前已有越来越多的研究集中到破乳工艺上[7-9]。其常用破乳方法有:转相法[10-11]、加热法[12-13]、冷冻解冻法[12,14-17]、酶法[18]、调整pH法[19-21]、剪切法[22-23]等。目前酶解破乳已应用在大豆水酶法提油过程中[24-25],应用酶法进行破乳能够尽量减少乳状液的稳定性,从而提高油的回收率。本实验对紫苏水酶法过程中形成乳状液的酶解破乳工艺进行研究,应用不同酶(Protex 6L、Protex 7L、Alcalase 2.4L)对乳状液进行破乳,首先对酶种类进行选择,选出最佳酶,并在单因素的基础上选择出最佳酶解破乳参数,再利用响应面法对紫苏乳状液酶法破乳工艺进行优化。
1 材料与方法
1.1 材料与仪器
紫苏 产自长白山;Cellulase 丹麦诺维信公司;Alcalase 2.4L 丹麦诺维信公司;Protex 6L、7L 无锡杰能科生物工程有限公司;Viscozyme L 丹麦诺维信公司;乙醚、石油醚、乙醇、正己烷 北京昊科尔化工有限公司;氢氧化钠 宜兴市辉煌化学试剂厂,分析纯;其他试剂 均为分析纯。
JY-9211N超声波细胞粉碎机 宁波新芝生物科技股份有限公司;JE-502电子天平 上海浦春计量仪器有限公司;MJ-60BE01B美的料理机 广东美的精品电器制造有限公司;HH-4丹瑞数显恒温水浴锅 金坛市双捷实验仪器厂;PHS-25C数字酸度计上海大普仪器有限公司;LGR20-W台式高速冷冻离心机 北京京立离心机有限公司;BGZ-246电热鼓风干燥箱 上海博讯实业有限公司医疗设备厂;BCD-215cm美的冰箱 合肥美的荣事达电冰箱有限公司;KDN-103F自动定氮仪、HYP-1040四十孔消化炉 上海纤检仪器有限公司;SCT-02索氏抽提器 天津玻璃仪器厂;SX-4-10箱式电阻炉 天津市泰斯特仪器有限公司;Agillent 6890-5973气相色谱-质谱联用仪 安捷伦科技有限公司。
1.2 实验方法
实验工艺流程见图1。
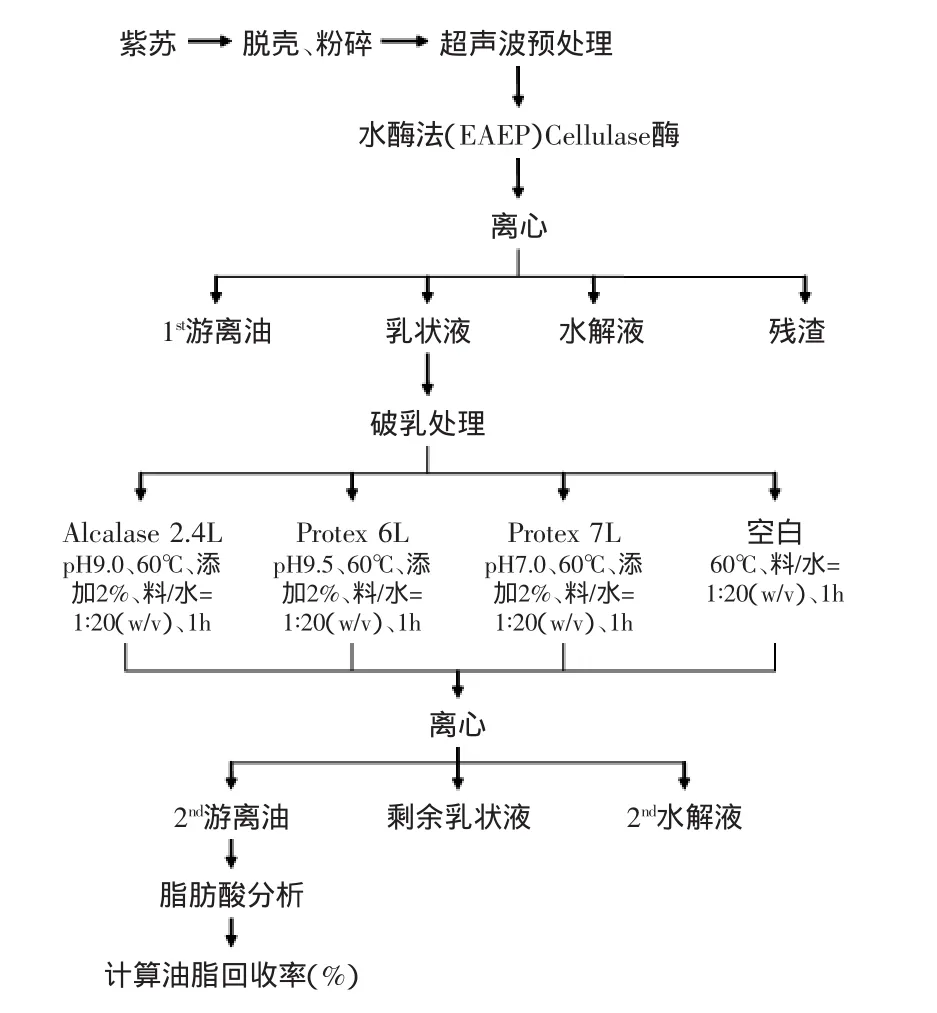
图1 实验工艺流程Fig.1 Experimental procedure flow
1.2.1 紫苏主要成分的测定 水分的测定:根据GB304-87进行测定;粗脂肪的测定:根据GB5512-85中索氏抽提法进行测定;粗蛋白的测定:根据GB6432-94进行;灰分测定:根据GB5009.4-85进行测定。
1.2.2 紫苏籽脱壳处理 紫苏籽用脱壳机进行脱壳

式中,乳状液含油量测定方法参照1990-AOAC Method,AOAC 955.19[27]。
1.2.7 二次酶解破乳的单因素实验
1.2.7.1 pH对二次酶解破乳油脂回收率的影响 实验选择在Protex-6L碱性蛋白酶的工作pH范围内(pH=8~10)。在温度60℃,酶添加量2%(乳状液质量的2%),酶解1h,乳状液/水=1∶20(w/v)的条件下,分别考察了pH为8.0、8.5、9.0、9.5和10.0对酶解紫苏乳状液的影响,并测其油脂回收率。
1.2.7.2 酶解温度对二次酶解破乳油脂回收率的影响 实验选择Protex-6L碱性蛋白酶的工作温度范围(50~70℃)。在pH=9.5、酶添加量2%(乳状液质量的2%)、酶解1h、乳状液/水=1∶20(w/v)的条件下,分别考察了温度在50、55、60、65和70℃对酶解紫苏乳状液的影响,并测其油脂回收率。
1.2.7.3 加酶量对二次酶解破乳油脂回收率的影响实验选择酶添加量范围为1%~3%。在pH=9.5、酶解温度60℃、酶解1h、乳状液/水=1∶20(w/v)的条件下,分别考察了底物浓度在1%、1.5%、2%、2.5%和3%时对酶解紫苏乳状液的影响,并测其油脂回收率。
1.2.7.4 酶解时间对二次酶解破乳油脂回收率的影处理,利用风机将壳除去,脱壳后的紫苏籽立即用于提取实验或放入两层的封口袋中密封并储存在4℃的冰箱中,用于进一步实验。
1.2.3 粉碎处理 准确称取30g脱壳清理后的紫苏籽,料理机干磨Ⅱ档粉碎15s,用180mL的蒸馏水冲洗三次搅拌杯内壁,要求搅拌杯内壁冲洗完全干净,然后倒入500mL烧杯中,用于进一步实验。
1.2.4 超声预处理 将步骤1.2.3中装有紫苏料的烧杯放入超声波细胞破碎仪中进行超声处理,条件为:时间20min,功率400W,温度40℃。超声处理后的紫苏籽进行下一步水酶法酶解实验。
1.2.5 水酶法乳状液的制备 如图1所示。超声预处理后,将装有紫苏料的500mL烧杯置于60℃的水浴锅中,用2mol/L的HCl溶液/NaOH溶液调整pH5.0,加入3%(紫苏籽质量的3%)的Cellulase酶,搅拌3h以进行酶解。酶解结束后进行离心操作(10000r/min、20℃、40min),离心后分为四层(游离油、乳状液、水解液、残渣),最上层游离油用正己烷萃取,用蒸气浴挥发充分后进行称量计数,剩余的乳状液和水解液倒入500mL分液漏斗中,4℃下静止12h,分离出乳状液置于已称重的烧杯中,用于进一步破乳实验[26]。
1.2.6 酶破乳处理的方法 图1显示了二次酶解破乳处理的破乳条件(酶的种类、加酶量、酶解时间、酶解温度、pH、料液比w/v)及后续步骤,其中,pH为每一种酶的最佳pH,由厂家说明书指定。每次破乳实验重复3次。空白处理不添加酶,其余与三种酶法破乳的条件一致,破乳处理后,样品转移到50mL离心管中,20℃10000r/min下离心40min,离心后,通过巴斯德吸管吸取上层游离油,剩下的残留在乳状液表面的游离油用正己烷洗涤、蒸气浴挥发后准确称量油重,并计算油脂回收率。油脂回收率计算公式如下:响 实验在pH=9.5、酶解温度60℃、酶添加量2%(乳状液质量的2%)、乳状液/水=1∶20(w/v)的条件下,分别酶解0.5、1、1.5、2、2.5h,考察酶解时间对酶解紫苏乳状液的影响,并测其油脂回收率。
1.2.8 响应面实验 以单因素为基础,利用Design Expert 7.1.1软件,采用响应面实验对二次酶解破乳酶解参数进行优化。表1为实验设计方案。

表1 Box-Behnken实验设计Table 1 Box-Behnken experimental design
1.2.9 实验设计与统计分析 乳状液的提取和对乳状液的每步处理均独立操作三次。因此,所有油脂回收率的计算都是3个数的平均数。实验以单因素为基础,利用Design Expert 7.1.1软件设计,进一步对二次酶解破乳酶解参数进行优化。
1.2.10 紫苏油脂肪酸分析方法
1.2.1 0.1 紫苏籽脂肪酸甲酯的制备 称取油脂或脂肪酸50mg置于10mL量瓶内,加入3mL正己烷和苯的混合溶剂(1∶1)轻轻摇动使之溶解。再加入2mL 0.5mol/L氢氧化钾-甲醇溶液,混匀。在室温静置30min,加蒸馏水使全部有机相甲酯溶液升至瓶颈上部。澄清后吸取上清液,所得清液即可用于气相色谱-质谱联用仪分析。
1.2.1 0.2 GC-MS分析条件 色谱条件:色谱柱为HP-88(100m×0.25mm×0.20μm)弹性石英毛细管柱;载气为He气;载气流量为1mL/min;进样口温度为250℃;初始温度80℃,保持5min,以10℃/min升温到150℃,保持2min,再以5℃/min升温至230℃,保持10min,总分析时间为40min,进样模式为split,分流比30∶1,进样量0.2μL。
质谱条件:电离方式EI,电子能量70eV,四级杆温度为150℃,离子源温度230℃,传输线温度为250℃,质谱扫描范围50~550amu。
2 结果与分析
2.1 紫苏籽的主要成分及乳状液中的油脂含量
参照AOAC 955.19方法测得紫苏乳状液中油脂含量为39.96%。本实验材料紫苏籽的主要成分如表2所示。

表2 紫苏籽的主要成分Table 2 Main components of the perilla frutescens seeds
2.2 单因素实验结果
2.2.1 不同酶的破乳处理 由图2可知,用Protex 6L进行二次酶解破乳,得到油脂回收率为69.56%,破乳效果最好;而空白实验组的油脂回收率为30.91%,破乳效果最差;Alcalase 2.4L和Protex 7L破乳效果处于两者之间。不加酶的油脂回收率低于添加酶的油脂回收率,结果表明蛋白酶能够破坏紫苏乳状液的稳定性,对油脂的回收具有重要意义。因此,选择Protex 6L进行以下实验。
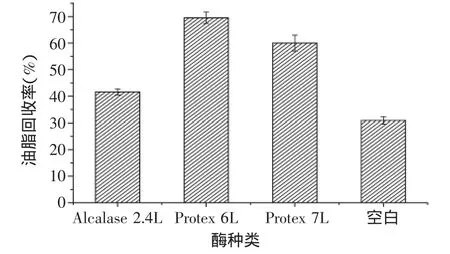
图2 不同酶二次酶解破乳油脂的回收率Fig.2 The econdary hydrolysis de-emulsification oil recovery yield of different enzyme
2.2.2 pH对二次酶解破乳油脂回收率的影响 由图3可知,当pH小于9.5时,随着pH的增加,油脂回收率逐渐增加;当pH为9.5时,油脂回收率最高,为75.56%;pH在9.5以后,油脂回收率反而降低;当pH为10时,油脂回收率最低。因此,最适酶解pH为9.5。主要原因是Protex 6L的最适pH接近9.5,pH在9.5附近时酶活高,酶对底物作用效果明显,油脂回收率最高。

图3 不同pH对二次酶解破乳油脂回收率的影响Fig.3 Effect of pH on the econdary hydrolysis de-emulsification oil recovery yield
2.2.3 酶解温度对二次酶解破乳油脂回收率的影响由图4可知,随着温度的升高,油脂回收率增加,当温度为60℃时,油脂回收率最高,而后随着温度的升高,油脂回收率反而逐渐降低。因为温度超过了Protex6L的最适温度,导致酶活性降低,同时温度过高会使酶变性,使酶的活性中心结构受到破坏,部分或全部失去催化活性[28]。因此,最适的酶解温度为60℃。
2.2.4 加酶量对二次酶解破乳油脂回收率的影响由图5可知,随着加酶量的增加,油脂回收率显著上升,添加量达到2%时,油脂回收率最大;当添加量超过2%后,油脂回收率变化不明显,趋于稳定。主要原因是酶添加量增加,使酶与底物可以充分接触,酶能够渗透到脂质体膜内,并且酶对脂蛋白的分解作用有利于油脂从油脂-蛋白的复合体中释放出来[29]。考虑到经济效益,油脂回收率几乎接近的条件下,最佳的加酶量选为2%。

图4 不同酶解温度对二次酶解破乳油脂回收率的影响Fig.4 Effect of hydrolysis temperature on the econdary hydrolysis de-emulsification oil recovery yield
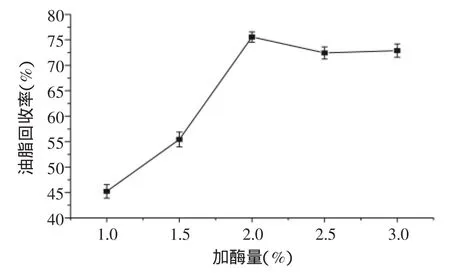
图5 不同加酶量对二次酶解破乳油脂回收率的影响Fig.5 Effect of enzyme dosage on the econdary hydrolysis de-emulsification oil recovery yield
2.2.5 酶解时间对二次酶解破乳油脂回收率的影响由图6可知,当酶解时间少于1.5h时,油脂回收率随酶解时间增加呈现快速上升趋势,变化较明显;而当酶解时间高于1.5h时,油脂回收率随着时间的增长反而逐渐降低,但变化较平缓。因为随着酶解时间的增加,底物不断减少,酶解充分,但酶解时间过长,油脂与空气长时间接触,会影响油的品质,而且时间长能耗相对较高,从经济效益的角度考虑酶解时间不宜过长,因此,综合考虑最适的酶解时间为1.5h。
2.3 响应面法对二次酶解破乳工艺条件的优化

图6 不同酶解时间对二次酶解破乳油脂回收率的影响Fig.6 Effect of hydrolysis time on the econdary hydrolysis de-emulsification oil recovery yield
运用Design Expert 7.1.1统计分析软件,在单因素实验的基础上,采用响应面中心组合实验设计,研究二次酶解破乳各酶解参数对考察指标的影响规律,并得到二次酶解破乳的最佳条件。以二次破乳各酶解工艺参数pH(x1)、酶解温度(x2)、加酶量(x3)、酶解时间(x4)为自变量,以乳状液中油脂回收率为响应值设计了四因素五水平的响应面分析实验,其因素水平编码表见表1;响应面共设计了30个实验点,包括24个分析因点和6个零点,响应面实验方案及结果见表3。

表3 Box-Behnken实验设计与结果Table 3 Box-Behnken design and experimental results
2.4 方差分析
通过统计分析软件Design Expert 7.1.1对数据进行多元回归拟合,对油脂回收率(y)与pH(x1)、酶解温度(x2)、加酶量(x3)和酶解时间(x4)之间建立二次响应面回归模型如下:y=85.04-0.76x1+1.04x2+0.061x3+1.64x4-2.79x1x2-1.07x1x3+2.96x1x4-1.23x2x3+0.45x2x4-2.31x3x4-2.61-2.15-1.20x32-5.70x42。
回归与方差分析结果见表4。

表4 回归与方差分析结果Table 4 Variance analysis of the fitted regression model for oil recovery yield
对该回归模型进行显著性检验,方差分析结果见表4。从表4中可以看出,该模型一次项x4、交互项x1x2、x1x4、x3x4和二次项x12、x22、x32、x42的影响极显著(p<0.01),一次项x2、交互项x1x3、x2x3的影响显著 (p<0.05),其他项不显著,表明各因素对于油脂回收率的影响不是简单的线性关系。该模型回归极显著(p<0.001),失拟误差不显著,并且R2=0.9659,R2Adj=0.9341,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,实验误差小,可以用此模型来分析和预测水酶法提取紫苏油的结果。因此,上述二次回归方程模型是合适的。由F检验可以得出因子贡献率为:x4>x2>x1>x3,即酶解时间>酶解温度>pH>加酶量。
2.5 响应面分析
应用响应面寻优分析方法对回归模型进行分析,当酶解时间为1.6h,酶解温度为62.6℃,pH为9.4,加酶量为1.9%,响应面最优值为85.524%±0.74%。
图7为各交互项的响应曲面图。由图7分析结果可以看出:pH(x1)与酶解温度(x2),pH(x1)与加酶量(x3),pH(x1)与酶解时间(x4),酶解温度(x2)与加酶量(x3),加酶量(x3)与酶解时间(x4)的相互作用对油脂回收率的影响。由此可知,在加酶量为1.0~3.0范围内,加酶量对油脂回收率的因子贡献率虽然小,但其与其他因素的交互作用对油脂回收率影响较大。
2.6 验证实验

图7 各交互显著项对紫苏油脂回收率影响的响应面图Fig.7 Response surface of Each significant interaction effect on oil recovery yield of perilla frutescens oil
在酶解时间为1.6h、酶解温度为62.6℃、pH为9.4、加酶量为1.9%条件下进行3次平行实验,得到平均油脂回收率为85.52%。响应值的实验值与回归方程预测值吻合良好,说明该模型能够较好预测实际紫苏油提油及破乳情况。
2.7 紫苏油脂肪酸分析

图8 紫苏油气相色谱图Fig.8 Gas-phase chromatogram of perilla frutescens oil

表5 紫苏油中主要的脂肪酸种类及含量Table 5 Main fatty acid compositions and contents of perilla frutescens oil
本实验得到的紫苏油呈淡黄色,澄清透明,具有紫苏独特的香味。由图8及表5可知,对紫苏油脂肪酸甲酯进行GC-MS分析,根据GC-MS联用仪获得质谱信息经数据库检索与标准谱图对照,分析了肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸、α-亚麻酸、花生酸7种主要组分,利用面积归一化法分别对各种脂肪酸的质量分数进行定量,结果表明,紫苏油脂肪酸的质量分数分别为:肉豆蔻酸0.46%、棕榈酸9.38%、硬脂酸6.81%、油酸22.11%、亚油酸12.23%、α-亚麻酸53.10%、花生酸0.52%。
3 结论
利用响应面进行优化得出二次酶解破乳的最佳条件为:Protex 6L酶解时间为1.6h,酶解温度为62.6℃,pH为9.4,加酶量为1.9%,紫苏油脂回收率为85.52%。得到的紫苏油呈淡黄色,澄清透明,具有紫苏独特的香味。提取的紫苏油经脂肪酸分析得到7种脂肪酸,质量分数分别为:肉豆蔻酸0.46%、棕榈酸9.38%、硬脂酸6.81%、油酸22.11%、亚油酸12.23%、α-亚麻酸53.10%、花生酸0.52%。
[1]Seo W H,Baek H H.Characteristic aroma-active compounds of Korean Perilla(Perilla frutescens Britton)leaf[J].J Agric Food Chem,2009,57:11537-11542.
[2]于长青,赵煜,朱刚,等.紫苏油的营养和药用价值研究[J].中国食物与营养,2007(8):47-48.
[3]王瑛瑶,王璋,罗磊.水酶法提花生油中乳化油性质及破乳方法[J].农业工程学报,2008,24(12):259.
[4]WUA J,JOHNSON L A,JUNG S.Demulsification of oil-rich emulsion from enzyme-assisted aqueous extraction of extruded soybean flakes[J].Bioresource Technology,2009,100(2):527-533.
[5]王璋,许时婴,林岚,等.酶法从全脂大豆中同时制备大豆油和大豆水解蛋白工艺的研究[J].无锡轻工业学院学报,1994,13(3):180-191.
[6]钱俊青,何国庆.水相酶解大豆蛋白的条件及其油脂分布的影响[J].浙江大学学报:工业版,2001,35(6):684-688.
[7]LAMSAL B P,JOHNSON L A.Separating oil from aqueous extraction fractions of soybean[J].Journal of the American Oil Chemists Society,2007,84(8):785-792.
[8]CHABRAND R M, KIM H J, ZHANG Cheng, et al.Destabilization of the emulsion formed during aqueous extraction of soybean oil[J].Journal of the American Oil Chemists Society,2008,85(4):383-390.
[9]杨慧萍,王素雅,宋伟,等.水酶法提取米糠油的研究[J].食品科学,2004,25(8):106-109.
[10]Sugarman N.Processing for Extraction of Oil and Protein Simultaneously from Oil-bearing Materials[J].US patent,1956,2:762-820.
[11]Lusas,EW,Lawhon JT,Rhee KC.Producing edible oil and protein from oilseeds by aqueous processing[J].Oil Mill Gaz,1982(4):28-34.
[12]Morales Chabrand R,Hyun-Jung K,Cheng Z,et al.Destabilization of the emulsion formed during aqueous extraction of soybean oil[J].J Am Oil Chem Soc,2008,85:383-90.
[13]McClements DJ.Food emulsions:principles,practice,and techniques[M].2nd end.Boca Raton FL:CRC Press,2005:161-232.
[14]Harada T,Yokomizi K.Demulsification of oil-in-water emulsion under freezing conditions:Effect of crystal structure modifier[J].J Am Oil Chem Soc,2000,77:859-63.
[15]Roxas PG.Recovering Oils from Oleaginous Meats of Nuts,Beans,and Seeds[J].US patent,1963(3),083,365.
[16]Embong MB,Jelen P.Technical feasibility of aqueous extraction of rapeseed oil a laboratory study[J].J Inst Can Sci Technol Aliment,1977(10):239-243.
[17]Chabrand RM,Kim H-J,Zhang C,et al.Destabilization of emulsion formed during aqueous extraction of soybean oil[J].J Am Oil Chem Soc,2008,85:383-390.
[18]郭玉宝,裘爱泳,薛正莲,等.盐效应对油茶籽油水相萃取的影响[J].中国油脂,2010,35(9):22-24.
[19]Lamsal BP,Johnson LA.Separating oil from aqueous extraction fractions of soybean[J].J Am.Oil Chem.Soc,2007,85:785-792.
[20]Wu J, Johnson LA, Jung S.Demulsification of oil-rich emulsion from enzyme-assisted aqueous extraction of extruded soybean flakes[J].Bioresour Technol,2009,100:527-533.
[21]Zhang SB,Wang Z, Xu SY.Optimization of the aqueous enzymatic extraction of rapeseed oil and protein hydrolysates[J].J Am Oil Chem Soc,2007,84:97-105.
[22]Hagenmaier RD,Cater CM,Mattil KF.Critical unit operations of the aqueous processing of fresh coconuts[J].J Am Oil Chem Soc,1972,49:178-181.
[23]Rhee KC,Cater CM,Mattil KF.Simultaneous recovery of protein and oil from raw peanuts in an aqueous system[J].J Food Sci,1972,37:90-93.
[24]Lamsal BP,Johnson LA.Separating oil from aqueous extraction fractions of soybean[J].J Am Oil Chem Soc,2007,84:785-92.
[25]Morales Chabrand R,Hyun-Jung K,Cheng Z,et al.Destabilization of the emulsion formed during aqueous extraction of soybean oil[J].J Am Oil Chem Soc,2008,85:383-90.
[26]Lamsal B,Johnson L.Separating Oil from aqueous extraction fractions of soybean[J].J Am Oil Chem Soc,2007,84:785-792.
[27]AOAC.Official Methods of Analysis,15th ed.Association of Official Analytical Chemists[S].Washington DC,1990.
[28]徐效圣,潘俨,傅力,等.响应面法优化水酶法提取核桃油的工艺条件[J].食品与机械,2010,26(2):92-96.
[29]易建华,朱振宝,赵芳.酶的选择对水酶法提取核桃油的影响[J].中国油脂,2007,32(2):27-29.
