油橄榄叶提取物中橄榄苦苷稳定性及对亚铁离子的螯合作用
2013-09-04谢普军黄立新张彩虹王成章
谢普军,黄立新,*,张彩虹,游 凤,王成章,周 昊
(1.中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏南京210042;2.中国林业科学研究院林业新技术研究所,北京100091)
橄榄苦苷是一种属于裂环烯醚萜苷类特殊单萜化合物,普遍存在于木犀属、女贞属、丁香属等油橄榄树的植物组织中[1]。作为油橄榄树代表物质,学者对它的研究颇多。经一些学者研究发现,油橄榄树的组织中橄榄苦苷含量因不同品种、地区和时间而不同[2],与油橄榄树的其他组织相比,油橄榄树叶的含量最高[3]。从1908年至今,从橄榄油里发现具有苦涩味的物质橄榄苦苷[4],经过100多年的研究发现橄榄苦苷具有多种药理生物活性,如抗炎、抗各种微生物、抗氧化、抗肿瘤、抗癌和降血糖[5-10]等。橄榄苦苷的诸多活性使其在食品、药品和化妆品方面应用十分广泛[11],现已有橄榄苦苷的相关产品问世。另外研究学者报道了很多有关橄榄苦苷提取分离富集和加工成产品等方面内容[12-13],而这些往往疏忽了加工过程中橄榄苦苷变化的研究。并且笔者通过查阅国内外文献发现,大量文献主要集中在橄榄苦苷的提取分离及一些生物活性方面的研究,仅Malik等[14]报道了将新鲜采摘后的油橄榄叶立即放置于-80℃贮存,然后对其进行解冻实验,结果发现,在室温条件下解冻30min后,因β-葡萄糖苷酶作用使其降解了95%;而其他因素如光、pH等对橄榄苦苷作用并未详细阐述,并且关于油橄榄叶加工过程中橄榄苦苷可能发生的变化也未见其他报道。基于此,本文首次通过控制不同光源、pH、温度和时间,研究了不同因素对油橄榄叶提取物中橄榄苦苷的变化情况。由于Fe2+是许多氧化反应催化剂的活性中心,抑制Fe2+与催化剂的基体结合也就意味着起到了一定的抗氧化作用,因此同时也考察了油橄榄叶提取物对Fe2+的螯合作用,为油橄榄叶的有效利用提供数据及理论基础。
1 实验材料与方法
1.1 材料与仪器
油橄榄叶 佛奥品种;橄榄苦苷标准品 天津一方科技有限公司(批号:10082613);2,6-二叔丁基-4-甲基苯酚(BHT,分析纯),抗坏血酸(VC,分析纯)西安沃尔森生物技术有限公司;菲洛嗪 分析纯;乙二胺四乙酸(EDTA)分析纯;甲醇 色谱纯;乙醇 分析纯;正己烷 分析纯;异丙醇 色谱纯;去离子水 自制。
AR2140电子天平 梅特勒-托利多仪器(上海)有限公司;旋转蒸发仪 上海东玺制冷仪器设备有限公司;WK-400A高速药物粉碎机 青州市精诚机械有限公司;HH-4数显水浴锅 江苏省金坛市荣华仪器制造有限公司;SHZ-D(Ⅲ)循环水式真空泵 上海东玺制冷仪器设备有限公司;超声波清洗器 南京垒君达超声电子设备有限公司;LC-20A高效液相色谱(包括LC-20ATvp,SPD-20A紫外检测器,色谱工作站LC-Solution)日本岛津株式会社;HT-130色谱柱恒温箱 天津市恒奥科技发展有限公司;Hypersil ODS2色谱柱 大连依利特分析仪器有限公司(批号:11164);TG-DSC 美国赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 油橄榄叶提取物的制备 采用自然阴干的油橄榄叶(佛奥品种),粉碎至40~60目,存储于阴暗干燥处备用。精确称取50g上述备用的油橄榄叶粉于提取容器中,75%乙醇-水溶液作为提取溶剂,进行超声辅助提取[12]。得到的收集液再过AB-8大孔树脂进行纯化[15],经过旋转蒸发除去乙醇并最后通过真空冷冻干燥制得的油橄榄叶提取物,所获得的提取物再经HPLC分析测定其中橄榄苦苷的含量(Oleuropein,27.3%)。
1.2.2 橄榄苦苷溶液的制备 精确称取1g油橄榄叶提取物于500mL的容量瓶中,用30%乙醇溶解并得到浓度为2mg/mL溶液,作为本实验中的母液。
1.2.3 光对橄榄苦苷稳定性的影响 从母液中移取50mL至具塞透明玻璃瓶中,分别使用不同光源:日光灯(2000Lux)、254nm的紫外灯等对其进行照射,并与在黑暗环境中做对比,照射时间为1h,每隔10min检测其中的橄榄苦苷含量。
1.2.4 温度对橄榄苦苷稳定性的影响 从母液中移取50mL至具塞透明玻璃瓶中,在不同水浴温度50~100℃静置3h,检测其中橄榄苦苷含量的变化。
为了继续研究温度对橄榄苦苷的影响,使用橄榄苦苷标准品,并对其做TG-DSC分析,考察高温条件下,是否对橄榄苦苷造成分解。
1.2.5 时间对橄榄苦苷稳定性的影响 从母液中吸取50mL溶液至具塞玻璃瓶中,分别在4、25℃的黑暗条件下放置27d,定期对其进行检测以观察橄榄苦苷含量的变化。
1.2.6 不同pH对橄榄苦苷稳定性的影响 首先用0.1mol/L的HCl和0.1mol/L的NaOH调节pH,配制成不同pH1~14,分别取1mL不同pH的水溶液与4mL的母液混合均匀,常温下静置5min,检测其中橄榄苦苷含量的变化。
1.2.7 对金属离子的螯合作用[16]将油橄榄叶提取物的母液稀释成不同浓度的溶液:0、0.2、0.4、0.6、0.8、1.0、1.2mg/mL。分别取1.0mL不同提取物溶液与FeCl2(0.5mL,1.0mmol/L)混合均匀,再加入的菲洛嗪(1mL,5.0mmol/L),最后加入5mL水稀释静置10min,在562nm下检测混合液的吸光度。本实验以EDTA作为参考物进行对照。
1.2.8 油橄榄叶中橄榄苦苷含量的计算公式[17]:
2 结果与讨论
2.1 光对橄榄苦苷稳定性的影响
光对橄榄苦苷稳定性的影响见图1,橄榄苦苷含量几乎没有变化。此结果说明橄榄苦苷对实验条件下的常用光比较稳定。可能是橄榄苦苷吸收光的能量后,不至于使其发生分解。但如果光的强度一直增大,橄榄苦苷含有的易断裂的酯键和醚键吸收特定波长的光且在强度够的前提下,可能断裂。但因实验条件有限,没有继续深入研究。
图1 光对橄榄苦苷的影响Fig.1 Effect of light on oleuropein
2.2 温度对橄榄苦苷稳定性的影响
温度是所有加工过程需要考察的一个重要因素,因此温度对橄榄苦苷的影响的考察十分有必要。在50~100℃条件下,静置3h,橄榄苦苷并没有发生明显变化,如图2所示。也即在常用加工的温度条件下不会发生降解作用。为了继续深入研究温度对橄榄苦苷的稳定性的影响,使用橄榄苦苷标准品进行TG-DSC分析实验,结果如图3所示。由图3可知,从TG的结果分析,橄榄苦苷在小于232.3℃没有发生变化,而在约232.3℃开始发生分解,在232.3~550℃,橄榄苦苷降解作用基本完成。在550~1000℃,橄榄苦苷分解后的质量保持恒定。另一方面,从DSC曲线分析可知,橄榄苦苷的分解是一个放热过程。因此,要保持橄榄苦苷不降解,加工油橄榄叶的温度不应该超过232.3℃。

图2 温度对橄榄苦苷稳定性的影响Fig.2 Effect of temperature on oleuropein
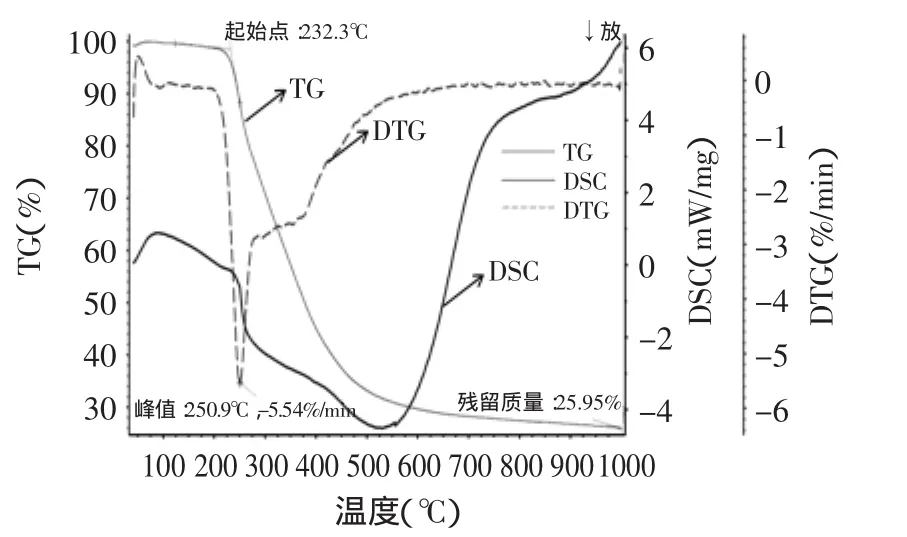
图3 橄榄苦苷标准品的TG-DSCFig.3 TG-DSC of Oleuropein standard
2.3 时间对橄榄苦苷稳定性的影响
加工过程的另一个重要因素是时间。当随着时间的延长,油橄榄叶中的橄榄苦苷可能会发生降解或聚合。因此,对时间的因素考察也是研究橄榄苦苷稳定性很重要的一个方面。
如图4所示,橄榄苦苷在第2d开始发生降解,且随着放置时间的延长,降解率逐渐增大,在第27d,在温度为4℃下,橄榄苦苷降解率为38.1%,而常温25℃下,橄榄苦苷几乎全部降解,降解率达95.24%。之所以会发生降解,是因为油橄榄叶中含有β-葡萄糖苷酶,会促进橄榄苦苷分解[14],25℃为该酶的最适温度。

图4 时间对橄榄苦苷稳定性的影响Fig.4 Effect of time on oleuropein stability
为提高油橄榄叶中橄榄苦苷稳定性,笔者对油橄榄叶提取物的溶液做100℃高温5min进行灭酶处理,实验结果显示,在30d之内,其中的橄榄苦苷含量几乎没有变化。此结果也进一步说明了橄榄苦苷随时间逐步降解的原因是由β-葡萄糖苷酶所导致的。
2.4 不同pH对橄榄苦苷稳定性的影响
由图5可知,与酸性条件下相比,橄榄苦苷在碱性条件下更容易水解,在酸性条件下,橄榄苦苷几乎没有影响,而在碱性条件下,在pH大于10时,橄榄苦苷发生降解,而在pH为14时,橄榄苦苷已经全部降解,因此,橄榄苦苷耐酸不耐碱,其结果与王成章等[18]的研究结果一致,作用过程如图6(b)所示,橄榄苦苷在酸或碱作用下生成羟基酪醇和榄香酸。

图5 pH对橄榄苦苷稳定性的影响Fig.5 Effect of pH on oleuropein

图6 橄榄苦苷在酸碱及酶的条件下分解作用Fig.6 Oleuropein decomposition process on acid,alkali and enzyme conditions stability
2.5 对金属离子的螯合作用

图7 螯合亚铁离子的作用Fig.7 Chelation action of ferrous ions
由图7可知,在螯合亚铁实验中,EDTA螯合作用最强且效果较明显,在其浓度为0.8mg/mL时,螯合率为96.7%;而油橄榄叶提取物螯合作用较低,油橄榄叶提取物(OLE)随着浓度的升高,OLE的螯合作用增强。在其浓度为1.2mg/mL时,螯合率能达约20%。因此,提取物在一定条件下,可以充当螯合剂,作为辅助抗氧化作用,因为生物体内很多氧化反应的酶中需要亚铁离子的催化作用,OLE螯合亚铁离子也就抑制了相关氧化反应的过程,也就防止了氧化损伤,起到了抗氧化作用。
3 结论
3.1 橄榄苦苷对常用光比较稳定;在3h、100℃的条件下,橄榄苦苷含量没有发生降解;橄榄苦苷的降解温度为232.3℃,并且该过程是一个放热过程。
3.2 橄榄苦苷较酸性环境中在碱性条件下容易分解,在pH为14时,橄榄苦苷将全部降解。
3.3 当提取物浓度为1.2mg/mL时,对亚铁离子的螯合率约为20%,明显低于EDTA(0.8mg/mL时,螯合率为96.7%)。
[1]郝婷,崔建玲,张树峰,等.橄榄苦苷提取分离和药理活性的研究进展[J].承德医学院学报,2010,27(1):69-72.
[2]王成章,高彩霞,叶建中,等.HPLC研究油橄榄叶中橄榄苦苷的含量变化规律[J].林产化学与工业,2008,28(6):39-43.
[3]Delrio J A,Baidez A G,Botia J M,et al.Enhancement of phenolic compounds in olive plants(Olea europaea L.)and their influenceonresistanceagainstPhytophthorasp[J].FoodChemistry,2003,83(1):75-78.
[4]Bourquelot E,Sur J C R.l′oleuropein,nouveau principe de nature glucosidique retre de l′olivier(Olea europaea)[J].Compt Rend Herbd Acad Sci,1908,147:533-535.
[5]Jemaia H,Bouaziza M,Fkia I,et al.Hypolipidimic and antioxidant activities of oleuropein and its hydrolysis derivativerich extracts from Chemlali olive leaves[J].Chemico-Biological Interactions,2008,176(2/3):88-98.
[6]ZHAO Guiqin, YIN Zhifeng, DONG Junxing.Antiviral efficacy against hepatitis B virus replication of oleuropein isolated from Jasminum officinale L.var.grandiflorum[J].Journal of Ethnopharmacology,2009,125(2):265-268.
[7]Micol V,Caturla N L,Perez-Fons V,et al.The olive leaf extract exhibits antiviral activity against viral haemorrhagic septicaemia rhabdovirus(VHSV)[J].Antiviral Research,2005,66(2/3):129-136.
[8]Han J, Tallrete N, Yamada P, et al.Anti-proliferative and apoptotic effects of oleuropein and hydroxytyrosol on human breast cancer MCF-7cells[J].Cytotechnology,2009,59(1):45-53.
[9]Hamdi H K,Castellon R.Oleuropein,a non-toxic olive iridoid,is an anti-tumor agent and cytoskeleton disruptor[J].Biochemical and Biophysical Research Communications,2005,334(3):769-778.
[10]Al-Azzawiea H F,Alhamdanib M S.Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits[J].Life Sciences,2006,78(12):1371-1377.
[11]党建章,张幸生,黄晓裕,等.D-101大孔树脂富集油橄榄叶中橄榄苦苷的研究[J].中药材,2007,30(4):454-457.
[12]谢普军,黄立新,张彩虹,等.响应面法超声辅助提取优化橄榄苦苷工艺的研究[J].天然产物研究与开发,2012,24(7):939-944.
[13]傅珊,万文倩,杨文革,等.油橄榄叶中橄榄苦苷的分离纯化[J].生物加工过程,2011,9(4):31-34.
[14]Malik N S A,Baradford J M.Recovery and stability of oleuropein and other phenolic compounds during extraction and processing of olive(Olea europaea L.)leaves[J].Journal of Food Agriculture and Environment,2008,6(2):8-13.
[15]高彩霞.油橄榄叶抗氧化物有效成分及其含量变化规律的研究[D].北京:中国林业科学研究院,2007.
[16]Dinis T C,Madeira V M,Almeidam L M.Action of phenolic derivates (aeetoaminophen,salyeilate,and 5-aminosalyeilate)as inhibitors of membrane lipid peroxidation and peroxyl radical scavengers[J].Archives of Biochemistry and Biophysics,1994,315(1):161-169.
[17]谢普军,黄立新,张彩虹,等.低温减压沸腾提取橄榄苦苷的工艺研究[J].中国中药杂志,2012,37(13):1946-1951。
[18]王成章,高彩霞,叶建中,等.引种阿斯油橄榄叶中橄榄苦苷提取分离及结构鉴定[J].林产化学与工业,2009,39(3):53-57.
