hPARP1酶在杆状病毒/昆虫细胞中的高表达及快速纯化
2013-09-04周海燕马军杨雪丽龚笑海李秋萍金坚
周海燕,马军,杨雪丽,龚笑海,李秋萍,金坚
江南大学医药学院,江苏 无锡 214122
聚 ADP核糖聚合酶 (Poly ADP-ribose polymerase,PARP)[1]是一种参与DNA修复的核酶,能够以烟酰胺腺嘌呤二核苷酸 (NAD+) 为底物,将聚腺苷二磷酸核糖基转移到受体蛋白的谷氨酸残基上,催化合成 PAR聚合物。但在该反应过程中会消耗大量ATP和NAD+,导致细胞死亡。由于PARP的激活在缺血再灌注、糖尿病、炎症和肿瘤[2]的病理过程中起着重要作用,这预示PARP抑制剂在治疗这些疾病中方面有着良好的前景。特别是在肿瘤治疗中,PARP已成为一个重要的新的治疗靶点[3]。
PARP是一个蛋白超家族,包括 PARP1、PARP2、PARP3、Vault-PARP、TANK1、TANK2和TANK3等亚型[4],其中对PARP1的研究最为深入和广泛。PARP1分子量为116 kDa,含有3个主要区域:N端为46 kDa的DNA结合区域,中间是一个22 kDa的自我修饰区域和C端是一个54 kDa的催化区域。当PARP1的锌指结构检测到DNA单链或双链断裂时,PARP1形成二聚体并催化NAD+合成烟酰胺和聚ADP核糖[5]。
聚ADP核糖聚合酶广泛应用于PARP1抑制剂的筛选、PARP1与其他DNA修复蛋白关系研究等。1986年,Burtscher等[6]首次在大肠杆菌中表达出有活性的PARP1,此后,一些研究学者纷纷发现酵母细胞[7]、CHO细胞[8]及其昆虫细胞[9]都可以作为 PARP1的表达宿主,其中昆虫细胞表达量较高[6-9],1 L大肠杆菌仅纯化出 0.3 mg hPARP1[6],而仅仅100 mL的昆虫细胞便可纯化出其 10倍以上 hPARP[9]。目前,国内尚未见成功表达纯化hPARP1研究的报道。
本实验室从分子构建开始,利用 Bac-to-bac昆虫杆状病毒表达系统成功地表达出高活性的hPARP1,并利用 hPARP1酶可以被 3-氨基苯甲酰胺特异性亲和的特点纯化出了高活性的hPARP1,为PARP1抑制剂的筛选奠定了基础。
1 材料与方法
1.1 质粒、菌株、细胞和试剂
hPARP1基因购自 OriGene科技有限公司。质粒 pFastBacTM1、大肠杆菌Escherichia coliDH10Bac、Escherichia coliDH5α和草地贪夜蛾卵巢细胞系 (Spodoptera frugiperda9,Sf9) 均由本实验室保存。脂质体转染试剂 (Lipofection 2000 Reagent) 和 SF900ⅡSFM 昆虫细胞培养基购自 GIBCO公司;琼脂糖回收试剂盒、限制性内切酶SgfⅠ和MiuⅠ购自宝生物工程 (大连)有限公司;质粒纯化试剂盒和T4 DNA连接酶购自生物工程 (上海) 股份有限公司;ECH Sepharose 6B和 EDC购自北京韦氏博慧色谱科技有限公司;3-氨基苯甲酰胺 (3AB) 购自阿拉丁公司;Anti-PARP1 (sc-74470) 多克隆抗体购自Santa Cruz Biotechnology,Anti-mouse IgG-HRP二抗购自 Vector公司。其他试剂均为国产分析纯级。
1.2 重组杆状病毒表达质粒 Bacmid-hPARP1的构建和鉴定
用SgfⅠ/MiuⅠ双酶切PCMVhPARP1,回收hPARP1片段,并克隆至 pFastBacTM1的相应位点中,然后转化大肠杆菌E. coliDH5α感受态细胞中。鉴定为阳性的重组子点接在LB培养基中过夜培养,采用质粒纯化试剂盒提取重组质粒pFast-hPARP1,用SgfⅠ/MiuⅠ双酶切鉴定,并送上海生工生物技术服务有限公司进行测序。取E. coliDH10Bac感受态细胞,加入1 ng的重组质粒 pFast-hPARP1,42 ℃热击 45 s后,于 LB培养基37 ℃孵育4 h,涂布在含有抗性的平板上,并加入X-gal,将平板于37 ℃培养48 h,筛选白色菌落作为阳性质粒Bacmid-hPARP1。提取的阳性质粒可用于下一步转染实验。
1.3 Sf9细胞的转染及其高滴度重组杆状病毒的获得
采用Invitrogen公司的脂质体转染试剂将重组质粒Bacmid-hPARP1转染Sf9细胞,操作步骤按照产品说明书进行。每孔 8 μg质粒转染 Sf9细胞4~6 h后更换SF900ⅡSFM,同时转染空质粒,作为阴性对照。6 d后观察细胞出现病变,收集细胞上清12 000 r/min离心5 min,收集上清并4 ℃避光保存,所获得的细胞即为P1代。取P1代重组病毒,按照 1∶10稀释后,感染处于对数生长期的Sf9细胞,27 ℃培养3 d,细胞出现明显病变时收集上清,得到 P2代病毒。同样方法再传一代,筛选到高滴度的含有hPARP1基因的重组杆状病毒。用 P3代高滴度的病毒感染细胞48 h、56 h、64 h和72 h后,分别收集病变的细胞。
1.4 hPARP1的Western blotting检测
收集病变的细胞,用PBS重悬后,超声裂解细胞,12 000 r/min离心 10 min,上清进行SDS-PAGE电泳,转膜并用5%的脱脂奶粉封闭后,用鼠抗 hPARP1的一抗 4 ℃孵育过夜,经TBST洗涤后,二抗为HRP标记的羊抗鼠IgG室温孵育2 h,洗涤后显色并观察特异性条带。
1.5 hPARP1活性测定
1.5.1 NAD+标准曲线的测定
黑色96孔板中加入20 μL NAD,使其终浓度分别为 0.48、0.97、1.95、3.9、7.81、15.625、31.25、62.5、125和250 nmol/L,每个浓度设4个孔。然后加入 10 μL 的 PARP 稀释缓冲液(50 mmol/L Tris-HCl,2 mmol/L MgCl2,pH 8.0),加入10 μL的2 mol/L KOH和10 μL的20%苯乙酮,4 ℃反应10 min;最后加入45 μL的88%甲酸,110 ℃反应5 min,待板温度降到常温时,在激发波长 (360±15) nm,发射波长 (445±15) nm条件下[10]测荧光强度。
1.5.2 hPARP1活性的测定
在黑色96孔板中加入20 μL的125 nmol/L NAD+,10 μL不同含量的溶于 PARP缓冲液中hPARP1和DNA (终浓度为15 mg/L) 混合物。反应 15 min后,加入 10 μL 2 mol/L KOH 和 10 μL 20%苯乙酮,4 ℃反应10 min;最后加入45 μL 88%甲酸,110 ℃反应5 min,待板温度降到常温时,在激发波长 (360±15) nm,发射波长(445±15) nm条件下测荧光强度,同时设置空白对照孔为 20 μL125 nmol/L NAD+,10 μL PARP缓冲液和DNA (终浓度为15 mg/L) 混合物,其hPARP1活性为0%[10-11]。
1.6 hPARP1的纯化
1.6.1 3-氨基苯甲酰胺 (3AB) 亲和层析柱的合成
用0.5 mol/L NaCl洗涤25 mLECH Sepharose 6B,去除乙醇后,用0.1 mol/L NaOH将其pH调至 4.5~6.0之间。在 4 ℃条件下,在 ECH Sepharose 6B中缓慢加入 1 g的 EDC (N-(3-dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride) 和 0.5 g 溶于 1 mL甲醇中的 3-氨基苯甲酰胺,摇动过夜,并保持其 pH为4.5~6.0。用 100 mmol/L乙酸钠 (pH 4.0) 和0.5 mol/L NaCl终止交联,并用 100 mmol/L Tris-HCl (pH 8.0) 和 0.5 mol/L NaCl洗涤填料[12]。
1.6.2 利用 3-氨基苯甲酰胺(3AB)亲和层析柱纯化hPARP1
12 000 r/min离心5 min,收集Sf9细胞,将其重悬于缓冲液 A (50 mmol/L葡萄糖,0.2%Tween 20,0.5 mmol/L EDTA 和 0.5 mmol/L PMSF),超声破碎后12 000 r/min离心30 min,硫酸鱼精蛋白 (终浓度1 mg/mL) 去除其DNA,上清液中缓慢加入硫酸铵,使硫酸铵的饱和度达到 70%后,4 ℃静置 1 h。12 000 r/min离心20 min,用缓冲液 B (100 mmol/L Tris-HCl pH 7.5,14 mmol/Lβ-巯基乙醇,0.5 mmol/L EDTA,0.5 mmol/L PMSF) 溶解沉淀。
在层析柱中装20 mL ECHsepharose 6B-3AB亲和填料,并用缓冲液B平衡后,以重力速度流速上样。用含有 100 mmol/L、400 mmol/L和800 mmol/L NaCl不同浓度的缓冲液B除去样品中未结合的蛋白,然后用洗脱液 (100 mmol/L Tris-HCl,pH 7.5,400 mmol/L NaCl,1 mmol/L 3-甲氧基苯甲酰胺,14 mmol/L β-巯基乙醇,0.5 mmol/L EDTA,0.5 mmol/L PMSF) 进行洗脱,并收集样品。
2 结果与分析
2.1 pFast-hPARP1昆虫表达载体的构建

图 1 重组质粒 pFast-hPARP1双酶切产物的琼脂糖凝胶电泳分析Fig. 1 Identification of recombinant transfer plasmid by enzyme digestion. M: DNA marker; 1: recombinant transfer plasmid digested with Sgf Ⅰand MiuⅠ.
重组质粒 pFast-hPARP1是通过将hPARP1基因插入到质粒pFastBacTM1的SgfⅠ和MiuⅠ两个酶切位点间来构建的。获得的重组质粒经SgfⅠ和MiuⅠ双酶切进行鉴定,酶切产物进行琼脂糖凝胶电泳分析 (图1)。通过双酶切鉴定,理论预测目的片段约为3 045 bp。图1中泳道2可以看出,质粒酶切后出现2条带,有一条带约在3 000 bp处出现,可能对应的是hPARP1基因片段,将鉴定为阳性的重组质粒送往上海生工生物技术服务有限公司进行测序,测序结果发现重组质粒上的hPARP1基因与报道的基因序列完全一致,表明hPARP1基因被正确克隆到质粒pFastBacTM1上,可用于下一步的实验中,将pFast-hPARP1导入E. coliDH10Bac感受态细胞,发生转座后,挑取白色的阳性质粒,为Bacmid-hPARP1。
2.2 免疫杂交试验验证hPARP1的表达
提取重组质粒 (Bacmid-hPARP1) 并转染Sf9细胞,6 d后可见转染Bacmid-hPARP1的细胞直径增大,细胞核充满整个细胞,细胞发生病变。将 P3代病毒接种到对数生长期的 Sf9细胞中,分别在48、56、64和72 h后收集病变细胞。超声破碎并离心后,取上清将感染细胞和野生病毒感染的 Sf9细胞组分别进行 SDS-PAGE电泳(图2),图2中可在泳道2、3、4、5清晰地看见116 kDa处hPARP的条带。并利用免疫印迹试验(Western blotting) 对细胞内的hPARP1酶进行结合特异性检测 (图3)。从图3中可以看出,转染pFast-hPARP1的昆虫细胞可以与hPARP1抗体发生特异性反应,而野生病毒感染的Sf9细胞组与hPARP1抗体并无结合反应。免疫印迹结果表明,Sf9昆虫细胞成功表达hPARP1酶。
2.3 hPARP1活性的测定
2.3.1 NAD+标准曲线的确定
选择一系列浓度的底物NAD+,按照上述方法测定荧光值,结果显示 (图4) 在1 nmol/L时候就可以检测生成化合物的荧光,当浓度达到250 nmol/L时仍然具有良好的线性关系(R2=0.9984)。根据标准曲线的测定,选择荧光值大约一半时的底物浓度,125 nmol/L NAD+作为酶活测定的标准。
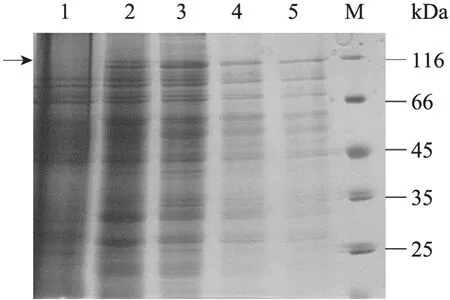
图2 SDS-PAGE检测昆虫细胞表达hPARP1Fig. 2 Identification of hPARP1expressed by Sf9 insect cell by Commassie blue staining. 1: Sf9 insect cell transfected with plasmid pFastBacTM1; 2: hPARP1 enzyme expressed in Sf9 insect cell after 48 h; 3:hPARP1 enzyme expressed in Sf9 insect cell after 56 h;4: hPARP1 enzyme expressed in Sf9 insect cell after 64 h; 5: hPARP1 enzyme expressed in Sf9 insect cell after 72 h; 6: protein marker.
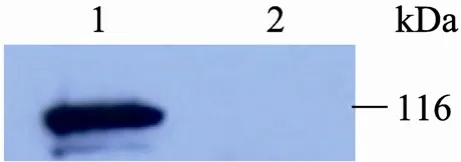
图3 Western blotting分析hPARP1抗体与hPARP1酶的特异性结合Fig. 3 Identification of hPARP1 expressed by Sf9 insect cell by Western blotting. 1: hPARP1 enzyme expressed in Sf9 insect cell identified by Western blotting;2:Sf9 insect cell transfected with plasmid pFastBacTM1.
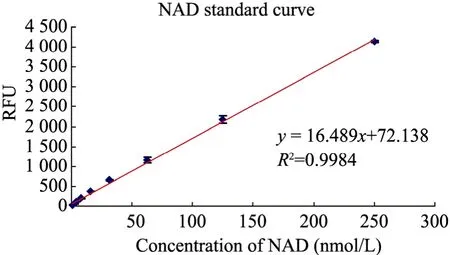
图4 NAD+标准曲线Fig. 4 NAD+ calibration curve.
2.3.2 hPARP1活性的测定
hPARP1活性的测定是通过检测其底物NAD+的量来间接测定hPARP1的活性,NAD+属于N-烷基吡啶类化合物,其可以与酮类反应,在过量酸中加热转化为荧光分子,通过测定荧光值变化间接反应 hPARP1活性。根据标准曲线,使用125 nmol/L NAD+作为酶活测定的底物,分别加入纯化后的不同量的 hPARP1酶和相同 DNA,反应15 min。结果可见图5,随着hPARP1量增加,荧光值逐渐降低,说明在相同时间内,随着hPARP1酶浓度的增加,底物NAD+被消耗的越多,即剩余的NAD+越少,荧光值越小。

图5 hPARP1的活性Fig. 5 Activity of purified hPARP1.
2.4 hPARP1酶的纯化
收集病变的细胞,超声破碎并离心后,利用硫酸鱼精蛋白去除 DNA。通过 70%硫酸铵沉淀,一方面富集 hPARP1酶和去除部分杂蛋白(图6);另外一方面,通过硫酸铵沉淀使hPARP1酶的比活从 0.051 nmol/(min·μg) 提高到0.072 nmol/(min·μg) (表 1),纯化倍数提高了 1.4倍,产率为91.5%。
由于 3-氨基苯甲酰胺是 PARP1的抑制剂,它可以与 PARP1的催化结构域特异性结合,所以我们利用 PARP1的这一特点交联合成了 3-氨基苯甲酰胺柱,并用它对hPARP1进行纯化。首先,用不同浓度的盐溶液梯度洗除杂质,然后用含有3-甲氧基苯甲酰胺的洗脱液进行洗脱,收集液用紫外监测仪检测。纯化后的蛋白进行还原性SDS-PAGE分析 (图6)。如图6 所示,泳道2中可以清晰观察到 116 kDa附近有一条很深的条带,经扫描分析,其纯度大于90%。结果表明通过利用 hPARP1酶的亲和层析柱可以实现hPARP1酶的分离纯化,并获得到较高纯度的hPARP1酶蛋白,同时还可以大大提高 hPARP1酶的比活,达到1.988 nmol/(min·μg)。经过亲和纯化后,hPARP1酶的纯化倍数提高了38倍,并且产率仍维持在80%以上。

图6 SDS-PAGE检测hPARP1酶的纯化Fig. 6 Commassie blue staining of the purified poly(ADP-ribose) polymerase1 from Sf9 lysate. M: protein marker; 1: 3-aminobenzamide affinity chromatography;2: ammonium sulfate precipitation; 3: cleared lysate.
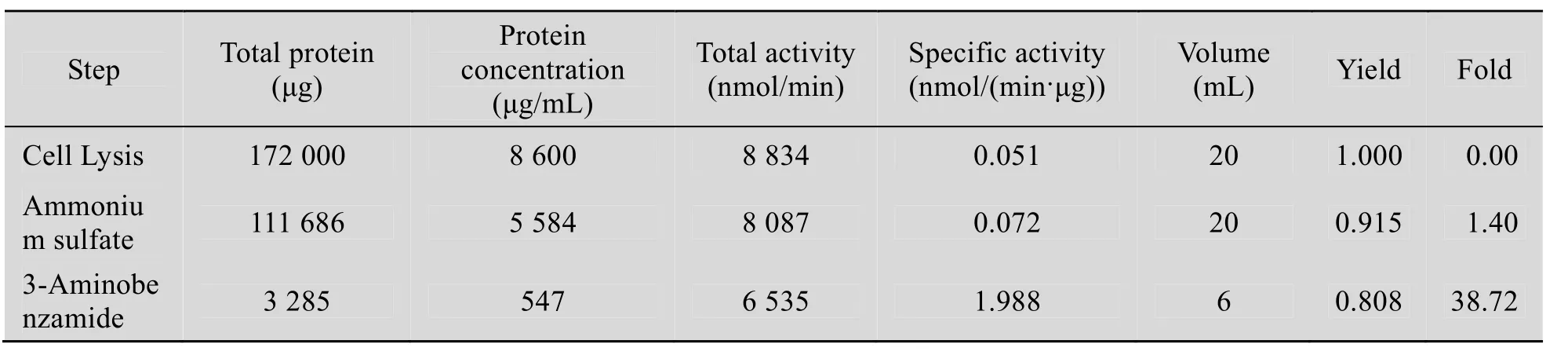
表1 hPARP1纯化活性Table 1 hPARP1 activity during the purification
3 讨论
近年来,由于 PARP1与炎症、肿瘤、缺血再灌注等病理过程有着密切的联系,PARP1已经成为一个新的治疗靶点。目前,PARP1抑制剂的筛选已经成为抗肿瘤药物的研究热点[13-15],PARP1抑制剂 AZD2281[16],ABT-888[17]等已经进入临床试验阶段,但是由于其临床用药量比预期稍大,临床试验陷入了一定的困境[18],因此,纯化出大量高活性的 hPARP1酶有利于我们对PARP1晶体结构的探索,进而增加对PARP这个靶点的认识。同时,高活性及纯度的聚 ADP核糖聚合酶在 PARP1抑制剂筛选中的应用具有广阔的前景。
由于E.coli中有PARP1的水解酶及其蛋白在原核表达系统中的折叠不同[9],E.coli中表达的有活性的hPARP1的表达量较低,因此我们采用杆状病毒表达系统。昆虫表达系统有诸多优点,如能进行翻译后修饰,酶的活性比较稳定,产量高,适用性强等[19]。本研究将编码hPARP1基因重组于杆状病毒表达载体中,成功构建了能够表达 hPARP1酶的重组杆状病毒。Western blotting表明该病毒表达的 hPARP1酶可被hPARP1单克隆抗体识别,表明该系统表达的hPARP1具有免疫原性;酶活测定实验表明hPARP1有良好的生物活性。
hPARP1酶在体外极不稳定,容易降解,其半衰期极短[20]。本研究仅仅利用一个亲和层析柱将hPARP1纯化,这为工业大规模生产提供了可能。纯化后的hPARP1酶仍具有良好的生物活性,本研究一方面为 PARP1抑制剂的筛选创造了条件;另一方面,从100 mL的昆虫细胞中即可纯化得到3.2 mg的PARP1酶,表明通过杆状病毒表达系统生产 PARP1酶可以获得很高的产量,这为大规模生产hPARP1酶奠定了基础。同时,大量生产 hPARP1酶对我们进一步研究hPARP1的晶体结构,增加对 PARP1的认识提供了必要的条件。
[1]Jagtap P, Szabó C. Poly (ADP-ribose) polymerase and the therapeutic effects of its inhibitors. Nat Rev Drug Discov, 2005, 4(5): 421−440.
[2]Aguilar-Quesada R, Munoz-Gamez J, Martin-Oliva D, et al. Modulation of transcription by PARP-1:consequences in carcinogenesis and inflammation.Curr Med Chem, 2007(11), 14: 1179−1187.
[3]Bryant HE, Schultz N, Thomas HD, et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly (ADP-ribose) polymerase. Nature, 2005,434(7035): 913−917.
[4]Beneke S, Bürkle A. Poly (ADP-Ribosyl) ation and aging. Exp Gerontol, 2004, 39(11): 234−241.
[5]Langelier MF, Planck JL, Roy S, et al. Structural basis for DNA damage-dependent poly(ADP-ribosyl) ation by human PARP1. Science,2012, 336(6082):728−732.
[6]Burtscher HJ, Auer B, Klocker H, et al. Isolation of ADP-ribosyltransferase by affinity chromatography. Anal Biochem, 1986, 152(2):285−290.
[7]Kaiser P, Auer B, Schweiger M. Inhibition of cell proliferation inSaccharomyces cerevisiaeby expression of human NAD+ADP-ribosyltransferase requires the DNA binding domain (“zinc fingers”). Mol Gen Genet, 1992,232(2): 231−239.
[8]Fritz G, Auer B, Kaina B. Effect of transfection of human poly (ADP-ribose) polymerase in Chinese hamster cells on mutagen resistance. Mutat Res,1994, 308(2): 127−133.
[9]Giner H, Simonin F, de Murcia G, et al.Overproduction and large-scale purification of the human poly (ADP-ribose) polymerase using a baculovirus expression system. Gene, 1992, 114(2):279−283.
[10]Putt KS, Hergenrother PJ. An enzymatic assay for poly (ADP-ribose) polymerase-1 (PARP-1) via the chemical quantitation of NAD+: application to the high-throughput screening of small molecules as potential inhibitors. Anal Biochem, 2004, 326(1):78−86.
[11]Liu J, Zhang LY. HTS model for poly(ADP-ribose)polymerase-1 inhibitors. Chin Pharmacol Bull,2007, 23(1): 124−127 (in Chinese).
柳军, 张陆勇. 聚腺苷二磷酸核糖聚合酶-1 抑制剂高通量筛选模型. 中国药理学通报, 2007,23(1): 124−127.
[12]Dantzer F, Amé JC, Schreiber V, et al. Poly(ADP-ribose) polymerase-1 activation during DNA damage and repair. Meth Enzymol, 2006, 409: 493.
[13]Kummar S, Chen A, Ji J, et al. Phase I study of PARP inhibitor ABT-888 in combination with topotecan in adults with refractory solid tumors and lymphomas. Cancer Res, 2011, 71(17): 5626−5634.
[14]Samol J, Ranson M, Scott E, et al. Safety and tolerability of the poly (ADP-ribose) polymerase(PARP) inhibitor, olaparib (AZD2281) in combination with topotecan for the treatment of patients with advanced solid tumors: a phase I study. Invest New Drugs, 2011, 30(4): 1−8.
[15]Domagala P, Lubinski J, Domagala W, et al.Iniparib in metastatic triple-negative breast cancer.New Engl J Med, 2011, 364(18): 1780−1781.
[16]Shivaani K, Alice C, Ralph EP, et al. Advances in using PARP inhibitors to treat cancer. BMC Medicine, 2012, 10(1): 25−30.
[17]Pothuri B, Sparano J, Blank S, et al. Phase I study of the PARP inhibitor ABT-888 (veliparib) and pegylated liposomal doxorubicin (PLD) in recurrent ovarian (ov) and breast (br) cancers.Gynecol Oncol, 2012, 125: 22.
[18]Patel AG, De Lorenzo SB, Flatten KS, et al. Failure of iniparib to inhibit poly (ADP-Ribose) polymerasein vitro. Clin Cancer Res, 2012, 18(6): 1655−1662.
[19]Wang F, Diao Y, Xiao WD, et al. Large-scale production of recombinant adeno-associated virus(rAAV). Chin J Biotech, 2009, 25(11): 1608−1613(in Chinese).
王峰, 刁勇, 肖卫东, 等. 重组腺相关病毒规模化生物包装技术. 生物工程学报, 2009, 25(11):1608−1613.
[20]Caiafa P, Guastafierro T, Zampieri M, et al.Epigenetics: poly (ADP-ribosyl) ation of PARP-1 regulates genomic methylation patterns. FASEB J,2009, 23(3): 672−678.
