高通量miRNA活性谱检测发现BHK21细胞中miR-206高活性
2013-09-04田文洪董小岩王刚郑刚周庆璋董哲岳吴小兵
田文洪,董小岩,王刚,郑刚,周庆璋,董哲岳,吴小兵
1 吉林大学生命科学学院,吉林 长春 130012
2 北京五加和分子医学研究所有限公司,北京 101111
3 中国疾病预防控制中心 病毒病预防控制所,北京 100052
microRNAs (miRNAs) 作为动物体中内源性的非编码小 RNA,通过抑制基因表达,调节多种生理过程,是动物细胞内重要的转录后调节因子[1-3]。miRNA的表达和活性具有明显的组织特异性[4-6],与多种生理病理过程密切相关[7-9]。不同细胞系因其来源和建立过程的差异呈现出不同的 miRNA表达和活性谱。因此 miRNA表达和活性谱有可能成为一种生物标记用于细胞系的区分和鉴定。BHK21细胞来源于金黄地鼠肾脏组织,是一种广泛应用的细胞系[10]。BHK21细胞与其他肾脏组织来源细胞 (如 Vero、HEK293和MDCK) 明显不同,被鉴定为成纤维细胞[11]。该差异是否也体现在miRNA水平上,值得进一步研究。
本课题组最近建立了一种活细胞中 miRNA活性谱检测技术[12]。本研究拟将该技术应用于BHK21、HEK293和 Vero三种肾脏来源细胞的miRNA活性谱检测,比较分析找出BHK21细胞中特异性高活性miRNA,并用QRT-PCR方法进行验证,为从miRNA水平揭示BHK21细胞的特性奠定基础。
1 材料与方法
1.1 材料
miRNA Asensor和 Control Asensor分别为miRNA活性检测和对照传感器。传感器为携带萤火虫荧光素酶 (Firefly luciferase,Fluc) 表达框和分泌型荧光素酶 (Gaussialuciferase,Gluc)表达框的腺相关病毒 (Adeno-associated virus,AAV) 载体,其中Fluc表达框用于校正不同传感器之间转导效率差异,Gluc表达框中含有miRNA靶序列,用于检测 miRNA活性[12]。Control Asensor的 Gluc表达框不携带任何miNRA靶序列,miRNA Asensor的Gluc表达框携带单个的完全互补的miRNA靶序列。Control Asensor和miRNA Asensor均由北京五加和分子医学研究所制备和保存。BHK-21 [C-13](ATCC No. CCL-10)、HEK293 (ATCC No. CRL-1573)、Vero (ATCC No. CCL-81) 和C2C12细胞 (ATCC No. CRL-1772) 购自ATCC。DMEM培养基购自北京清大天一生物技术有限公司。胎牛血清(Fetal bovine serum,FBS)、马血清 (Horse serum,HS) 和Trizol试剂购自Invitrogen公司。细胞总蛋白提取试剂盒-I购自北京普利莱生物技术有限公司。BCA蛋白浓度测定试剂盒为 Pierce产品。鼠抗MHC一抗和鼠抗β-actin一抗为Abcam公司产品。鼠抗 Cx43一抗为 Cell Signaling Technology公司产品。碱磷酶标记马抗鼠二抗为北京中杉金桥生物技术有限公司产品。BCIP/NBT为德国Calbiochem公司产品。Fluc和Gluc活性检测试剂盒分别为Promega和NEB公司产品。TaqMan MicroRNAs Assay试剂盒为ABI公司产品。
1.2 生物信息学分析
利用 microRNAviewer (http://people.csail.mit.edu/akiezun/microRNAviewer) 在线工具分析miRNA序列同源性[13],找出人、小鼠、大鼠和斑马鱼中成熟序列完全相同的miRNA种类,从本课题组已经制备好的 260种 miRNA Asensors中,找出相应的miRNA Asensor。从NCBI的蛋白数据库 (http://www.ncbi.nlm.nih.gov/protein)中搜索获得人、小鼠、大鼠和斑马鱼Cx43蛋白序列,应用Vector NTI11.5软件进行序列比对分析;从NCBI的GenBank中搜索获得人、小鼠、大鼠和斑马鱼 Cx43蛋白相应 mRNA的 3′UTR序列,根据种子序列 (Seed sequence) 原则[14-15]预测miRNA靶序列。
1.3 miRNA活性检测阵列制备
根据1.2所叙述方法,选择获得58种miRNA Asensor。按照一定的顺序用Liquidator 96手动移液工作站将 Control Asensor和 miRNA Asensor加入 96孔细胞培养板中,每孔所加 miRNA Asensor量为 2.5×108vg (viral genome)/20 μL,每种miRNA Asensor三个复孔。然后,将96孔细胞培养放入超净工作台中自然干燥完全,获得miRNA活性检测阵列miRNA Asensor array,放于 2~8 ℃保存。每次制备多套 miRNA Asensor array。取出一套 miRNA Asensor array,加入BHK21细胞,48 h后按照说明书用Fluc活性检测试剂盒测定Fluc表达活性,根据文献报道的公式计算出本套miRNA Asensor array的转导系数(Transduction coefficient,TC)[12],用于校正不同Asensor之间的转导效率差异。
1.4 BHK21、HEK293和 Vero细胞 miRNA活性谱检测
用 10% FBS DMEM 培养基将 BHK21、HEK293和Vero细胞分别以1×104/孔的密度接种miRNA Asensor array,放置于37 ℃、5% CO2孵箱中培养。48 h后,每孔吸取20 μL细胞培养上清,用 Gluc活性检测试剂盒参照说明书检测Gluc活性。计算Control Asensor的Gluc活性与miRNA Asensor的Gluc活性的比值,即抑制倍数(Inhibiting fold,IF)。用 miRNA Asensor的 IF值与 TC值的乘积,即相对抑制倍数 (Relative inhibiting fold,RIF) 表示miRNA活性。
1.5 倒置显微镜观察 BHK21形态变化和Western blotting检测MHC和Cx43蛋白表达
BHK21细胞接种于10 cm细胞培养皿 (10%FBS,DMEM),待细胞 90%融合度时,弃去培养基,用 PBS清洗细胞 2次,弃去 PBS,更换为 2% HS DMEM 培养细胞,设置 10% FBS DMEM培养条件为对照。48 h后,倒置显微镜观察BHK21细胞并拍照。然后,消化收集细胞,用PBS清洗2次,蛋白抽提试剂盒-I提取细胞总蛋白,BCA法蛋白定量试剂盒测定细胞总蛋白浓度。取20 μg细胞总蛋白上样,10% SDS-PAGE变性电泳分离后,转移至PVDF膜上。膜用含5%(W/V) 脱脂奶的 TBST (含 0.1% Tween 20的TBS) 封闭后,分别与鼠抗MHC一抗 (1∶100)、鼠抗Cx43一抗 (1∶1 000) 和鼠抗 β-actin一抗(1∶5 000) 孵育,接着再分别与碱磷酶标记马抗鼠二抗 (1∶1 000) 孵育。最后,BCIP/NBT试剂盒显色并拍照。
1.6 miR-206活性检测
细胞接种于 96孔细胞培养板 (1×104个细胞/孔),Control Asensor和 miR-206 Asensor分别以2.5×108vg感染接种细胞,每种Asensor三个复孔,放置于37 ℃、5% CO2孵箱中培养。48 h后,用 Gluc活性检测试剂盒测定细胞培养上清Gluc活性,Fluc活性检测试剂盒测定细胞裂解Fluc活性。利用Fluc活性值计算miR-206 Asensor的TC值,Gluc活性值计算IF值,计算TC值与IF值的乘积,获得 RIF值,用于表示 miR-206活性。
1.7 QRT-PCR检测细胞中miR-206表达
Trizol试剂提取细胞内总 RNA,BioPhotometer plus核酸蛋白测定仪测定提取RNA浓度。TaqMan MicroRNAs Assay试剂盒测定细胞内miR-206表达水平,测定过程参照试剂盒说明书。选择细胞内小RNA U6作为内参,细胞内miR-206的相对表达水平用2的ΔCt值的次方表示,其中ΔCt值为U6的Ct值和 miR-206的Ct值的差值。
1.8 统计学分析
所有数据以±s表示。采用SPSS16.0软件,应用独立样本t检验分析处理数据,P<0.05具有统计学差异。
2 结果
2.1 BHK21、HEK293和 Vero三种细胞 58种miRNA活性谱的获得
首先,在本课题组已有的260种miRNA活性检测传感器miRNA Asensor中,以miRbase数据库中miRNA序列为依据,通过序列同源性分析,找出了 58种在人、小鼠、大鼠和斑马鱼中成熟序列完全相同的miRNA (表1),选择其相应的miRNA Asensor,参考以前报道的方法[12],制备获得 58种 miRNA的活性检测阵列 miRNA Asensor array。然后,利用该阵列检测获得了BHK21、HEK293和 Vero三种细胞中 58种miRNA活性。
在3种细胞中,58种miRNA总活性明显不同,其中BHK21细胞最高,HEK293细胞次之,Vero细胞最低;相同的miRNA在 3种细胞中的活性不尽相同,呈现出不同的活性谱特征 (图1)。其中肌肉特异性表达的miR-206在BHK21细胞中的 RIF值为 34.30±4.31,而在 HEK293和 Vero细胞的 RIF值分别为:1.85±0.15和 1.43±0.13,表明 BHK21细胞中 miR-206的活性明显高于HEK293和Vero细胞。随后我们对该现象进行了进一步研究。

表1 miRNA成熟序列表Table 1 Mature sequences for miRNAs
2.2 miR-206在BHK21细胞中高活性及高表达
为了验证miR-206在BHK21细胞中的高活性,以miR-206高表达细胞株C2C12为阳性对照,miR-206不表达细胞株HEK293为阴性对照[16],利用 miR-206 Asensor分别检测了 BHK21、HEK293和C2C12三种细胞中的miR-206活性,QRT-PCR法检测了 3种细胞的 miR-206表达水平。结果显示,BHK21和C2C12细胞中miR-206活性都较高,且BHK21细胞明显高于C2C12细胞,差异具有统计学意义,HEK293细胞中则未检测到miR-206活性 (图2A);与活性水平类似,BHK21和C2C12细胞中miR-206的表达水平都较高,且BHK21细胞明显高于C2C12细胞,差异具有统计学差异,HEK293细胞中仍未检测到miR-206的表达 (图2B)。结果证实了BHK21细胞中miR-206的高活性及高表达。

图1 BHK21、HEK293和Vero细胞中58种miRNA活性谱Fig. 1 miRNA activity profile for BHK21, HEK293, and Vero cells. 58 miRNA activities were detected using miRNA Asensor array. Each miRNA activity was shown. And miR-206 activity was presented as dark black.

图2 HEK293、BHK21和C2C12细胞中miR-206活性及表达水平Fig. 2 miR-206 activity and expression levels in HEK293, BHK21, and C2C12 cells. (A) miR-206 activity level in the three cell lines. miR-206 activity was assayed in the three cell lines using miR-206 Asensor. And miRNA activity was represented by relative inhibiting fold (RIF). (B) miR-206 expression level in the three cell lines. miR-206 expression level was detected by QRT-PCR. 2ΔCt was used to indicate miR-206 expression level. ΔCt=CtU6−CtmiRNA. RIF, relative inhibiting fold. Error bars correspond to x ±s (n=3). Student’s t-test was used to examine statistical significance of differences. **P<0.01.
2.3 马血清诱导后BHK21细胞变化
以前的研究表明 BHK21细胞培养中撤除牛血清、换成马血清培养,能够诱导细胞分化并表达产生肌肉特异性蛋白,呈现出横纹肌细胞特点[17]。考虑到miR-206在肌肉细胞发育过程中发挥重要作用[18-19],我们比较分析了换成马血清诱导培养前后 BHK21细胞中形态特征和肌肉特异性蛋白表达情况以及miR-206活性和表达水平。结果显示马血清培养BHK21细胞48 h后,细胞变长,部分细胞发生融合出现多核细胞 (图3A),而且细胞骨骼肌肌球蛋白重链 (Slow skeletal myosin heavy chain,MHC) 表达升高 (图 3B),表明 BHK21细胞向横纹肌细胞分化。马血清诱导培养48 h后,miR-206活性和表达水平都明显上升,且差异都具有统计学意义 (图 3C和图 3D)。
为了进一步揭示马血清诱导培养 BHK21细胞后 miR-206的升高是否引起了相应的基因负调控作用,用Western blotting检测了诱导培养前后 BHK21细胞中连接蛋白 Connexin43 (Cx43)的表达情况。之所以选择Cx43蛋白,是因为在人、小鼠、大鼠和斑马鱼细胞中Cx43基因mRNA的3′UTR区都能发现miR-206的种子序列 (表2)。Cx43基因在人、小鼠、大鼠和斑马鱼之间具有较高的保守性,人和小鼠以及人和大鼠之间的氨基酸序列同源性达99.7%,大鼠和小鼠之间的氨基酸同源性为100%,人和斑马鱼之间的同源性也高达60.3% (表2)。检测结果显示,诱导48 h后BHK21细胞中Cx43蛋白表达下降 (图3E),与以前报道的 miR-206抑制 C2C12细胞表达Cx43蛋白,从而调节 C2C12细胞发育成肌细胞的研究结果相一致[20]。
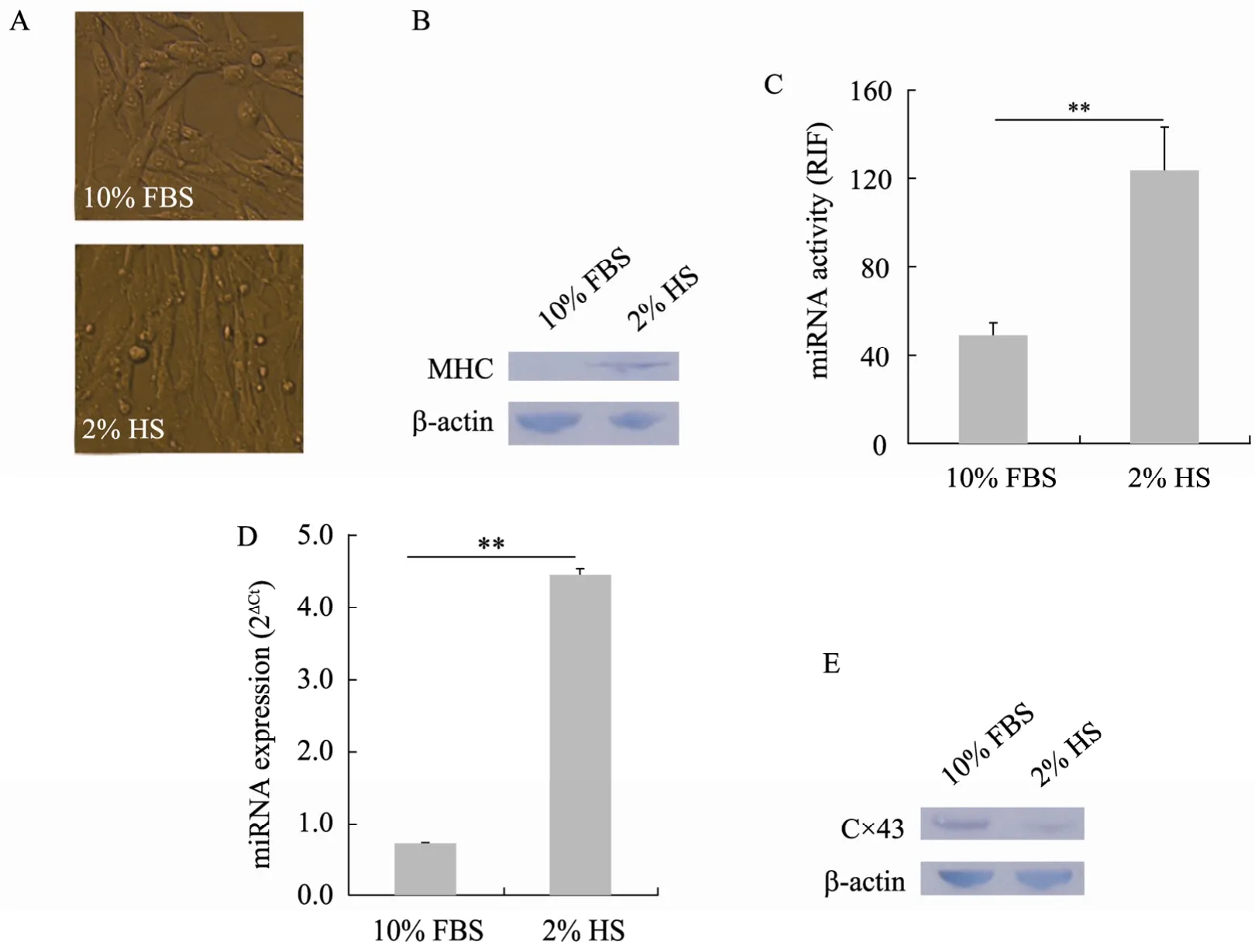
图3 马血清诱导培养后BHK21细胞的变化Fig. 3 Changes after differentiation of BHK21 induced by 2% HS. (A) Morphological changes in BHK21 cells induced by 2% HS. Cells were examined by Leica DMI3000 M Simply Microscopy (200×). (B) BHK21 expressed skeletal muscle protein when induced by 2% HS. Slow skeletal myosin heavy chain(MHC) was assayed by Western blotting in BHK21induced with or without 2% HS. (C) miR-206 activity increased in BHK21 induced by 2% HS.miR-206 activity was assayed in BHK21 when it was cultured in the medium with 10% FBS or 2% HS using miR-206 Asensor, respectively. miRNA activity was presented as relative inhibiting fold (RIF). (D) miR-206 expression level increased in BHK21 induced by 2% HS. In the two different culture conditions, miR-206 expression level was tested by QRT-PCR in BHK21. 2ΔCt was used to indicate miR-206 expression level. (E) Cx43 expression decreased in BHK21 induced by 2% HS. Expression of Cx43 was assayed by Western blotting in BHK21 induced with or without 2% HS.ΔCt=CtU6−CtmiRNA. RIF: relative inhibiting fold. Error bars correspond to x ±s (n=3). Student’s t-test was used to examine statistical significance of differences. **P<0.01.

表2 Connexin 43基因生物信息学分析Table 2 Bioinformatics analysis of Connexin 43 gene
3 讨论
BHK21、HEK293和 Vero细胞是3种常见的肾组织来源细胞株。不同于 HEK293和 Vero细胞,BHK21细胞来源于 1日龄的金黄地鼠肾组织,并鉴定为成纤维细胞[11]。已有的研究还表明BHK21细胞具有某些横纹肌细胞的特性[16],提示BHK21的独特性。miRNA作为一种广泛存在于后口动物中的转录后调节因子,其表达和活性呈现出明显的时空特异性,与多种生理病理过程密切相关,具有成为生物标记的潜力[21-24]。本研究试图用我们建立的活细胞miRNA活性谱检测技术比较 BHK21、HEK293和 Vero三种常见的肾细胞的 miRNA活性谱,从 miRNA水平上揭示BHK21细胞的特性。
我们首先扫描获得了 BHK21、HEK293和Vero三种细胞中 58种 miRNA活性谱,比较发现miR-206在BHK21细胞中特征性高活性。随后,以成肌细胞 C2C12为阳性对照,人胚肾细胞 HEK293为阴性对照,进一步证明了 BHK21细胞中miR-206的高活性及高表达。最后,采用马血清诱导培养BHK21细胞,发现miR-206活性和表达水平都升高,并且miR-206的靶基因之一Cx43蛋白的表达明显下调。
miR-206作为一种肌肉特异性miRNA,主要在肌肉组织及其来源细胞系中表达[25]。BHK21细胞在马血清诱导培养下部分细胞发生融合出现多核细胞,能够表达横纹肌特征性蛋白,表明BHK21细胞具有成肌细胞特性。本研究首次发现miR-206在BHK21细胞中的高活性和高表达,从miRNA水平上揭示了BHK21细胞的成肌细胞特征。而且 BHK21细胞为成纤维细胞,区别于同为肾脏来源的上皮细胞样的 HEK293和 Vero细胞,说明 BHK21细胞可能来源于肾脏的间质细胞。
BHK21细胞经马血清诱导后,miR-206的活性和表达水平明显升高,且细胞间连接蛋白Cx43的表达水平下降。保守性序列分析发现 BHK21细胞的Cx43基因的3′UTR区存在miR-206的靶序列,说明miR-206可能通过抑制Cx43蛋白的表达参与马血清诱导的 BHK21发育分化过程。提示 BHK21细胞可以作为一种有效的细胞模型,用于 miR-206的功能和表达活性调节机制研究。
miR-206在 BHK21细胞中特征性高活性和高表达,提示miR-206可以作为一种生物标记分子,用于BHK21细胞的鉴定。BHK21细胞在诱导分化后miR-206活性和表达水平明显升高,提示 miR-206可能作为一种向肌细胞分化的分子标志物。
BHK21细胞表达miRNA种类和成熟序列信息的缺乏限制了BHK21细胞中miRNA表达和功能性研究。本研究通过miRNA成熟序列同源性分析确定了 58种 BHK21细胞中可能表达的miRNA及序列信息,利用活细胞miRNA活性谱检测技术初步了解了58种miRNA在BHK21细胞中的活性水平,为这些 miRNA的功能研究提供了基础。
总之,利用活细胞miRNA活性谱检测技术,首次在BHK21细胞中发现了miR-206特征性高活性,并验证了这一发现,初步探索了miR-206在 BHK21细胞经马血清诱导分化过程中可能的作用机制,表明 miR-206可以作为一种 BHK21细胞特征性的生物标记。本研究还提示 BHK21可以用作miR-206功能研究的细胞模型,BHK21细胞来源于金黄地鼠肾脏,探索非肌肉来源细胞中 miR-206的表达机制,可能有助于揭示miR-206肌肉特异性表达的原因。这是我们下一步拟开展的工作。
[1]Bartel DP. MicroRNAs: genomics, biogenesis,mechanism, and function. Cell, 2004, 116(2):281−297.
[2]Ambros V. The functions of animal microRNAs.Nature, 2004, 431(7006): 350−355.
[3]Filipowicz W, Bhattacharyya SN, Sonenberg N.Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight? Nat Rev Genet, 2008, 9(2): 102−104.
[4]Lagos-Quintans M, Rauhut R, Yalcin A, et al.Identification of tissue-specific microRNAs from mouse. Curr Biol, 2002, 12(9): 735−739.
[5]Wienholds E, Kloosterman WP, Miska E, et al.MicroRNA expression in zebrafish embryonic development. Science, 2005, 309(5732): 310−311.
[6]Landgraf P, Rusu M, Sheridan R, et al. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell, 2007, 129(7):1401−1414.
[7]Carrington JC, Ambros V. Role of microRNAs in plant and animal development. Science, 2003,301(5631): 336−368.
[8]Schichel R, Boyerrinas B, Park SM, et al.MicroRNAs: key players in the immune system differentiation, tumorigenesis and cell death.Oncogene, 2008, 27(45): 5959−5974.
[9]Sun W, Julie Li YS, Huang HD, et al. microRNA: a master regulator of cellular processes for bioengineering systems. Annu Rev Biomed Eng,2010, 12: 1−27.
[10]Pay TW, Boge A, Menard FJ, et al. Production of rabies vaccine by an industrial scale BHK 21 suspension cell culture process. Dev Biol Stand,1985, 60:171−174.
[11]Stoker M and Macpherson I. Syrian hamster fibroblast cell line BHK21 and its derivatives.Nature, 1964, 203: 1355−1357.
[12]Tian W, Dong X, Liu X, et al. High-throughput functional microRNAs profiling by recombinant AAV-based microRNA sensor arrays. PLoS ONE,2012, 7(1): e29551.
[13]Kiezun A, Artzi S, Modai S, et al. miRviewer: a multispecies microRNA homologous viewer. BMC Res Notes, 2012, 5: 92.
[14]Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets.Cell, 2005, 120(1): 15−20.
[15]Brennecke J, Stark A, Russell RB, et al. Principles of microRNA-target recognition. PLoS Biol, 2005,3(3): e85.
[16]McCarthy JJ. MicroRNA-206: The skeletal muscle-specific myomiR. Biochim Biophys Acta,2008, 1779(11): 682−691.
[17]Schaart G, Pieper FR, Kuijpers HJH, et al. Baby hamster kidney (BHK-21/C13) cells can express striated muscle type proteins. Differentiation, 1999,46(2): 105−115.
[18]Taulli R, Bersani F, Foglizzo V, et al. The muscle-specific microRNA miR-206 blocks human rhabdomyosarcoma growth in xenotransplanted mice by promoting myogenic differentiation. J Clin Invest, 2009, 119(8): 2366−2378.
[19]Chen JF, Tao Y, Li J, et al. microRNA-1 and microRNA-206 regulate skeletal muscle satellite cell proliferation and differentiation by repressing Pax7. J Cell Biol, 2010, 190(5): 867−879.
[20]Anderson C, Catoe H, Werner R. miR-206 regualtes connexin43 expression during skeletal muscle development. Nucleic Acids Res, 2006,34(20): 5863−5871.
[21]Mitchell PS, Parkin RK, Kroth EM, et al.Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA, 2008, 105(30): 10513−10518.
[22]Cho WC. MicroRNAs: potential biomarkers for cancer diagnosis, prognosis and targets for therapy.Int J Biochem Cell Biol, 2010, 42(8): 1273−1281.
[23]Mattie MD, Benz CC, Bowers J, et al. Optimized high-throughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies. Mol Cancer,2006, 5:24.
[24]Corsini LR, Bronte G, Terrasi M, et al. The role of microRNAs in cancer: diagnostic and prognostic biomarkers and targets of therapies. Expert Opin Ther Targets, 2012, 16(Suppl 2): S103−109.
[25]Politz JC, Zhang F, Pederson T. MicroRNA-206 colocalizes with ribsome-rich regions in both the nucleolus and cytoplasm of rat myogenic cells.Proc Natl Acad Sci USA, 2006, 103: 18957−18962.
