慢病毒载体转录通读率检测方法的建立
2013-09-04何佳平方彧聃张帆孙凤强王娟张敬之
何佳平,方彧聃 ,张帆,孙凤强,王娟,2,张敬之 ,2
1 上海市儿童医院 上海交通大学附属儿童医院 上海交通大学医学遗传研究所,上海 200040
2 卫生部医学胚胎分子生物学重点实验室暨上海市胚胎与生殖工程重点实验室,上海 200040
转录通读 (Read-through) 是指RNA聚合酶复合物在转录过程中遇到转录终止信号 (如AAUAAA signal) 时不能被正常终止,而是读过终止信号继续转录下游DNA序列的现象 (图1)。它经常发生在病毒或病毒载体基因的转录过程中。目前广泛使用的第3代慢病毒载体经过了自灭活改造 (删除U3启动子),进一步降低其产生重组型活病毒的可能性。然而,自灭活改造同时亦删除了 3端的转录终止上游序列 (USE) 从而提高了载体的转录通读水平[1]。转录通读现象的发生将有可能激活下游原本沉默的基因,这为慢病毒载体用以基因治疗带来了生物安全性方面的风险[2]。为了规避这种风险,研究者尝试在病毒载体中插入隔离子来降低通读率[3-7]。而建立一种快速有效的通读率检测方法,对于评估以上工作的效果,提高病毒载体的生物安全性具有重要意义。
目前测定转录通读水平的方法主要是通过流式细胞仪等手段,定量转录通读 mRNA所表达的蛋白产物。为了建立一种检测转录通读实际情况的方法,我们利用整合入染色体上的慢病毒载体原病毒 (Pro-viral vector) 的转录本中不存在5端U3,而只存在3端U3的原理,首先将总的病毒载体转录本以及其转录通读转录本用相应的不同的下游特异引物进行分别反转录,然后使用特异针对3端的U3定量引物和探针,通过
qRT-PCR来对转录通读率进行绝对定量。在此,我们的转录通读率定义是:通读mRNA的数量/(正常mRNA的数量+通读mRNA的数量) ×100%。
本研究以携带野生型 LTR (wLTR) 和自灭活LTR (ΔLTR) 的两种慢病毒载体作为研究对象进行通读率的检测,同时运用检测通读相对量的传统方法加以验证,以显示该方法的有效性和准确性。
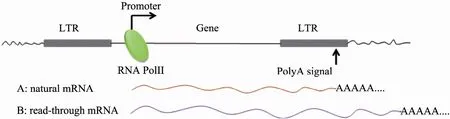
图1 病毒载体的转录通读现象Fig. 1 Phenomenon of transcriptional Read-through in viral vectors.
1 材料与方法
1.1 材料
大肠杆菌 TPO10宿主菌、pEGFP-N1载体(Invitrogen,美国) FUGW,NL4.3 (Addgene),PyrobestTaqE,ExTaqE,T4 DNA 连接酶,ApaⅠ,XhoⅠ,MluⅠ,NheⅠ,dNTPs,RTase M-MLV,RNase Inhibitor (TaKaRa,日本),Pac(New ⅠEngland Biolabs,NEB,美国) lipofectimin2 000,Trizol (Invitrogen公司),引物合成 (Generay公司,上海),定量引物及MGB探针合成 (GeneCore公司,上海)。
1.2 方法
1.2.1 载体构建
用 PCR方法扩出 HIV-1病毒株 NL4.3的3野生型 wLTR,扩增引物为 wLTR-XhoⅠ-F和wLTR-ApaⅠ-R。扩增产物经XhoⅠ和ApaⅠ双酶切后,接入pEGFP-N1多克隆位点SalⅠ和ApaⅠ之间,构建出 pEGFP-N1-wLTR载体 (图 2A)。用XhoⅠ和ApaⅠ双酶切下慢病毒载体FUGW上的经删减 U3的 3LTR,接入 pEGFP-N1的SalⅠ和ApaⅠ之间,构建出 pEGFP-N1-ΔLTR 载体(图 2B)。上述两个载体主要用于检测3LTR的通读情况。
用分子克隆手段在FUGW的U5和flap之间插入一个单一的NheⅠ位点,得到FUGW (NheⅠ)载体。随后在此基础上,将3LTR接入MluⅠ和NheⅠ之间获得 proFUGW-ΔLTR 载体 (图 2D);将两个 3wLTR 分别接入MluⅠ、NheⅠ之间和XhoⅠ、ApaⅠ之间获得 proFUGW-wLTR 载体(图2C)。上述两个载体可以用来模拟慢病毒整合入宿主基因组的情况,使检测更接近于实际的通读情况。
1.2.2 细胞转染
将 pEGFP-N1、pEGFP-N1-LTR、pEGFP-N1-wLTR、proFUGW-ΔLTR 和 proFUGW-wLTR 5种载体,以等摩尔方式用lipofectimin 2 000转染入293T细胞后,在37 ℃、5% CO2的条件下培养48 h,经0.25%胰酶消化细胞5~10 min后用含血清培养液终止反应。将细胞和培养液收集入1.5 mL的管中,离心弃上清后待用。

图2 载体构建图Fig. 2 Schematic diagram of the vectors. (A) pEGFP-N1-wLTR. (B) pEGFP-N1-ΔLTR. (C) proFUGW-wLTR.(D) proFUGW-ΔLTR.
1.2.3 qRT-PCR检测转录通读率
用 Trizol提取 pEGFP-N1-LTR、pEGFP-N1-wLTR、proFUGW-LTR和proFUGW-wLTR,4种载体转染细胞后的总 RNA。待分光光度计测定浓度后,取相同量的 RNA,分别用引物 RP和LTR3进行反转录。这两条引物分别设计在3LTR的R区域中PolyA信号 (AAUAAA) 位点的前后(图 3)。取 cDNA产物作为模版,以 FP、RP作为引物,以 MGB-Probe作为探针,进行定量PCR。反转录及定量反应体系同参考文献[8],所用引物探针序列见表1。ABI 7 500实时定量PCR仪上进行反应,反应条件为:95 ℃变性5 min;95 ℃ 30 s,59 ℃ 30 s,40 个循环;59 ℃时采集荧光,荧光检测波长为FAM 510 nm。反应结束后通过定量 PCR仪的分析软件对实验结果进行分析,并计算出通读率的变化:通读率=通读mRNA (以LTR3为引物进行逆转录获得cDNA)/总 mRNA (以 PA-RP为引物进行逆转录获得cDNA)。
1.2.4 荧光显微镜检测
在已离心弃上清的转染细胞沉淀中加入100 µL PBS,取少量单细胞悬液置于荧光显微镜下镜检,并检测GFP阳性细胞数及荧光强度。
1.2.5 FACS检测转染细胞荧光强度
取50 µL细胞的单细胞悬液,3 000 r/min离心5 min,弃上清,加入200 µL以PBS为主的鞘液,经流式细胞仪检测,计数5×104个细胞,计算GFP平均荧光强度。
1.2.6 数据分析
用Excel自带统计软件包,进行实验组间单因素方差分析。

图3 基于qRT-PCR检测转录通读率的方法Fig. 3 Flowchart of detecting Read-through rate by qRT-PCR.

表1 引物和探针序列Table 1 List of primers and probes
2 结果与分析
2.1 在 pEGFP-N1报告基因载体系统中检测病毒元件LTR的转录通读率
HIV载体的转录终止信号位于 3LTR的 R上。为了研究LTR的转录终止能力,我们把野生型 HIV的 LTR (wLTR) 和自灭活慢病毒载体的LTR (ΔLTR) 分别插入到表达载体pEGFP-N1中的多克隆位点 (MCS) 上 (图 2A,B),即位于CMV启动子和报告基因EGFP之间。EGFP表达越强表明LTR的转录终止能力越弱,而转录通读水平越高。
2.1.1 qRT-PCR检测转录通读率
带有两种类型LTR元件的表达载体pEGFPN1-ΔLTR和 pEGFP-N1-wLTR分别瞬时转染293T细胞。转染48 h后提取细胞的总RNA,经DNaseⅠ(RNase free) 处理去除残留的质粒DNA和基因组DNA。通过qRT-PCR的方法检测LTR的转录通读率。结果显示 (图4),自灭活慢病毒载体的 ΔLTR转录通读率达到了 64%,而 HIV病毒野生型wLTR的转录通读率较低,约为36%(n≥5,P<0.01)。
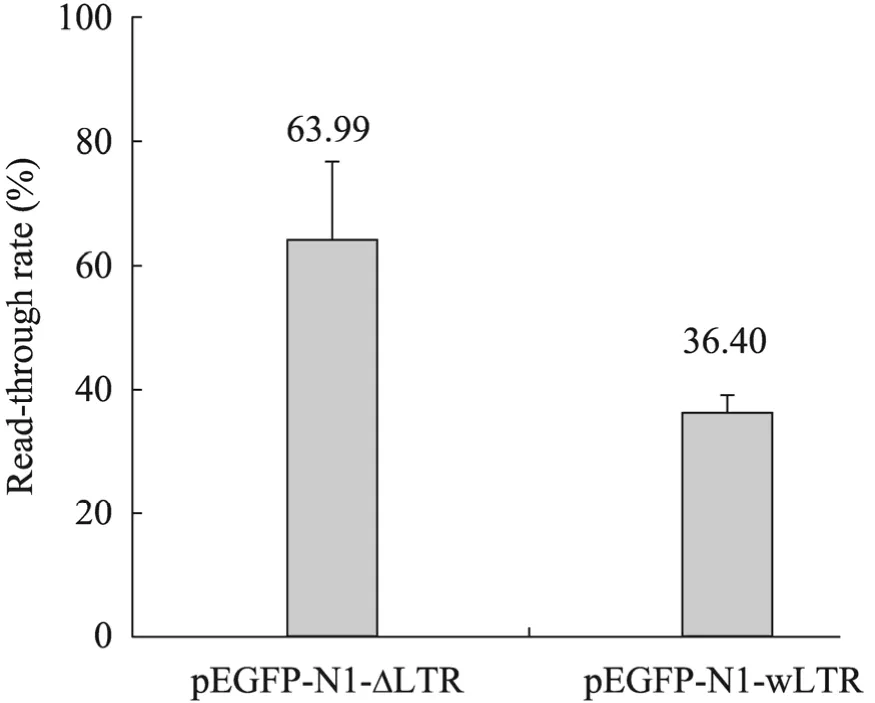
图4 qRT-PCR检测pEGFP-N1-wLTR和pEGFPN1-ΔLTR的转录通读率Fig. 4 Read-through rate of pEGFP-N1-wLTR and pEGFP-N1-ΔLTR detected by qRT-PCR.
2.1.2 通过检测 EGFP的蛋白表达来验证转录通读的效率。
基于 qRT-PCR检测转录通读的方法检测到的是通读率的绝对数值。为了验证该方法的准确性,我们在蛋白水平检测了转录通读的相对水平。表达载体 pEGFP-N1-ΔLTR 和 pEGFP-N1-wLTR分别瞬时转染 293T细胞 (以转染pEGFP-N1的293T作为阴性对照)。转染24 h后在荧光显微镜下观察EGFP的表达水平。荧光图片显示 (图 5) 插入 ΔLTR和 wLTR以后 EGFP阳性细胞数与阴性对照组相比均有显著的减少。这说明这两种LTR均有转录终止能力。但是,插入wLTR组比插入ΔLTR组的阳性细胞数要少的多,这说明ΔLTR比wLTR的转录通读率要高。上述细胞经胰酶消化,进行 FACS检测。FACS结果 (图 6) 与荧光镜检的结果相一致,插入wLTR组的平均荧光强度比插入ΔLTR组弱55%左右 (n≥5,P<0.01)。也就是说 ΔLTR的转录通读率高于wLTR,这一结果与qRT-PCR的结果相一致。因此,荧光显微镜镜检结果和FACS结果均验证了我们建立的基于 qRT-PCR检测转录通读率方法的准确性。
2.2 模拟病毒载体整合入染色质后的转录通读率检测
病毒载体颗粒感染细胞后,释放出mRNA,经反转录形成两端带有两个相同 LTR的双链DNA,并且整合入染色体中。整合入染色体中的病毒DNA被称为原病毒。检测病毒载体整合入细胞基因组中的转录通读率比检测单个 LTR的通读率更能反映其在染色体上的实际情况。由于慢病毒载体的随机整合特性,载体整合位点附近的染色体环境将极大地影响转录通读率。为了规避染色体环境因素的影响,我们用质粒来模拟病毒载体整合入基因组的序列,进行转录通读率的检测。

图5 pEGFP-N1、pEGFP-N1-wLTR和pEGFP-N1-ΔLTR转染293T的荧光显微镜镜检图 (400×)Fig. 5 Microscopic observation of 293T cells transfected with pEGFP-N1, pEGFP-N1-wLTR and pEGFP-N1-ΔLTR(400×). (A) 293T cells transfected with pEGFP-N1. (B) 293T cells transfected with pEGFP-N1-ΔLTR. (C) 293T cells transfected with pEGFP-N1-wLTR. A1, B1, C1: microscopic photos under the natural light; A2, B2, C2: microscopic photos under the natural light plus fluorescence; A3, B3, C3: microscopic photos under the fluorescence.

图6 pEGFP-N1、pEGFP-N1-wLTR和pEGFP-N1-ΔLTR的平均荧光强度Fig. 6 Mean fluorescent intensity of pEGFP-N1,pEGFP-N1-wLTR and pEGFP-N1-ΔLTR by FACS.
原病毒模拟载体 proFUGW-ΔLTR 和proFUGW-wLTR (图 2C,D) 分别转染 293T细胞。转染48 h后,通过基于qRT-PCR的方法检测转录通读率。检测结果显示 (图7),自灭活慢病毒载体的转录通读率为 59%左右,而携带wLTR的慢病毒载体转录通读率约为22% (n≥9,P<0.01)。
3 讨论
慢病毒载体是研究者们对人类 1型艾滋病毒 (Human immunodeficiency virus type 1,HIV-1) 进行拆分,改造而形成的一种高效基因介导载体[9-11]。

图7 qRT-PCR检测proFUGW-wLTR和proEGFPN1-ΔLTR的转录通读率Fig. 7 Read-through rate of proFUGW-wLTR and proEGFP-N1-ΔLTR detected by qRT-PCR.
在HIV-1的LTR (即wLTR) 中已知的转录终止调控序列包括:位于R区的多聚腺苷酸化信号AAUAAA元件,AAUAAA上游 59~76 nt、77~94 nt、141~176 nt间的 3个 USEs[12-14],位于U5富含 GC的 DSE[15-16]和位于 R和 U5接界的Poly (A) 位点[17]。慢病毒载体自灭活改造时,在删除U3启动子的同时删除了3'端的转录终止的一系列上游序列[18]。经删减后的LTR (即ΔLTR)与wLTR相比其通读率有显著的提高[1]。
而转录通读的危害在临床基因治疗中已有体现。在运用 γ-逆转录病毒进行临床基因治疗的过程中,一些接受治疗的病人却相继得了白血病[19-21]。
与γ-逆转录病毒载体类似,在使用自灭活慢病毒载体进行基因治疗的过程中,同样存在着因转录通读而造成激活下游基因的风险。正因如此,在用慢病毒载体治疗-地中海贫血的过程中,科学家们在△U3中插入了两个拷贝的鸡隔离 子 (The chicken β-globin 5′ DNaseⅠhypersensitive site 4 insulator,CHS4) 以减少转录通读率[22]。所以,在改造载体前后,需要有一种能够准确检测及评估通读率的方法。文中我们描述了用 qRT-PCR确定其转录通读的实际值的方法。在此过程中,我们使用了两套不同的特异性引物对慢病毒载体总转录本和通读转录本分别进行了反转录; 在此基础上,采用了同一套定量引物和探针分别对它们进行定量,从而避免了在扩增过程中两组cDNA的扩增效率的差异,保证了检测结果的准确性。
Yang等2007年报道了一种检测单一LTR转录通读率的较为复杂的方法,他们使用了 LacZ报告基因表达后染色来直观地显示通读率[1]。他们在蛋白活性上的检测数据与我们在 mRNA水平上模拟慢病毒载体在染色体上的情况相比尽管趋势相同,但数值小了很多,有可能是由于额外的翻译因素所造成的,因此,与他们的方法相比,我们的方法有可能更加准确地体现了转录通读的实际情况。通过对3'LTR和3'wLTR分别在转录和翻译水平上的分析,我们认为,我们所建立的方法能够有效和真实地体现慢病毒载体的转录通读率,为慢病毒载体改进工作提供了技术支持。
致谢:衷心感谢曾溢滔院士和任兆瑞教授对本文的悉心指导。
[1]Yang Q, Lucas A, Son S, et al. Overlapping enhancer/promoter and transcriptional termination signals in the lentiviral long terminal repeat.Retrovirology, 2007, 4(4):1−8
[2]Zaiss A, Son S, Chang L. RNA 3’readthrough of oncoretrovirus and lentivirus: implications for vector safety and efficacy. J Virol, 2002, 76(14):7209−7219.
[3]Ramezani A, Hawley TS, Hawley RG..Combinatorial incorporation of enhancer blocking components of the chicken β-globin 5′HS4 and human T-cell receptor α/δBEAD-1 insulators in self-inactivating retroviral vectors reduces their genotoxic potential. Stem Cells, 2008, 26(12):3257−3266.
[4]Chang L, Ding X, George S, et al. Genomic and functional assays demonstrate reduced gammaretroviral vector genotoxicity associated with use of the cHS4 chromatin insulator. Mol Ther, 2009, 17(4): 717−724.
[5]Paritha I, Tomoyasu H, Fabrizia U, et al. Genotoxic potential of lineage-specific lentivirus vectors carrying the β-globin locus control region. Mol Ther, 2009, 17(11): 1929−1937.
[6]Ramezani A, Hawley TS, Hawley RG. Reducing the genotoxic potential of retroviral vectors.Methods Mol Biol, 2008, 434: 183−203.
[7]Hideki H, Motoko Y, Huifen Z, et al. Optimized lentiviral vector design improves titer and transgene expression of vectors containing the chicken β-globin locus HS4 insulator element. Mol Ther, 2009, 17(4): 667−674.
[8]Ma H,Fang YD,Zhang JZ. A novel method for the determination of recombinant lentiviral titer and infectivity by qRT-PCR. Life Sci Res, 2009, 13(5):394−398 (in Chinese).
马海燕, 方彧聃, 张敬之. 应用荧光实时定量PCR方法检测重组慢病毒滴度及感染率. 生命科学研究, 2009, 13(5): 394−398.
[9]Poznansky M, Lever A, Bergeron L, et al. Gene transfer into human lymphocytes by a defective human immunodeficiency virus type 1 vector. J Virol, 1991, 65(1): 532−536.
[10]Naldini L, Blomer U, Gallay P, et al.In vivogene delivery and stable transduction of nondividing cells by a lentiviral vector. Science, 1996,272(5259): 263−265.
[11]Zufferey R, Nagy D, Mandel RJ, et al. Multiply attenuated lentiviral vector achieves efficient gene deliveryin vivo. Nat Biotechnol, 1997, 15(9):871−875.
[12]Valsamakis A, Zeichner S, Carswell S, et al. The human immunodeficiency virus type 1 polyadenylylation signal: A 3' long terminal repeat element upstream of the AAUAAA necessary for efficient polyadenylylation. Proc Natl Acad Sci USA, 1991, 88(6): 2108−2112.
[13]Gregory M, Elizabeth S, Joyce O, et al. Activation of HIV-1 pre-mRNA 3' processingin vitrorequires both an upstream element and TAR. EMBO J,1992, 11(12): 4419−4428.
[14]Valsamakis A, Schek N, Alwine JC, et al. Elements upstream of the AAUAAA within the human immunodeficiency virus polyadenylation signal are required for efficient polyadenylationin vitro. Mol Cel Boil, 1992, 12(9): 3699−3705.
[15]Böhnlein S, Hauber J, Cullen BR. Identification of a U5-specific sequence required for efficient polyadenylation within the human immunodeficiency virus long terminal repeat. J Virol, 1989, 63(1): 421−424.
[16]Brown PH, Tiley LS, Cullen BR, et al. Effect of RNA secondary structure on polyadenylation site selection. Genes Dev, 1991, 5(7): 1277−1284.
[17]Dezazzo JD, Kilpatrick JE, Imperiale MJ, et al.Involvement of long terminal repeat U3 sequences overlapping the transcription control region in human immunodeficiency virus type 1 mRNA 3'end formation. Mol Cel Boil, 1991, 11(3):1624−1630.
[18]Zufferey R, Dull T, Ronald J, et al.Self-inactivating lentivirus vector for safe and efficientin vivogene delivery. J Virol, 1998,72(12): 9873−9880.
[19]Hacein-Bey-Abina S, Von Kalle C, Schmidt M, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1.Science, 2003, 302(17): 415−419.
[20]Hacein-Bey-Abina S, Garrigue A, Wang GP, et al.Insertional oncogenesis in 4 patients after retrovirus-mediated gene therapy of SCID-X1. J Clin Invest, 2008, 118(9): 3132−3142.
[21]Hacein-Bey-Abina S, Hauer J, Lim A, et al.Efficacy of gene therapy for X-linked severe combined immunodeficiency. N Engl J Med, 2010,363(4): 355−364.
[22]Ramezani A, Hawley TS, Hawley RG. Performance and safety-enhanced lentiviral vectors containing the human interferon-β caffold attachment region and the chicken-globin insulator. Blood, 2003,101(12): 4717−4724.
