人视黄醇结合蛋白4在杆状病毒系统中的表达及其多克隆抗体制备
2013-09-04任玉莹陈丹郭玉争史洪娜刘娟班靖洋刘亚宁吴晓芳王维龙程海李鼎锋刘勇王立良
任玉莹,陈丹,郭玉争,史洪娜,刘娟,班靖洋,刘亚宁,吴晓芳,王维龙,程海,李鼎锋,刘勇,王立良
北京安百胜生物科技有限公司,北京 100176
视黄醇类 (Retinoids) 是维生素 A(VitaminsA,vitA) 在体内各种代谢物的统称,主要包括视黄醇 (Retinol)、视黄醛 (Retinene)和视黄酸 (Retinoic acid,RA),它们是一类疏水性分子,广泛分布于细胞内、外环境中[1]。视黄醇结合蛋白4 (Retinal binding protein4,RBP4) 是一种分泌型的运载蛋白,属于疏水性的小分子结合蛋白家族,分子量约21 kDa,含有201个氨基酸残基和 3个二硫键[2-3],正常生理情况下主要在肝脏中合成,释放入血后与视黄醇 (ROH) (维生素 A)、甲状腺素运载蛋白 (TTR) 以 1∶1∶1的比例形成三元复合物,是体内运送视黄醇至其特定靶组织的运载蛋白[4]。当 RBP4与细胞表面的RBP4受体结合后,视黄醇进入细胞内,复合物解体,游离的 RBP从肾小球滤出,其中绝大部分被近端肾小管上皮细胞重吸收并被分解,供组织利用,仅有少量从尿中排出[5]。
目前,临床上用于肾功能损伤早期诊断的尿小分子蛋白主要是 β2微球蛋白和 RBP4。β2微球蛋白在pH<5.5时很不稳定,易降解,取尿液标本后应立即调pH至中性。而且β2微球蛋白在尿液中的半衰期较短:pH 4.0、4 ℃放置4 h后有70%的降解,而RBP4在相同条件下仅降解5%[6]。因此,RBP4相对于 β2微球蛋白在肾功能损伤诊断中更稳定、更可靠。
近年来大量研究报道,血清和尿液中 RBP4是一个较敏感的指标,且随着病程发展在反映早期肾损害时优于 β2微球蛋白和尿微量白蛋白[7-9],在糖尿病、肾病早期,尿RBP4排泄增加先于微白蛋白尿出现,被认为是反映早期肾损害的标志[10]。
原核表达系统表达蛋白通常作为获得目的蛋白的首选方案,其表达量高、周期短、成品低,但绝大多数重组蛋白都以包涵体形式存在且没有活性或者活性很低,其蛋白构象通常与天然蛋白差异很大,这些是研究人员考虑的主要问题。本实验室曾用E. coli系统表达人RBP4与其他报道一致,重组蛋白全部为包涵体,且复性困难活性低下。因此本文选用昆虫杆状病毒表达系统制备重组人 RBP4,获得较高的表达量,并制备高质量的抗体,为后续的产品开发提供理论依据及实验数据。
1 材料与方法
1.1 细胞、菌种和质粒
Sf9昆虫细胞,大肠杆菌TOP10、DH10Bac,pFastBac-dual 质粒 (简称 pFBd)。
1.2 主要试剂和仪器
PyrobestTaq、DNA连接酶、限制性内切酶(TaKaRa);DNA凝胶回收试剂盒、小量质粒提取试剂盒 (OMEGA公司);BAC/PAC试剂盒(Sigma 公司);Grace’s Insect Medium (Gibco 公司);GPM-115培养基 (金普诺安公司);胎牛血清 (缩写:FBS) (Gibco 公司);L-Glutamine (中文名称:谷氨酰胺,缩写L-Gln) (Hyclone公司);cellfectin reagent (Invitrogen 公司);DMSO(Sigma公司);山羊抗兔 IgG/辣根酶标记 (中杉金桥);人源RBP4 (购自桂林英美特公司);抗人RBP4兔多抗及大肠杆菌重组RBP4 (E-RBP4) 为实验室自制。Ⅱ
1.3 基因来源
杆状病毒密码子优化的bRBP4基因由本实验室保存。
1.4 RBP4重组bacmid的构建
1.4.1 信号肽与目的基因连接
pMD18-T-bRBP4 (实验室保存) PCR扩增bRBP4基因,(引物:bRBP4-for,bRBP4-rev见表1) 获得bRBP4基因。小量提取bacmid质粒,以其为模板,PCR方法扩增SS64信号肽片段 (引物:SS64-for,SS64-rev)。然后以bRBP4、SS64PCR产物为模板,PCR方法扩增SS64-bRBP4基因 (引物:SS64-for,bRBP4-rev) 反应条件:94 3 min℃ ;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,共 30 个循环;72 10 min℃ 。
1.4.2 重组转移质粒的构建
将 pFBd质粒与SS64-bRBP4基因分别用BamHⅠ和EcoRⅠ双酶切,并分别胶回收、连接,转化大肠杆菌 TOP10感受态细胞并涂布Amp-LB平板,37 ℃温箱培养过夜。次日从平板上挑取单菌落培养,提取质粒经双酶切(BamHⅠ+EcoRⅠ) 初步鉴定并送检测序。

表1 构建载体所用的引物Table 1 Primers used in vector construction
1.4.3 重组杆状病毒构建
将已鉴定的重组转移质粒 pFBd-SShRBP4和空白载体pFBd质粒分别转化到DH10bac感受态细胞,37 ℃摇床培养4 h后涂三抗平板 (卡那霉素、四环素、庆大霉素、X-gal、IPTG),于37 ℃孵箱培养48 h。挑取阳性单菌落LB扩增,按BAC/PAC试剂盒方法提取bacmid质粒。PCR扩增初步鉴定 (引物:PHsequ-F,M13-R) 反应条件:94 3 min℃ ;94 ℃ 30 s,55 ℃ 30 s,72 ℃90 s,共30个循环;72 10 min℃ 。将鉴定正确的重组质粒命名为rbacmid-RBP4,于−20 ℃冰箱冻存备用。
1.5 细胞培养
Sf9细胞于Grace培养基 (10%胎牛血清、1% GLN) 中培养,培养温度 27 ℃,细胞调整到对数生长期。
1.6 转染表达
将 Sf9细胞接种到六孔板,接种量为9×105cells/孔,贴壁15~30 min备用,余下细胞扩增维持培养。各取 rbacmid-RBP4、rbacmid-pFBd 1~2 μg 按说明书 (Bac-to-Bac expression manual,Invitrogen) 分别进行转染。转染混合物加入细胞后,27 ℃孵育5 h,然后换液继续培养,逐日观察细胞病变。27 ℃培养72 h或出现明显病变时结束培养。收集六孔板内上清液作为P1代病毒进行转接扩增,P1毒种取5 L接种到T25细胞瓶,继续培养至出现明显病变,无菌收集上清记为 P2代毒种。按试剂盒说明书进行滴定。
表达与鉴定:取 5瓶对数期 Sf9细胞 (T75培养瓶,密度70%),将P2代毒种以MOI=1接种,继续培养至出现明显病变后逐日收集样品,1000 r/min离心5 min,分离细胞及上清。用适量PBS重悬细胞,按1×105cells量通过SDS-PAGE和Western blotting进行检测和鉴定。抗RBP4的兔多抗和HRP标记的羊抗兔IgG被用于Western blotting来检测目的蛋白。
悬浮培养表达:将rbacmid-RBP4 P2代毒种接种到300 mL悬浮的培养细胞中,扩增培养,逐日取样 (1 mL) 分离上清、细胞进行SDS-PAGE和Western blotting检测和鉴定,其余按1.7操作。取表达样品 (上清、细胞裂解液) 做2n(n=0,1,2) 倍比稀释并进行 SDS-PAGE检测,用标准品500 ng估测目的蛋白表达量。
1.7 纯化
细胞培养上清经0.45 μm滤膜过滤后,上样于金属 (Ni2+) 螯合琼脂糖凝胶层析柱 (26 mm×20 cm),流速8 mL/min。上样结束后,用平衡液(50 mmol/L PB+0.5 mol/L NaCl+ 20 mmol/L咪唑,pH 7.4) 充分洗平层析柱,依次用不同咪唑浓度的缓冲液洗脱 (50 mmol/L PB+0.5 mol/L NaCl+100 mmol/L咪唑,50 mmol/L PB+0.5 mol/L NaCl+500 mmol/L咪唑),收集A280吸收峰。SDS-PAGE检测纯化过程中RBP4的纯度,凝胶成像扫描分析蛋白纯度。
1.8 多克隆抗体的制备
选择2月龄健康新西兰大白兔制备多克隆抗体,抗原为杆状病毒系统表达并纯化的RBP4蛋白 (I-RBP4),同时将原核表达系统获得的同种蛋白 (E-RBP4,实验室保存)、购进的人尿液提纯的RBP4蛋白 (H-RBP4) 进行免疫,对比免疫效果,每个实验组5只兔。
初免用抗原0.25 mg/只 (0.25 mL) 与等体积弗氏完全佐剂混合,乳化1 h以混合物滴到液面不扩散为乳化完全,免疫时脊柱两侧皮下多点注射0.05 mL/点。并于第2周、4周用不完全佐剂加强免疫,第6周颈动脉取血,分离抗血清检测待用。
1.9 抗体效价及特异性测定
天然的人RBP4 (0.4 μg/mL) 包板检测血清效价,将血清样品以 10−3、10−4、10−5三个稀释度稀释,100 μL/孔 37 ℃孵育 30 min后洗板 5次,加入山羊抗兔IgG/辣根酶标记 (1∶3 000稀释) 100 μL/孔 37 ℃孵育 30 min后洗板 5次,室温显色 10 min后终止。Thermo酶标仪检测450 nm及630 nm的吸光度值。
同时将 Sf9细胞的培养上清、Sf9细胞破碎液 (超声破碎离心的上清液) 分别包板,检测血清样品,并确定其特异性。
1.10 RBP4抗原抗体亲和力试验
取80 nm微球8 mL活化30 min,pH 7.2 MES过柱,按 20∶3的量分别偶联硫铵初纯后抗体(E-RBP4 PcAb、I-RBP4 PcAb、H-RBP4 PcAb)(PcAb,polyclonal antibody 即多克隆抗体),室温混匀过夜,甘氨酸封闭1 h。用0.05% SDS洗涤微球3次,最后重悬于储存液中备用。测定前微球超声5 S:3 S,4次使其具有良好的分散度。将偶联抗体配入R2试剂。
参照安徽大千视黄醇结合蛋白检测试剂盒的检测方法,顺序加入S (S为安徽大千RBP4标准品),R1试剂 (Tris 50 mmol/L+NaCl 1 mol/L+BSA 0.1% pH 7.2),R2试剂 (偶联抗体+表面活性剂+稳定剂),R2加入后迅速混匀,测定A546,5 min后再次测定。
2 结果
2.1 重组转移质粒的鉴定
随机挑选3~5个阳性克隆经LB (100 μg/mL Amp) 过夜培养,提取重组质粒、经BamHⅠ和EcoRⅠ双酶切、1%琼脂糖凝胶电泳检测 (图1),有一条800 bp左右的片段产生,表明RBP4基因已经成功克隆至pFBd载体中,随后的测序结果显示目的基因RBP4序列与预期完全一致,命名为 pFBd-SShRBP4。

图1 重组转移质粒pFBd-SShRBP4的酶切鉴定Fig. 1 Identification of the recombinant pFBd-SShRBP4 by restriction endonulease digestion. M1:DNA marker DL2 000; M2: DNA marker DL15 000; 1:pFBd-SShRBP4 digested with BamH I and EcoR I.
2.2 重组RBP4-bacmid的鉴定
挑选 3~5个纯白色阳性克隆经 LB (含50 μg/mL 卡那霉素、10 μg/mL 四环素、7 μg/mL庆大霉素) 过夜培养并提取 bacmid DNA,以引物 (PHsequ-F、M13R) 进行 PCR进一步筛选鉴定,PCR产物的经1%琼脂糖凝胶检测,结果如图2所示,重组bacmid PCR产物在1 600 bp左右出现特异性条带 (而阴性对照 rbacmid-pFBd在800 bp处扩出单一条带,未附图),表明bacmid构建成功,命名rbacmid-RBP4。
2.3 细胞转染及鉴定
提取rbacmid-RBP4 DNA转染单孔细胞,逐日观察病变情况,结果见图3,细胞生长停止,肿胀、变圆,折光性增强,细胞核呈充满状态。部分细胞逐渐坏死、脱落,与正常细胞形成明显对比,表明转染成功 (图3)。

图2 重组rbacmid-RBP4的PCR鉴定Fig. 2 Identification of the recombinant rbacmid-RBP4 by PCR. M1: DNA marker DL 15 000; M2: DNA marker DL1 kb; 1: PCR production from rbacmid-RBP4.
2.4 蛋白表达量测定
按实验要求留取细胞悬液,离心,上清细胞分离,SDS-PAGE或Western blotting检测如下。
2.4.1 方瓶胞内表达
以rbacmid-RBP4 P2代毒种接种T75细胞,从细胞出现明显病变起开始收集样品,每天收集1瓶感染细胞,分离细胞、上清,分别电泳检测。结果见图4,在23 kDa处可看到清晰的特异性条带,与预测蛋白的分子量大小一致,表明 RBP4蛋白在Sf9细胞中成功表达。
2.4.2 悬浮扩增培养
以rbacmid-RBP4 P2代毒种感染悬浮培养细胞,感染4 d后取1 mL细胞悬液,1 000 r/min离心10 min,取10 L上清液加入等量缓冲液混匀,煮沸3 min,10 L点样检测目的蛋白分泌表达量。结果见图 5,表明 RBP4在悬浮培养的 Sf9细胞中得到高效表达。经与标准品对照计算表达水平不低于100 mg/L。
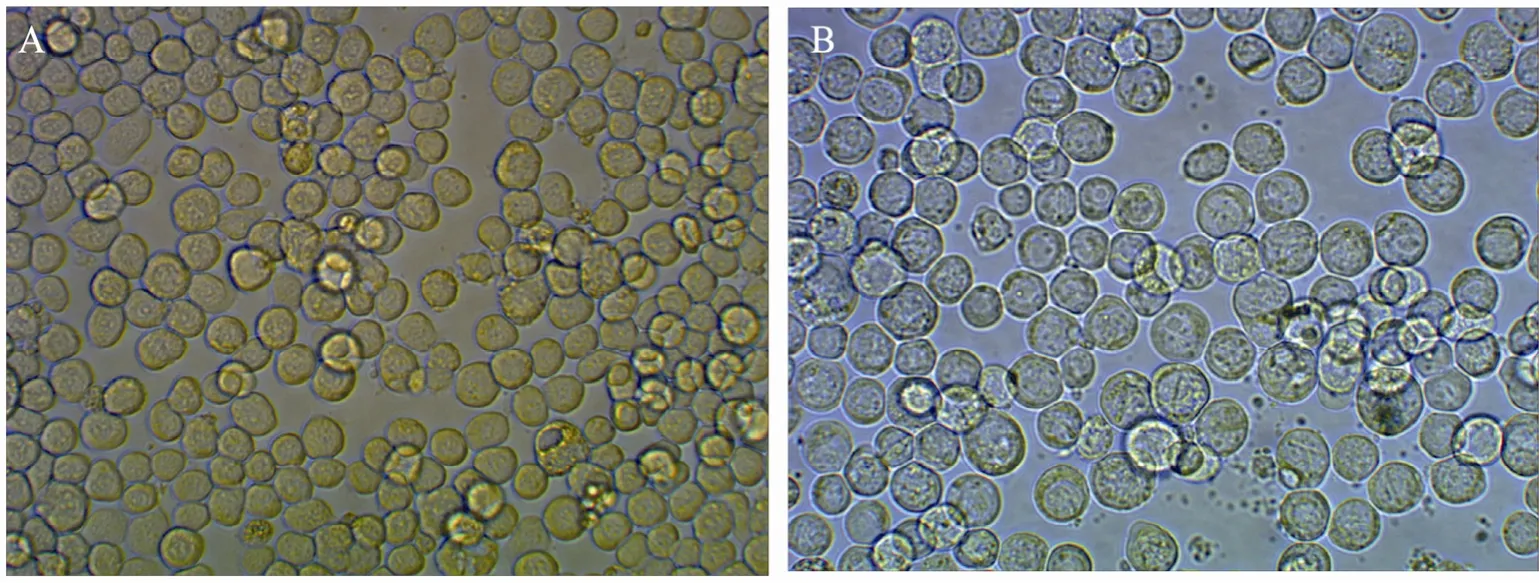
图3 正常Sf9细胞与转染Sf9细胞的形态对比 (400×)Fig. 3 Morphological comparison of the normal and transfected Sf9 cells (400×). (A) Normal Sf9 cells. (B)Transfected Sf9 cells.
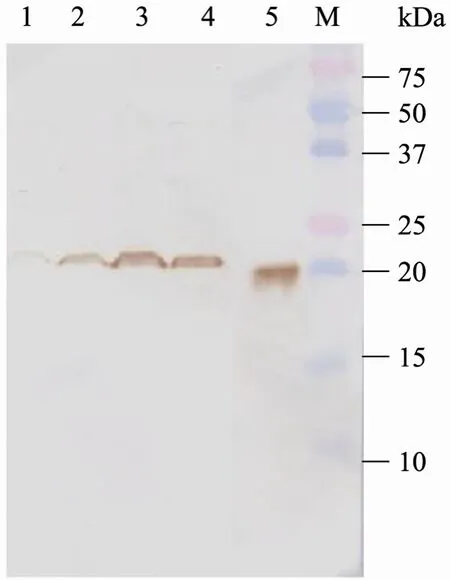
图4 Western blotting鉴定RBP4在Sf9细胞内的表达Fig. 4 Western blotting analysis of recombinant RBP4 protein in Sf9 cells. M: protein marker; 1−4: infected cells at 3rd/4th/5th/6th day post-infection; 5: RBP4 positive control.
2.5 目标蛋白的纯化
目标蛋白经金属 (Ni2+) 螯合层析柱纯化,产物SDS-PAGE分析,在分子量约23 kDa可见单一条带 (图 6)。纯化后 I-RBP4含量为36.5 mg/L,收获率为37%。
2.6 抗体制备
分别用杆状病毒系统表达的 I-RBP4、原核表达的 E-RBP4、人源 H-RBP4抗原免疫新西兰白兔,三针免疫获得高效价抗血清,I-RBP4三免后 1:105稀释度的血清OD450-630平均值为0.8850,而 E-RBP4三免后 1:105稀释度的OD450-630平均值为0.1575低于临界点,其抗体水平低于真核表达的,H-RBP4三免后1:105稀释度的OD450-630平均值为 1.2604 (图 7)。NC (兔阴性血清 1∶100稀释)OD450-630平均值为 0.047,BC (空白对照)OD450-630平均值为0.009,血清无非特异性结合,实验成立。从图上可以看出,杆状病毒系统表达的 I-RBP4抗原的免疫原性与人源H-RBP4抗原免疫原性接近,而远好于原核表达的E-RBP4抗原的免疫原性,提示杆状病毒系统表达的 I-RBP4蛋白具有类似人源 H-RBP4抗原的活性,而原核表达的 E-RBP4蛋白与人源H-RBP4抗原的活性相差很大。抗血清特异性检测结果表明:RBP4兔抗血清与 Sf9细胞 (培养基、细胞代谢物、细胞成分) 无交叉反应,验证其专属性。

图5 悬浮培养Sf9细胞表达RBP4的SDS-PAGE和Western blotting鉴定Fig. 5 SDS-PAGE and Western blotting analysis of recombinant RBP4 secreted by suspension cultured Sf9 cells. M:protein marker; 1: the supernatant from rbacmid-pFBd infected Sf9 cells at 72 h post-infection; 2: the supernatant from rbacmid-RBP4 infected Sf9 cells at 72 h post-infection.
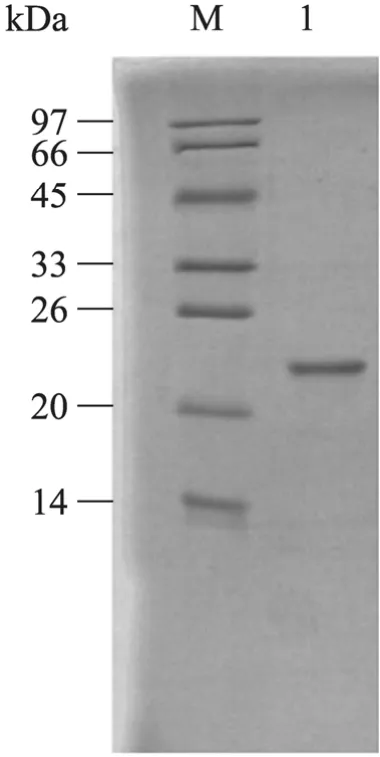
图6 Sf9细胞表达RBP4蛋白的纯化鉴定Fig. 6 Purification of protein secreted by Sf9 cells. M:protein marker; 1: after purification.
2.7 抗原抗体亲和力试验
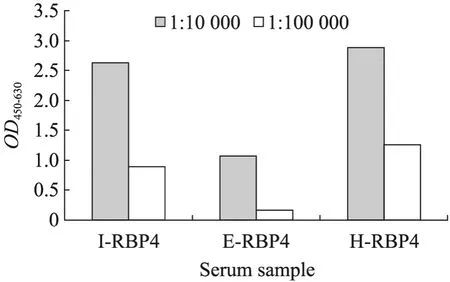
图7 RBP4兔抗血清ELISA效价测定Fig. 7 ELISA analysis of RBP4 rabbit antiserum.
利用抗原 (RBP4标准品) 与特异性抗体(兔抗人视黄醇结合蛋白抗血清) 相结合,形成不溶性免疫复合物,使反应液产生混浊,其浊度即反应样品中视黄醇结合蛋白的浓度。
试验中将不同来源的多克隆抗体与微球偶联,放大信号更有效地检测血清中低浓度的蛋白,紫外分光光度检测确定抗原抗体的结合率。由表2可见,I-RBP4多抗与H-RBP4结合效果相近,远高于E-RBP4多抗的效果。这提示本研究杆状病毒系统表达生产的重组蛋白 I-RBP4具有和人源H-RBP4相似的生物学特性 (活性、高级结构),而这些生物学特性为大肠杆菌生产的重组蛋白E-RBP4所不具备;这也验证了杆状病毒表达系统具有的优越性之一,即其重组产品绝大多数具有很好的活性。

表2 抗原抗体亲和力试验Table 2 Antigen-antibody affinity test
3 讨论
目前获得RBP4蛋白的方法主要有两个:其一,天然提纯化。正常人体液中,RBP4含量甚微,血液中,RBP4浓度维持在25~70 mg/L;尿液中含量为0.7 mg/L[11]。在肾功能损伤病人中,尿液含量仍然较低,约1~3 mg/24 h尿,且尿液中的RBP4以多聚物形式存在,蛋白纯化繁琐,成本较高,得率较低[12],不利于大量提取。其二,DNA重组技术制备。利用原核系统、真核系统表达目的蛋白。
原核系统表达目的产物主要为包涵体形式,多为错误折叠的RBP4和一些菌体蛋白以及核酸和一些脂类物质,需要复性才能得到具有活性及实际的应用价值,操作繁琐、难度大、收率低、成本高,在结构与功能上与天然蛋白有一定的差距;即使是在E. coli细胞内直接表达的可溶性蛋白,在与特异性抗体的识别上也有明显的差异。我们的动物免疫结果也证明了这点。
真核表达首选 Bac-to-Bac杆状病毒表达系统。此系统利用昆虫细胞高效表达多种重组蛋白,在生物制品的研发与生产中有很大的应用潜力[13-14],并且有各种优化方案可供选择[15-17]。采用该系统重组病毒 DNA不含有亲代病毒,免除空斑纯化,节省成本提高效率。高滴度的病毒通过初步的转染而获得,这一特性将鉴定纯化重组病毒的时间从4~6周缩减到7~9 d[18],同时阳性克隆的转化率从0.1%~1%提高到接近30%[19-20]。对脊椎动物而言意味着较好的生物安全性[21]。杆状病毒系统还具有其他表达系统不具有的特性,如容纳较大的外源 DNA (10 kb) 而不影响病毒的复制和装配;适合表达细胞毒性蛋白[22];可同时表达多种蛋白并完成病毒样颗粒的构建[23-24];利用生物反应器进行大规模的扩增培养[25];可以在虫体内表达生产蛋白,大大节约成本[26]等。
实验中利用EcoRⅠ和BamHⅠ两个酶切位点将RBP4片段亚克隆到pFBd供体质粒中,重组病毒的构建在 DH10Bac感受态细胞中完成,通过pFBd供体质粒上的mini-Tn7序列与bacmid上的 mini-attTn7序列进行转座,获得重组rbacmid-RBP4,并转染到Sf9细胞而获得重组的RBP4蛋白。
实验初期,采用Grace (含FBS 10%) 培养基进行贴壁培养的Sf9细胞表达目的蛋白,自感染第3天起收集细胞和上清检测,上清中表达量低未能检出目的蛋白,而胞内的表达从第3天起逐步加大,第5天达到最高。由上述摸索实验得出如下结论:Grace培养基能够支持目的蛋白的表达,但不是最佳的选择。在此基础上,逐步更换培养体系,用GPM-115 (含FBS 3%) 培养基逐步取代Grace培养基,实现细胞的悬浮培养,驯化后细胞从扩增速度、感染速度以及分泌表达上都有了一定的提高,当采用Grace培养基贴壁培养时,目的蛋白最大表达量出现在5~6 d,且仅为胞内表达;而优化条件后,细胞第3天即分泌大量目的蛋白并可持续到第5天,在无补料添加的条件下,表达量达100 mg/L以上。
真核细胞重组蛋白的优点通过家兔免疫实验得以证实。杆状病毒系统表达的RBP4蛋白,其免疫原接近人源的RBP4,而优于E. coli表达的 RBP4。这也从另一个角度证明了杆状病毒表达系统生产的蛋白具有天然免疫原性。
[1]Chen J, Zhou DJ. The classification, structure and function of retinol-binding proteins. Chem Life,2004, 24(2): 112−115 (in Chinese).
陈健, 周度金. 视黄醇类结合蛋白的分类、结构及功能. 生命的化学, 2004, 24(2): 112−115.
[2]Wang SS, Xu QS. Studies on retinol-binding proteins. Chem Life, 2000, 20(4): 165−167 (in Chinese).
王世春, 徐琪寿. 视黄醇结合蛋白研究. 生命的化学, 2000, 20(4): 165−167.
[3]Lin WP, Li SG, Xu QS. Molecular mechanism and clinical application of retinol-binding protein. Bull Acad Milit: Med Sci, 2005, 29(5): 492−495 (in Chinese).
林维平, 李思光, 徐琪寿. 视黄醇结合蛋白的分子机制及临床应用. 军事医学科学院院刊, 2005,29(5): 492−495.
[4]Smith CW, Patton JG, Nadal-Ginard B. Alternative splicing in the control of gene expression. Annu Rev Genet, 1989, 23: 527−577.
[5]Monaco HL, Rizzi M, Coda A. Structure of a complex of two plasma proteins: transthyret in and retinol-binding protein. Science, 1995, 268(5213):1039−1041.
[6]Blumsohn A, Morris BW, Griffiths H, et al.Stability of beta 2-microglobumin and retinol binding protein at different values of pH and temperature in normal and pathological urine. Clin Chim Acta, 1991, 195(3): 133−137.
[7]Xing JH, Wu K, Gao L. Diagnostic values of CysC,RBP, MA, NAG and β2-MG during early renal damage in type 2 diabetes. Exper Lab Med, 2010,28(3): 243−244 (in Chinese).
熊建辉, 吴凯, 高龙. 辨析 CysC、RBP、MA、NAG、β2-MG对2型糖尿病肾脏早期损害的诊断价值. 实验与检验医学, 2010, 28(3): 243−244.
[8]Wei YP, Zhang J, Yang JP. Diagnostic values of combined detection of serum cystatin C and four classes of urine proteins in early diabetic nephropathy. Chin J Clin Res, 2011, 24(8): 722 (in Chinese).
魏宇鹏, 张季, 杨金萍. 血胱抑素 C和尿中 4种蛋白联合检测对早期糖尿病肾病的诊断价值. 中国临床研究, 2011, 24(8): 722.
[9]Liu N, Wang XZ. Early diagnostic markers of acute renal failure. Exper Lab Med, 2009, 27(1): 72−74(in Chinese).
刘宁, 王小中. 急性肾衰竭的早期诊断标志物.实验与检验医学, 2009, 27(1): 72−74.
[10]Koch A, Weiskirchen R, Sanson E, et al.Circulating retinol binding protein 4 in critically ill patients before specific treatment: prognostic impact and correlation with organ function,metabolism and inflammation. Crit Care, 2010,14(5): R179.
[11]Deng RC, Shi QF. Progresses in clinical application of retinol-binding protein. Exper Lab Med, 2012,30(1): 40−43 (in Chinese).
邓荣春, 施桥发. 视黄醇结合蛋白临床应用进展.实验与检验医学, 2012, 30(1): 40−43.
[12]Jin H, Gao LX, Wang ZY, et al. Purification of retinol-binding protein and preparation of its antiserum. Progr Biochem Biophys, 1993, 20(6):460−463 (in Chinese).
金宏, 高兰兴, 王宗印, 等. 视黄醇结合蛋白的分离纯化及其抗血清的制备. 生物化学与生物物理进展, 1993, 20(6): 460−463.
[13]Cox MM. Recombinant protein vaccines produced in insect cells. Vaccine, 2012, 30(10): 1759−1766.
[14]Vicente T, Roldão A, Peixoto C, et al. Large-scale production and purification of VLP-based vaccines.J Invertebr Pathol, 2011, 107(Suppl): S42−S48.
[15]Hitchman RB, Locanto E, Possee RD, et al.Optimizing the baculovirus expression vector system. Methods, 2011, 55(1): 52−57.
[16]Li SF, Wang HL, Hu ZH, et al. Genetic modification of baculovirus expression vectors.Virol Sin, 2012, 27(2): 71−82.
[17]Aucoin MG, Mena JA, Kamen AA. Bioprocessing of baculovirus vectors: a review. Curr Gene Ther,2010, 10(3): 174−186.
[18]Zhang WY, Yang XN, Jin DZ, et al. Expression and enzyme activity determination of human cyclooxygenase-1 and -2 in a baculovirus-insect cell system. Acta Pharmacol Sin, 2004, 25(8):1000−1006.
[19]Hartig PC, Cardon MC. Rapid efficient production of baculovirus expression vectors. J Virol Methods,1992, 38(1): 61−70.
[20]Kitts PA, Ayres MD, Possee RD. Linearization of baculovirus DNA enhances the recovery of recombinant virus expression vectors. Nucleic Acids Res, 1990, 18(19): 5667−5672.
[21]Van Oers MM. Opportunities and challenges for the baculovirus expression system. J Invertebr Pathol, 2011, 107 (suppl): S3−S15.
[22]Bel Haj Rhouma R, Cérutti-Duonor M, Benkhadir K, et al. Insecticidal effects ofButhus occitanustunetanus BotIT6 toxin expressed inEscherichia coliand baculovirus/insect cells. J Insect Physiol,2005, 51(12): 1376−1383.
[23]Chung CY, Chen CY, Lin SY, et al. Enterovirus 71 virus-like particle vaccine: improved production conditions for enhanced yield. Vaccine, 2010,28(43): 6951−6957.
[24]Palomares LA, Mena JA, Ramírez OT.Simultaneous expression of recombinant proteins in the insect cell-baculovirus system: production of virus-like particles. Methods, 2012, 56(3): 389−395.
[25]Maranga L, Cunha A, Clemente J, et al. Scale-up of virus-like particles production: effects of sparging,agitation and bioreactor scale on cell growth,infection kinetics and productivity. J Biotechnol,2004, 107(1): 55−64.
[26]Wu TY, Chen HA, Li FY, et al. High-level expression, purification and production of the fungal immunomodulatory protein-gts in baculovirus-infected insect larva. Appl Biochem Biotechnol, 2013, 169(3): 976−989.
