miR-24通过靶基因Sp1调控β-类珠蛋白表达
2013-09-04马艳妮王斌巩蓓王芳赵华路张俊武余佳
马艳妮,王斌,巩蓓,王芳,赵华路,张俊武,余佳
中国医学科学院基础医学研究所 医学分子生物学国家重点实验室,北京 100005
MicroRNA (miRNA) 是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,它们在动植物中参与转录后基因表达调控,以完全互补或不完全互补的形式与靶 mRNA结合,引起靶mRNA的降解或抑制靶mRNA的翻译进而对靶基因的表达进行负调控[1-2]。miRNA作为细胞内一类重要的非编码调控分子,它所介导的调控作用已经被认为是多细胞生物基因表达转录后水平的一种普遍调节方式[3-5]。随着被鉴别miRNA数量的不断增加和它们功能的陆续阐明,人们逐渐发现以miRNA为主导的基因转录后调控网络几乎参与了各种生命活动的各个环节。
人 β-类珠蛋白基因的表达具有明显的发育阶段时空特异性,其表达限制在红细胞链系内并且由发育程序精确控制[6-7]。β-类珠蛋白基因作为研究真核基因表达调控非常好的模型而被广泛研究,珠蛋白基因的启动子、增强子及位于基因簇上游的位点控制区 (LCR) 等顺式调控元件以及调控珠蛋白表达的各种反式作用因子已经研究得相对清楚,但调控珠蛋白基因的miRNA分子却非常少。因此我们从红系分化过程中差异表达的miRNA着手,希望找到直接或间接调控珠蛋白表达的miRNA分子。我们从芯片数据中找到63个在红系分化过程中表达变化的miRNA,但通过软件预测,这些 miRNA都与珠蛋白的3'UTR区没有直接的相互作用。而在分化过程中逐渐上升的miR-24被预测可以靶向Sp1这一负调节珠蛋白表达的转录因子。Sp1属于 Sp/Kruppel转录因子家族,广泛表达于各种组织,可与富含GC或 GT盒的DNA序列结合行使转录因子功能[8]。Sp1既可以正向促进靶基因的表达,也可以通过转录抑制因子的作用负调控一些靶基因[9-10]。我们在之前的研究中已证明Sp1对于珠蛋白的负调控作用。而 miR-24已被广泛报道在多种肿瘤发生过程中具有重要作用,参与调节细胞增殖、细胞凋亡、细胞分化等生物学过程[11-14],但其在珠蛋白表达中的作用还未见报道。
我们发现miR-24在hemin诱导的K562细胞以及 EPO诱导的造血干/祖细胞向红系分化过程中表达上升,且miR-24的过表达能够促进K562细胞中 ε-和 γ-珠蛋白的表达。同时,miR-24确实可以通过与Sp13UTR区结合负调节Sp1的表达,其对于珠蛋白的调控作用依赖于Sp1。
1 材料与方法
1.1 主要试剂
K562细胞和293T细胞从中国医学科学院基础所细胞中心购买。淋巴细胞分离液Ficoll-Hypaque为Amersham Biotech公司产品。CD34+磁珠及分选试剂盒均为 Miltenyi Biotech公司产品。培养原代细胞所用细胞因子重组人白介素3 (rhIL-3),重组人干细胞因子(rhSCF),重组人促红细胞生成素(rhEpo) 均购自R&D公司。转染试剂lipofectamine 2000为Invitrogen公司产品。DharmafectI转染试剂、miRNA mimic或inhibitor以及Sp1 siRNA均为Dharmacon公司产品。双荧光检测试剂盒为Promega公司产品。提取 RNA所用 TRIZOl及反转录试剂盒为Invitrogen公司产品。实时定量PCR所用试剂为TaKaRa公司产品。实验中所用抗体分别为:Sp1抗体 (Milipore);-珠蛋白抗体 (Santa Cruz);-珠蛋白抗体 (Santa Cruz);GAPDH 抗体(Proteintech)。
1.2 细胞系的培养及诱导分化
人髓性白血病细胞系 K562细胞培养于RPMI-1640培养基中,293T细胞培养于DMEM培养基中,每100 mL培养液中加入10 mL胎牛血清 (FCS),100 U青霉素,100 μg链霉素。培养条件均为37 ℃,5% CO2及饱和湿度。K562细胞于诱导前1天更换新鲜的完全培养基,使其在诱导当天处于对数生长期。于第2天向处于对数生长期的K562细胞中加入30 μmol/L氯高铁血红素诱导其向红系分化。
1.3 CD34+造血干/祖细胞的分离
将所采集的新鲜脐带血标本以含 2 mmol/L EDTA的1×PBS按照1∶4体积进行稀释,并用淋巴细胞分离液 Ficoll-Hypaque (密度 1.077 g/mL)分离得到单个核细胞。单个核细胞进一步经CD34+磁珠分离得到 CD34+造血干/祖细胞,具体如下:2×108单个核细胞重悬于600 μL的分选缓冲液 (含 0.5% BSA的 PBS) 中,加入 200 μL的 FcR阻断剂到上清中,抑制非特异的抗体结合。进而加入200 μL的CD34多重分选微磁珠,6~12 ℃孵育30 min,后经分选缓冲液洗涤1次,重悬于适当体积的分选缓冲液中。将MS柱放在MACS磁铁上,将细胞悬液加到柱子顶端,让阴性细胞通过。把柱子移开分离器,用提供的塞子冲出阳性部分,分选缓冲液冲洗柱子,收集阳性细胞。
1.4 CD34+造血干/祖细胞的体外诱导红系分化
分离得到的CD34+细胞,按照1×105cells/mL的密度将细胞接种于5 mm培养皿中,1×IMDM,30%进口胎牛血清 (FCS),1%牛血清白蛋白(BSA),100 μmol/L β 巯基乙醇 (β-ME),2 ng/mL重组人白介素3 (rhIL-3),100 ng/mL重组人干细胞因子 (rhSCF),60 mg/mL青霉素和100 mg/mL链霉素,2 U/mL重组人促红细胞生成素 (rhEpo)。
1.5 实时定量PCR
在分化的不同时间点收集细胞,根据TRIZOl操作说明,提取细胞总RNA。提取的总RNA定量后,对于蛋白编码基因使用oligodT作为逆转录引物,对于 miRNA使用 miRNA特异的逆转录引物,使用反转录试剂盒合成cDNA第一链。使用适量的cDNA作为PCR模板,BioRad CFX-96进行PCR反应,SYBR染料实时检测扩增产物的量,以GAPDH为内参分析蛋白编码基因表达情况,以 U6为内参分析 miRNA的表达情况。所使用引物序列见表1。
1.6 寡核苷酸转染
miR-24及随机寡核苷酸使用DharmafectI转染试剂,按照操作说明转染K562细胞,终浓度为60 nmol/L,转染后24 h诱导向红系分化。表型回复实验使用 miR-24的抑制型寡核苷酸与Sp1 siRNA共转染 K562细胞,终浓度各为50 nmol/L,转染后24 h诱导向红系分化。
1.7 报告基因实验
将 Sp1 3UTR 区含 miR-24结合位点的300~500 bp序列克隆插入pMIR-reporter载体中,同时构建含与 miR-24序列完全互补片段的pMIR-reporter作为阳性对照。使用搭桥的方法获得Sp1 3UTR区miR-24结合位点突变的片段构建相应的突变克隆,所使用引物见表 1。0.4 µg pMIR-reporter质粒,0.02 µg pRL-TK,与 5 pmoL miRNA mimic或随机寡核苷酸对照共转染293T细胞,转染后48 h收集细胞,按照双荧光检测试剂盒说明书操作,检测报告基因表达水平。
1.8 Western blotting
收集细胞,提取总蛋白质,BCA法测定蛋白浓度。取20 μg蛋白样品进行SDS-PAGE电泳分离,并将蛋白样品转移至 PVDF膜上,5%脱脂奶粉室温封闭2 h后与兔抗人Sp1 (1∶1 000)4 ℃孵育过夜,TBST洗膜 3次后与山羊抗兔二抗 (1∶10 000) 室温孵育 2 h,TBST洗膜后经ECL显色,压片,显影。

表1 引物序列Table 1 Primer sequence
1.9 统计学分析
在数据分析过程中采用双总体t检验,P<0.05认为有统计学意义,标注为*,P<0.01标注为**,P<0.001标注为***。
2 结果与分析
2.1 miR-24在红系分化过程中表达上升
在 EPO诱导的造血干/祖细胞向红系分化过程中,分别于第4天、8天、11天和 18天收集细胞检测成熟 miR-24的表达水平,发现随着红系分化的进行,miR-24呈逐渐上升趋势 (图1A)。在 hemin诱导的 K562细胞红系分化过程中,miR-24也表现出显著的表达上调,且较原代造血干/祖细胞红系分化过程中的上升更为明显,如图1B所示,提示其可能对珠蛋白的表达具有一定的调控作用。
2.2 miR-24的过表达能够促进 K562细胞中珠蛋白的表达
为了进一步明确 miR-24对于珠蛋白的调控作用,我们在K562细胞中过表达miR-24,从图2A中可以看出miR-24在K562细胞中过表达成功。进而hemin诱导这些细胞向红系分化,在未诱导以及诱导48 h和72 h收集细胞检测γ-及ε-珠蛋白的表达情况。如图2B所示,miR-24的过表达能够明显促进红系分化过程中 γ-珠蛋白的表达,但在未诱导的情况下,miR-24的过表达对于珠蛋白无明显影响。同样 miR-24的过表达也能够促进红系分化过程中 ε-珠蛋白的表达(图 2C)。而且miR-24的过表达同样能够促进γ-及 ε-珠蛋白蛋白的表达 (图2D),这些结果充分说明miR-24确实能够参与调控珠蛋白基因的表达。
2.3 miR-24靶向转录因子Sp1
为了明确 miR-24调节珠蛋白基因表达的机制,我们通过 Targetscan预测了 miR-24的靶基因,其中之一就是对珠蛋白表达具有负调控作用的转录因子 Sp1,图 3A显示 Targetscan软件预测的 Sp13UTR区 miR-24的结合位点。我们进一步通过报告基因实验证明了 miR-24的过表达能够抑制包含Sp1 3UTR区的报告基因的表达,而在Sp1 3UTR区miR-24的结合位点突变后这种抑制作用消失 (图3B),充分说明miR-24确实通过与 Sp1 3UTR区的相互作用介导了对报告基因的负调控。为了进一步验证Sp1是 miR-24的靶基因,我们在 K562细胞中过表达 miR-24或抑制miR-24的表达后检测Sp1蛋白和mRNA水平的变化。如图3C所示,miR-24过表达后Sp1的蛋白水平确实出现明显的下降,相反地,miR-24的抑制却导致 Sp1蛋白水平的上调。同时,Sp1mRNA水平变化不明显,说明 miR-24可能通过抑制Sp1翻译影响其蛋白水平 (图3D)。这些结果充分说明Sp1确实是miR-24的新的靶基因。

图1 miR-24在红系分化过程中表达上升Fig. 1 miR-24 increased during erythroid differentiation. (A) miR-24 increased during Epo-induced human CD34+HPCs erythroid differentiation for 4, 8, 11 and 18 days. (B) miR-24 increased during hemin-induced K562 cell erythroid differentiation for 0, 24, 48 and 72 hours.

图2 miR-24能够促进红系分化过程中γ-及ε-珠蛋白的表达Fig. 2 Overexpression of miR-24 improved the γ-and ε-globin gene expression during erythroid differentiation. (A)miR-24 was successfully overexpressed in K562 cells. (B) Overexpression of miR-24 improved the γ-globin gene expression in hemin-induced K562 cells for 48 h and 72 h. (C) Overexpression of miR-24 improved the ε-globin gene expression in hemin-induced K562 cells for 48 h and 72 h. (D) Overexpression of miR-24 improved the protein level of γ- and ε-globin gene expression in hemin-induced K562 cells.
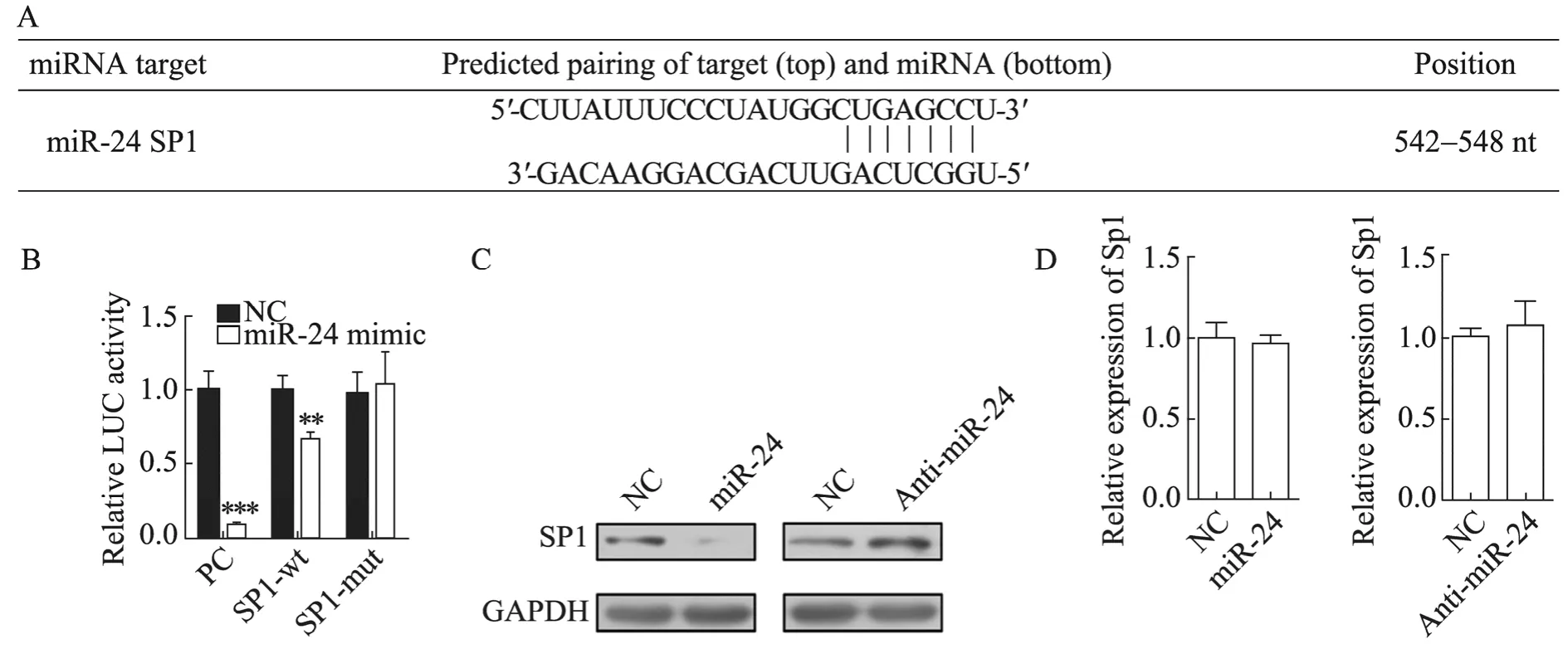
图3 Sp1是miR-24的新靶基因Fig. 3 Sp1 was a new target of miR-24. (A) A miR-24 binding site was predicted to be in 3' UTR of Sp1 by Targetscan. (B) The reporter assay showed that overexpression of miR-24 could repress the activity of luciferase and the repression was depended on the miR-24 binding site. (C) Western blotting of Sp1 in miR-24 overexpressing or repressing K562 cells. (D) mRNA level of Sp1 in miR-24 overexpressing or repressing K562 cells.
2.4 miR-24对于珠蛋白的正调控作用依赖于Sp1
miR-24能够促进珠蛋白的表达,又能通过转录后水平抑制 Sp1这一珠蛋白的负调节因子的表达,那么miR-24是否通过靶基因Sp1行使其对珠蛋白的调控作用呢?我们通过表型回复实验证明了 miR-24对于珠蛋白的调控作用确实依赖于 Sp1,即我们首先在 K562细胞中通过抑制型寡核苷酸抑制了miR-24的表达,在miR-24被抑制后,其靶基因Sp1的表达上调,同时 γ-及 ε-珠蛋白的表达被抑制。而在抑制 miR-24表达的基础上使用 siRNA抑制 Sp1的表达,由miR-24抑制所引起的 Sp1升高被部分抑制,同时 Anti-miR-24对 γ-及 ε-珠蛋白的抑制作用也被回复,充分说明 miR-24确实通过调节其靶基因Sp1的表达调控珠蛋白的表达。
3 讨论
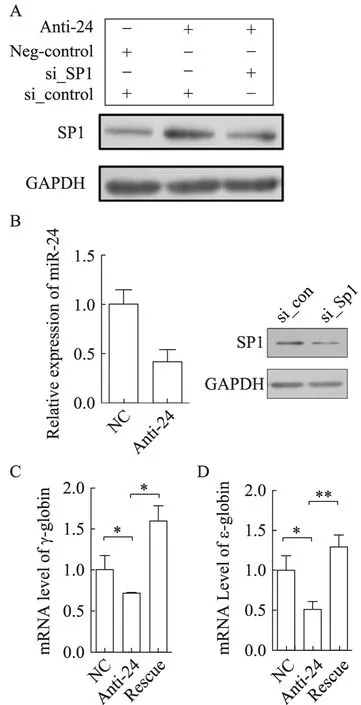
图4 miR-24通过调节Sp1的表达发挥对珠蛋白的调控作用Fig. 4 miR-24 regulated ε- and γ-globin gene expression through targeting Sp1. (A) Western blotting of Sp1 in K562 cells which were transfected with miR-24 inhibitors or miR-24 inhibitors combined with si_Sp1 for hemin induction 48 hours. (B) The repression of miR-24 in K562 cells by anti-24 and the suppression of Sp1 by si_Sp1. (C) Real-time PCR analysis of the expression of γ-globin in the above K562 cells. (D)Real-time PCR analysis of the expression of ε-globin in the above K562 cells.
miRNA是非编码RNA中研究最为深入,作用机制相对明确的一大类调控分子,其功能广泛,几乎涉及生命活动的各个方面,如组织器官发育、细胞增殖和凋亡、细菌和病毒感染、细胞代谢和癌症发生与转移等[15-16]。但关于miRNA在人 β-类珠蛋白基因的表达调控中的报道却非常少,这可能部分因为β-类珠蛋白基因,包括ε-,γ-,β-珠蛋白基因 3UTR非常短,根据软件预测能与之结合的miRNA很少,因此限制了miRNA在这一领域的研究。miR-96是唯一一个报道的以γ-珠蛋白为靶基因的miRNA分子,其可以结合至 γ-珠蛋白基因的编码区在转录后水平调节γ-珠蛋白的表达[17]。还有一些通过靶向珠蛋白表达相关的转录因子,间接地调节珠蛋白表达,如miR-144 通过靶基因klfd特异性地调控 α-珠蛋白的表达[18],miR-15a和 miR-16-1通过靶基因MYB参与13号染色体三体患者中胎儿血红蛋白的高表达[19]。我们在研究中发现 miR-24能够促进hemin诱导的 K562细胞中ε-和γ-珠蛋白的表达,这一发现丰富了miRNA在珠蛋白调控领域的研究。且 miR-24对于珠蛋白的这种促进作用依赖于对转录因子Sp1的抑制。转录因子Sp1被报道在人鼠杂交细胞系 A181γ中可与 β-类珠蛋白启动子区及珠蛋白上游高敏位点结合,并募集组蛋白去乙酰化酶从而抑制珠蛋白的表达[20]。因此在红系分化起始阶段,Sp1结合于珠蛋白基因上游,募集组蛋白去乙酰化酶,使得组蛋白去乙酰化而结合区域的染色质丧失转录活性。而miR-24能够抑制Sp1的表达,使Sp1表达下降,珠蛋白基因上游DNA区域被释放,进一步通过蛋白相互作用募集 PCAF组蛋白乙酰化酶使得组蛋白乙酰化从而激活珠蛋白基因的转录。
miR-24已被广泛报道参与调节细胞增殖、细胞凋亡、细胞分化等生物学过程,但关于其在珠蛋白表达中的调控作用,我们是首次报道。另外有一篇 miR-24参与调节红系分化的报道,认为miR-24通过靶向ALK4 (Activin type I receptor)阻断 K562细胞对 activin A的反应,从而抑制activin A所介导的红系分化以及红系分化过程中血红蛋白的积累[21]。但在我们的研究中却发现miR-24能够促进hemin诱导的k562细胞中珠蛋白的表达,说明不同信号所引发的红系分化过程是不同的,而同一个分子也可能在两个不同诱发剂所引起的相似过程中起不同作用。
总之,我们发现 miR-24在红细胞分化过程表达上调且对于珠蛋白的表达具有重要调控作用,miR-24的过表达可促进hemin诱导的K562细胞中 ε-、γ-珠蛋白的表达上升,且 miR-24对珠蛋白的促进作用是通过抑制负调节珠蛋白表达的转录因子Sp1实现的。
[1]Bartel DP. MicroRNAs: genomics, biogenesis,mechanism, and function. Cell, 2004, 116(2):281−297.
[2]Borel C, Deutsch S, Letourneau A, et al.Identification of cis- and trans-regulatory variation modulating microRNA expression levels in human fibroblasts. Genome Res, 2011, 21(1): 68−73.
[3]Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nat Rev Genet, 2010, 11(9): 597−610.
[4]Herranz H, Cohen SM. MicroRNAs and gene regulatory networks: managing the impact of noise in biological systems. Genes Dev, 2010, 24 (19):1339−1344.
[5]Frost RJ, van Rooij E. miRNAs as therapeutic targets in ischemic heart disease. J Cardiovasc Transl Res, 2010, 3(3): 280−289.
[6]Baron MH. Developmental regulation of the vertebrate globin multigene family. Gene Expr,1996, 6(3): 129−137.
[7]Stamatoyannopoulos G, Ntenhuis AW.Hemoglobin Switching: Molecular Basis of Blood Diseases. 2nd ed. Philadelphia: Philadelphia Press,1994: 107−156.
[8]Bouwman P, Philipsen S. Regulation of the activity of Sp1-related transcription factors. Mol Cell Endocrinol, 2002, 195(1/2): 27−38.
[9]Dynan WS, Tjian R. The promoter-specific transcription factor Sp1 binds to upstream sequences in the SV40 early promoter. Cell, 1983,35(1): 79−87.
[10]Kaczynski J, Cook T, Urrutia R. Sp1- and Krüppel-like transcription factors. Genome Biol,2003, 4(2): 206.
[11]Cheng AM, Byrom MW, Shelton J, et al. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis.Nucleic Acids Res, 2005, 33(4): 1290−1297.
[12]Lal A, Kim HH, Abdelmohsen K, et al.p16(INK4a) translation suppressed by miR-24.PLoS ONE, 2008, 3(3): e1864.
[13]Lal A, Navarro F, Maher CA, et al. miR-24 Inhibits cell proliferation by targeting E2F2, MYC, and other cell-cycle genes via binding to “seedless”3'UTR microRNA recognition elements. Mol Cell,2009, 35(5): 610−625.
[14]Takagi S, Nakajima M, Kida K, et al. MicroRNAs regulate human hepatocyte nuclear factor 4alpha,modulating the expression of metabolic enzymes and cell cycle. J Biol Chem, 2010, 285(7):4415−4422.
[15]Beezhold KJ, Castranova V, Chen F.Microprocessor of microRNAs: regulation and potential for therapeutic intervention. Mol Cancer,2010, 9: 134.
[16]Herranz H, Cohen SM. MicroRNAs and gene regulatory networks: managing the impact of noise in biological systems. Genes Dev, 2010, 24(13):1339−1344.
[17]Azzouzi I, Moest H, Winkler J, et al.MicroRNA-96 directly inhibits γ-globin expression in human erythropoiesis. PLoS ONE, 2011, 6(7):e22838.
[18]Fu YF, Du TT, Dong M, et al. Mir-144 selectively regulates embryonic α-hemoglobin synthesis during primitive erythropoiesis. Blood, 2009, 113(6):1340−1349.
[19]Sankaran VG, Menne TF, Šćepanović D, et al.MicroRNA-15a and -16-1 act via MYB to elevate fetal hemoglobin expression in human trisomy 13.Proc Natl Acad Sci USA, 2011, 108 (4): 1519−1524.
[20]Feng D, Kan YW. The binding of the ubiquitous transcription factor Sp1 at the locus control region represses the expression of beta-like globin genes.Proc Natl Acad Sci USA, 2005, 102 (28):9896−9900.
[21]Wang Q, Huang Z, Xue H, et al. MicroRNA miR-24 inhibits erythropoiesis by targeting activin type I receptor ALK4. Blood, 2008, 111(2):588−595.
