蛋白酪氨酸磷酸酶4A3(PTP4A3)促进小鼠胎肝来源红系细胞脱核
2022-07-11胡欣俊余东林韩改净
胡欣俊,余东林,范 宏,韩改净,薛 征,吕 湘
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病理生理学系 医学分子生物学国家重点实验室,北京 100005)
输血治疗仍是目前临床上不可替代的治疗手段且用血量日益增长。已有在体外液体培养基中,由造血干细胞或胚胎干细胞诱导分化形成成熟红细胞的技术,但其中干细胞体外分化效率低,分化细胞成熟度不够,红系终末分化和脱核效率低等问题都是困扰体外高效造血的限速步骤。
蛋白酪氨酸磷酸酶4A3(protein tyrosine phos-phatase type 4A member3,Ptp4a3)基因位于8号染色体长臂(8q24.3),由40 462个碱基对组成。PTP4A3蛋白共 173个氨基酸,分子质量19 535 ku,属于蛋白酪氨酸磷酸酶家族成员。PTP4A3促进小鼠胎肝来源红系细胞脱核在细胞增殖[1]、肿瘤发生和转移[2]及自噬等过程中均发挥重要作用。有报道PTP4A3促进小鼠胎肝来源红系细胞脱核可通过促进有丝分裂G1期向S期转换参与肿瘤发生发展[3]。PTP4A3促进小鼠胎肝来源红系细胞脱核在小鼠红系终末分化细胞中高表达,但其功能尚未明确。本工作初步探讨并提示PTP4A3促进小鼠胎肝来源红系细胞脱核在红系脱核中发挥重要调控功能。
1 材料与方法
1.1 材料
1.1.1 细胞: C57 孕鼠取E 13.5 胎肝,磁珠分选Ter119阴性细胞;人胚肾上皮细胞系HEK-293T(ATCC细胞库https://www.atcc.org)。
1.1.2 试剂:胎牛血清(fetal bovine serum,FBS)、细胞培养基IMDM(Iscove’s Modified Dulbecco’s Medium)、DMEM (Dulbecco’s Modified Eagle Medium)、L-谷氨酰胺(L-glutamine)、血清替代物、PFHM-Ⅱ(Gibco公司) ;β-巯基乙醇、地塞米松、胆固醇、转铁蛋白(holo-transferrin)、MTG、HEPES(Sigma-Aldrich公司);重组人胰岛素(翎圣公司);IL-3、EPO(Peprotech公司);IGF-1、SCF(Stem Cell公司);线性 PEI转染试剂p4000(北京兰博利德生物科技公司)。青霉素-链霉素抗生素、F108(Invitrogen公司);Ter119磁珠(BD公司);构建质粒所需的内切酶(NEB公司);SYBR Green PCR试剂盒、RNA提取试剂盒、反转录试剂盒(南京诺唯赞生物科技公司)。
1.2 方法
1.2.1 质粒的构建:构建shRNA干扰质粒,在Splashrna网站(http://splashrna.mskcc.org)设计shRNA,使用sh-Luc(Ctrl)作为对照组,sh-PTP4A3作为实验组。合成相应干扰序列并在两端加入KpnⅠ/XhoⅠ 酶切位点,95 ℃ 高温退火,得到的双链片段与线性化的 SFFV-GFP-mir30 载体连接,转化后挑菌提质粒,进行病毒包装。
1.2.2 病毒包装体系:A液,20 μL P4000 +500 μL 0.9%氯化钠溶液3;B液,PAX2 7.5 μg,pMD2.G 3.5 μg,干扰质粒10 μg。A液配制完成后室温静置5 min,再与B液混合,二者混匀室温静置15 min后加于HEK-293T细胞中。
1.2.3 小鼠胎肝培养体系:胎肝细胞复苏后前3 d使用增殖培养基,第4天更换分化培养基直至第7天。细胞浓度保持在约 2×106细胞/mL。
1.2.4 病毒包装:48 h后收集病毒上清于50 mL离心管中,4 ℃ 3 000×g,离心15 min去除细胞碎片,0.45 μm滤膜过滤。病毒上清于无菌离心管中,超高速离心机,4 ℃ 50 000×g,离心4 h。病毒沉淀用DMEM培养基重悬(与病毒上清体积比为1∶100)。按细胞数加入病毒重悬液及HEPES和F108感染胎肝细胞,细胞置于恒温37 ℃,5% CO2培养箱中培养,细胞为2 × 105个/mL。
1.2.5 流式细胞测量术检测:细胞离心弃上清,BSA封闭30 min后,加入标记抗鼠Ter119-PE抗体避光孵育60 min,PBS洗涤,加入hoechst避光孵育10 min。使用SONY MA900全自动流式分选仪测, 并用FlowJo V10软件分析结果。
1.2.6 RT-qPCR:收取细胞后利用RNA提取试剂盒提取细胞总RNA,使用反转录试剂盒将RNA反转录成cDNA。使用SYBR Green进行实时荧光定量,检测目标基因在mRNA水平的表达情况。
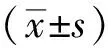
1.2.8 生物信息学分析:对分选得到的小鼠胎肝细胞进行转录组测序建库并二代测序,测序文件(fastq格式)使用cutadapt和trimmomatic软件去除接头和低质量序列,数据清洗后使用hisat2软件比对到小鼠基因组mm10得到sam文件,使用samtools压缩为bam文件后,使用featureCounts软件得到基因表达矩阵(count文件)。进一步使用deseq2包进行差异表达分析,使用pheatmap软件可视化差异表达基因。
1.2.9 引物序列:短发夹RNA(short hairpin RNA,shRNA)干扰序列及RT-qPCR引物序列见表1,2。

表1 shRNA干扰序列Table 1 Sequences for shRNA
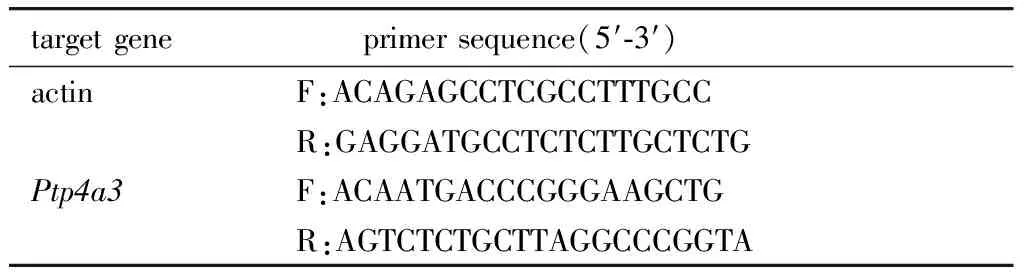
表2 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
2 结果
2.1 筛选红系终末分化的潜在调节基因
根据小鼠红系终末分化4个时期的转录组测序数据,分析在此过程中平均表达水平在前100位且表达逐渐升高的基因。发现蛋白酪氨酸磷酸酶PTP4A4在早幼红(basophilic erythroblast, Baso)、中幼红(polychromatic erythroblast, Poly)和晚幼红(orthochromatic erythroblast, Ortho)细胞中均有表达,且表达量逐步升高(图1A)。PTP4A4是为数不多的在红系分化晚期高表达的磷酸酶之一(图1B)。在小鼠胎肝体外红系分化体系中检测Ptp4a3的表达,也证实PTP4A4随红系分化表达逐渐升高(图1C)。
2.2 敲低Ptp4a3抑制红系脱核
与对照细胞相比,两条shRNA干扰序列均导致小鼠胎肝细胞中Ptp4a3mRNA表达水平显著降低(图2A)。与对照组相比,敲低Ptp4a3的表达导致胎肝来源红系细胞中Ter119+Hoechst-无核红细胞比例,即红系脱核率,显著降低(图2B)(Ctrl: 25.3%±1.9%vssh-Ptp4a3-1: 14.4%±2.5%vssh-Ptp4a3-2: 16.9%±1.4%,n=3),而没有检测到对红系分化的明显影响(图2C)。
2.3 敲低Ptp4a影响细胞周期相关基因表达
在小鼠胎肝细胞中敲低Ptp4a3并诱导其向红系分化,分选得到Ptp4a3敲低组与对照组有核红细胞(Ter119+Hoechst+)进行转录组测序,主成分分析PCA(图3A,左)和样本聚类分析(图3A,右)显示样本组内重复较好且组间具有明显的差异。进一步进行差异表达分析,共获得4 430个表达变化2倍以上的差异基因,其中上调基因1 718个,下调基因2 712个(图3B,C)。下调差异基因中包括Ptp4a3,表明其敲低成功。对差异表达基因进行KEGG富集分析(图3D), 结果显示敲低Ptp4a3后表达上调的基因富集细胞周期、PI3K-AKT信号通路、肌动蛋白细胞骨架相关通路,下调基因中未富集到已知与红系脱核相关的调控通路。
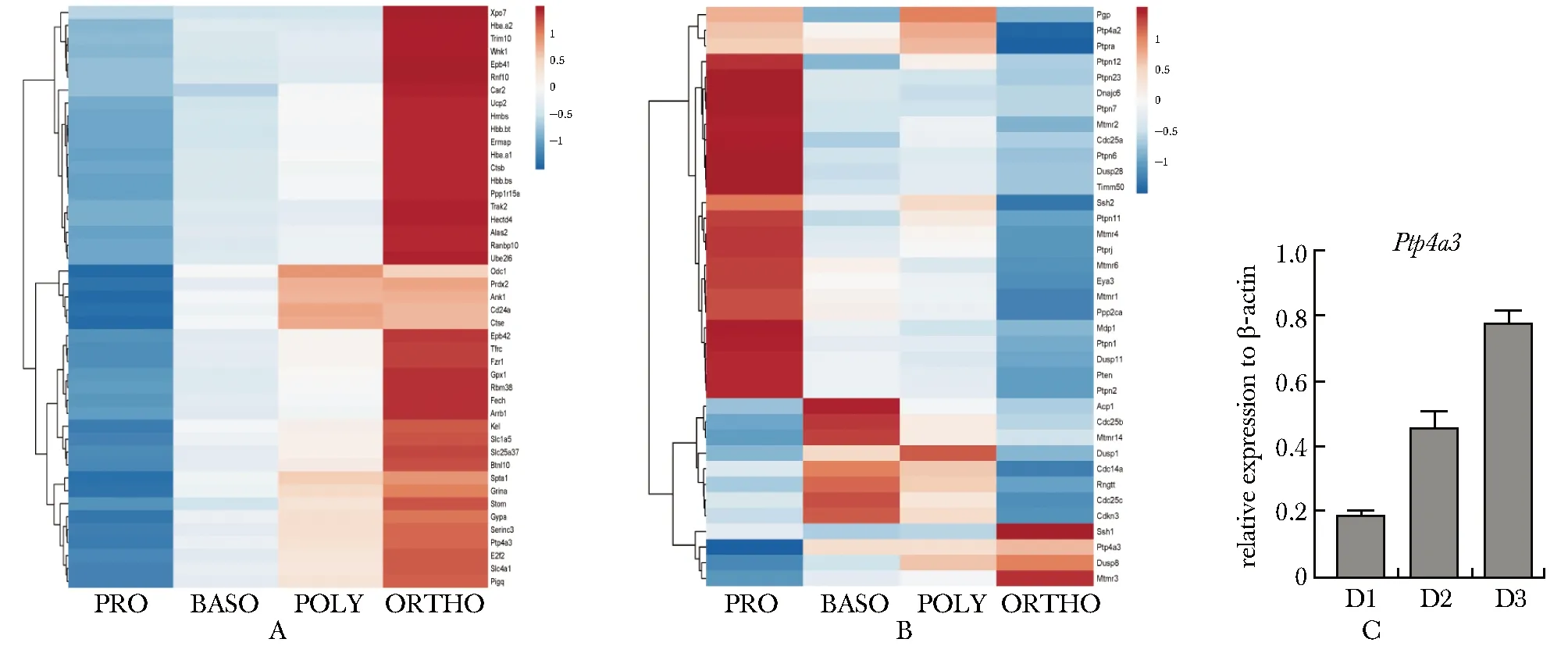
A.genes with top100 ranked and a gradually increased expression during mouse terminal erythroid differentiation were displayed by heat map;B.heat map of phosphatases expression during mouse terminal erythroid differentiation;C.RT-qPCR indicated the gradually increased Ptp4a3 expression during in vitro erythroid differentiation of mouse fetal liver
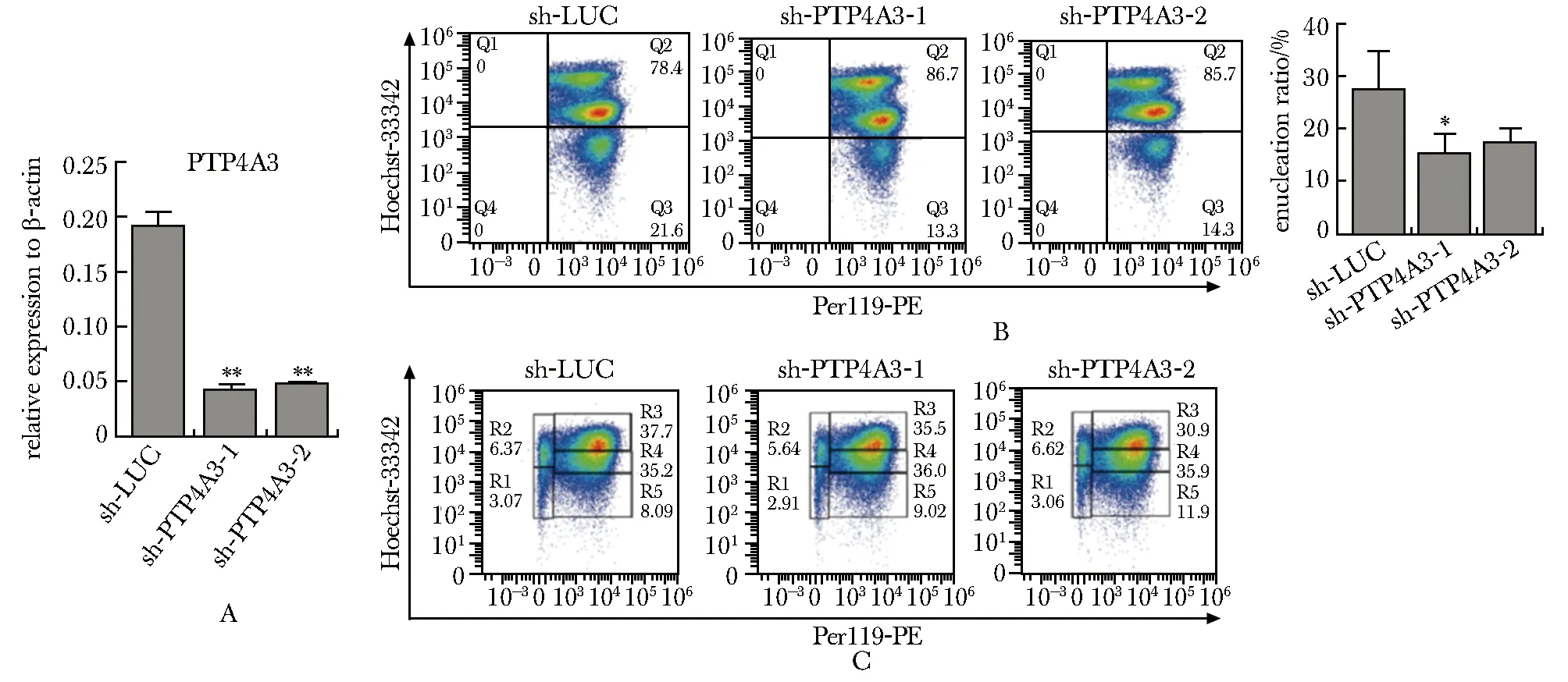
A.RT-qPCR indicated that Ptp4a3 was successfully knocked down in mouse fetal liver-derived erythroid cells, *P<0.001 compared with sh-LUC; B.flow cytometry analysis showed that knockdown of Ptp4a3 expression resulted in significant decrease in the ratio of erythroid enucleation,*P<0.05 compared with sh-LUC; C.knockdown Ptp4a3 did not affect erythroid differentiation
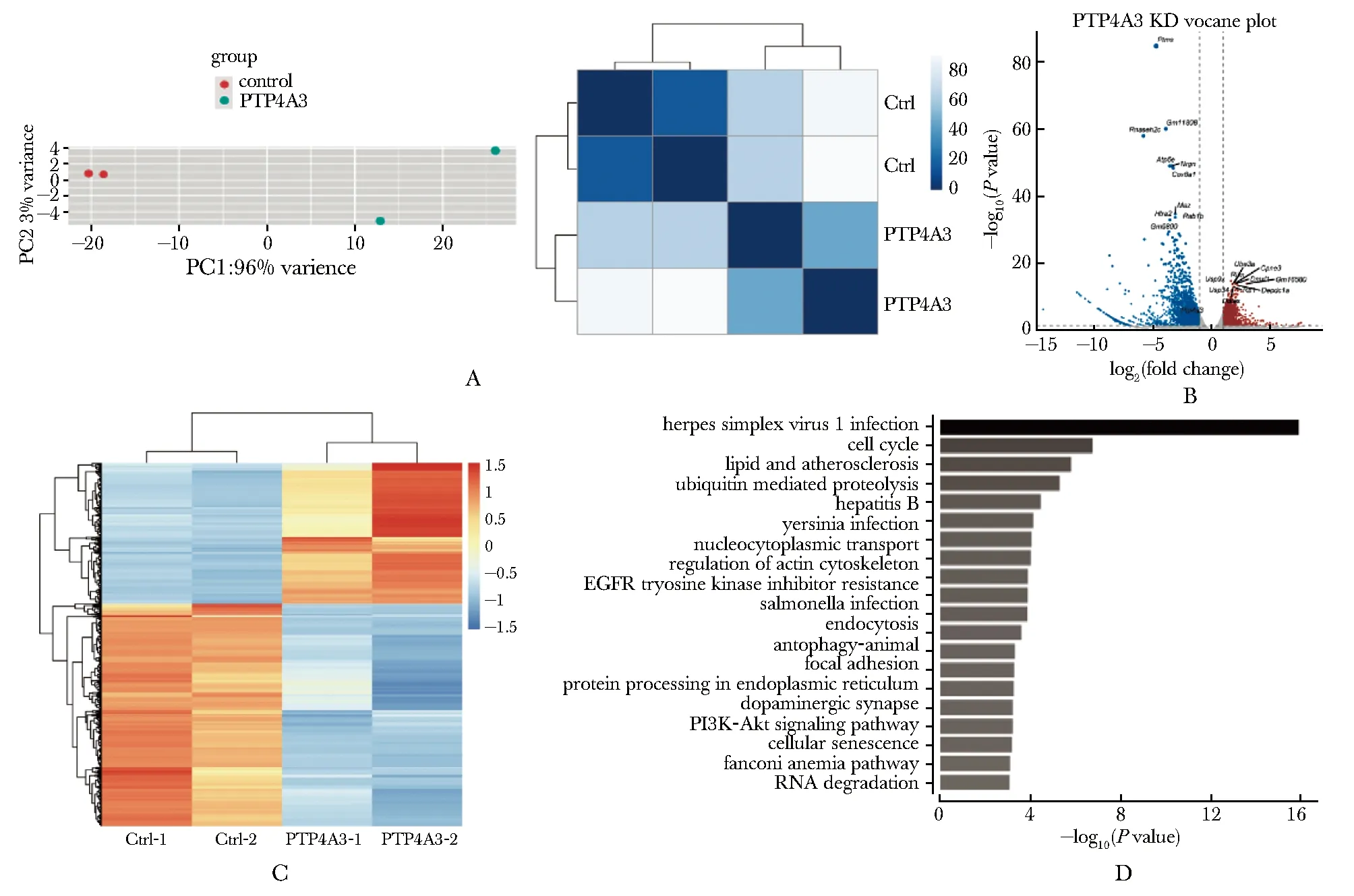
A.PCA plot and sample distance matrix plot;B.volcano plot of differential expression genes from Ptp4a3 knockdown fetal liver-derived erythroid cells compared to Ctrl cells;C.heatmap of all differentially expressed genes, the color indicated the scaled expression level;D.KEGG enrichment analysis of upregulated genes
3 讨论
本研究首先利用实验室前期工作中小鼠红系终末分化4个时期细胞转录组测序数据,筛选在红系终末分化中可能发挥功能的基因。分析结果显示在红系分化晚期高表达的基因包括HBb、Alas2、Rbm38和Ptp4a3等。其中β-珠蛋白作为血红蛋白亚基,在红系终末分化晚期大量积累是红系分化晚期特征基因[4],Alas2是成红细胞中负责血红素合成的关键基因,其突变与 X 连锁铁粒幼细胞性贫血有关[5],此外Rbm38是红系生成中可变剪接的关键调节因子[6-7]。本工作聚焦研究同样在红系终末分化晚期高表达的PTP4A3在红系终末分化及脱核中的功能。通过慢病毒感染敲低Ptp4a3会导致小鼠胎肝细胞来源红系细胞脱核率显著降低。RNA表达谱分析提示,Ptp4a3可能通过影响细胞周期相关基因或PI3K-AKT通路参与调节红系细胞脱核。已有研究发现PI3K-AKT 通路在红系细胞脱核过程中通过重新定位细胞核促进细胞极化及脱核[8]。
红系分化与成熟对生命体至关重要,已有研究表明细胞骨架重塑、细胞周期调控及细胞分裂[9]、组蛋白释放[10]等生物学过程与脱核密切相关。但蛋白磷酸酶在红系脱核中的功能尚不清楚。 PTP4A3属于蛋白酪氨酸磷酸酶家族,包含一个酪氨酸磷酸化结构域,并具有双重磷酸酶活性,可对蛋白质酪氨酸、苏氨酸及丝氨酸位点去磷酸化,实现促进细胞增殖、血管生成和促进有丝分裂过程中G1期向S期的转换等功能。研究表明细胞周期改变在红系分化多个阶段发挥重要调控作用,在红系分化早期通过促进细胞从G1向S期转变促进细胞增殖,而细胞周期的退出在红系终末分化中起重要作用[11-12]。表明PTP4A3参与调控红系细胞脱核,但是否通过其磷酸酶功能发挥作用以及具体的分子机制仍需更深入研究。
