利用毕赤酵母系统直接分泌表达具有活性的谷氨酰胺转胺酶
2013-09-03李鹏飞孙红兵游丽金巩伏雨陈藻张爱联朱泰承
李鹏飞,孙红兵,游丽金,巩伏雨,陈藻,张爱联,朱泰承
1 海南大学农学院,海南 海口 5702282 中国热带农业科学院热带生物技术研究所 农业部热带作物生物技术重点开放实验室,海南 海口 5711013 中国科学院微生物研究所,北京 1001014 厦门大学化学化工学院,福建 厦门 361005
利用毕赤酵母系统直接分泌表达具有活性的谷氨酰胺转胺酶
李鹏飞1,孙红兵3,游丽金3,巩伏雨3,陈藻4,张爱联2,朱泰承3
1 海南大学农学院,海南 海口 570228
2 中国热带农业科学院热带生物技术研究所 农业部热带作物生物技术重点开放实验室,海南 海口 571101
3 中国科学院微生物研究所,北京 100101
4 厦门大学化学化工学院,福建 厦门 361005
李鹏飞, 孙红兵, 游丽金, 等. 利用毕赤酵母系统直接分泌表达具有活性的谷氨酰胺转胺酶. 生物工程学报, 2013,29(2): 180−188.
Li PF, Sun HB, You LJ, et al. Direct secretory expression of active microbial transglutaminase inPichia pastoris. Chin J Biotech, 2013, 29(2): 180−188.
使用异源表达系统直接分泌表达具有活性的微生物谷氨酰胺转氨酶 (Microbial transglutaminase,MTG) 是目前最具前景的MTG生产方法之一,但由于产量较低无法实现工业化生产。毕赤酵母是近年来发展出的高效蛋白表达系统。通过采用pro序列与成熟MTG基因共表达的策略,成功地实现了用重组毕赤酵母分泌表达具有活性的茂原链霉菌Streptomyces mobaraenseMTG。进一步通过对pro序列和MTG基因拷贝数以及重组酵母培养条件的优化,最终使得MTG在1 L发酵罐中高密度发酵的酶活达到7.3 U/mL,为MTG的工业化生产奠定了基础。
谷氨酰胺转胺酶,毕赤酵母,拷贝数,共表达,高密度发酵,酶原序列
谷氨酰胺转胺酶 (Transglutaminase,又称转谷氨酰胺酶,EC 2.3.2.13,TGase或TG) 能够催化蛋白质肽链中谷氨酰胺残基的 γ-羧酰胺基与各种酰基受体发生酰胺基转移反应,是一种有效的蛋白质交联剂[1-2]。TG广泛存在于人体、动物、植物和微生物中,特别是微生物来源的 TG(Microbial transglutaminase,MTG),在无 Ca2+的条件下依然可以表现出催化活性,被广泛用于食品工业以改善蛋白质的功能性质、提高营养价值[1]。近些年,MTG在化妆品行业、纺织业、皮革业及生物材料领域也表现出良好的应用前景[1,3]。
MTG在工业上是通过微生物发酵法制备,生产菌株最初是从土壤中筛选到的链霉菌,如茂原链霉菌Streptomyces mobaraense[4]、吸水链霉菌Streptomyces hygroscopicus[5]等。链霉菌MTG是一种胞外酶,以无活性的酶原 (pro-MTG) 形式分泌,pro-MTG被胞外蛋白酶SAM-P45切除N-端酶原区 (pro序列) 后,转化成成熟的具有活性的MTG[6]。近些年,用重组表达系统来生产MTG成为研究的主要方向,最为成功的系统有大肠杆菌[7-9]、棒杆菌[10-11]和甲基营养型酵母[12]。迄今为止,直接克隆表达成熟MTG编码区的策略均未获得成功[2]。因此,目前 MTG的表达策略主要分为两类,第一类是以酶原形式表达 (或无活性表达),在体外用SAM-P45蛋白酶去除pro序列获得活性 MTG[13-14]。虽然以酶原形式表达目前可以积累高达2.5 g/L的酶原蛋白[13],但体外蛋白酶的处理步骤无疑提高了生产成本和操作的复杂度。第二类是以成熟MTG形式表达 (或活性表达)。早期的工作是将pro-MTG与SAM-P45蛋白酶在异源宿主中共同分泌表达[15-16],但该策略表达水平很低,且蛋白酶的后续去除也会提高分离纯化的成本。2004年,Yurimoto等首先采用了将MTG酶原的pro序列和成熟MTG编码区作为两个独立的元件进行共表达的策略,成功地实现了用甲基营养型酵母C. boidinii分泌表达活性MTG[12],产量达到1.83 U/mL。采用此策略,Liu等也在大肠杆菌中获得了MTG的活性表达[17],产量达到0.13 U/(mL·OD600)。但目前报道的共表达策略酶活水平仍然较低,离工业化应用还有较大的差距。
甲基营养型酵母毕赤酵母Pichia pastoris是近20年发展起来的一种高效异源蛋白表达系统,它的许多优良特点[18-19]使其成为蛋白分泌表达的首选系统之一。本研究通过使用重组毕赤酵母菌株表达MTG并对重组菌株发酵条件进行优化,使得MTG在1 L发酵罐中的产量达到7.3 U/mL,初步证明了利用毕赤酵母直接分泌表达具有活性的MTG的可行性。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌E. coliDH5α、Pichia pastorisGS115以及质粒pAOα[20]均为本实验室保存。
1.1.2 酶、试剂、引物和DNA序列测定
所有核酸限制性内切酶购自 NEB公司。DNA 连接酶 (SolutionⅠ)、DNA Marker、TaqDNA聚合酶以及蛋白Marker购自TaKaRa公司。质粒提取试剂盒、小片段DNA回收试剂盒以及琼脂糖凝胶 DNA回收试剂盒购自 OMEGA公司。引物合成和DNA测序由北京擎科生物有限公司完成。
1.1.3 培养基
大肠杆菌培养用LB和LLB培养基,毕赤酵母菌培养用的培养基 YPD、MD、BMGY、BMMY、BSM配方见Invitrogen公司提供的操作手册[21]。
1.2 方法
1.2.1 成熟谷氨酰胺转胺酶 (MTG) 基因和pro序列基因的克隆
根据 GenBank提供的 pro-MTG基因序列(GenBank Accession No. AY502065.1),分别设计成熟 MTG基因的扩增引物 mtgF (引入XhoⅠ)和mtgR (引入EcoRⅠ),以及pro序列的扩增引物proF (引入XhoⅠ) 和proR (引入EcoRⅠ)。
以茂原链霉菌菌株基因组为模板,PCR扩增MTG基因。PCR条件为:95 ℃预变性5 min;94 30 s℃,55 30 s℃,72 ℃ 80 s,30个循环;72 ℃延伸10 min。PCR产物纯化后与pMD19-T simple载体连接,转化至E. coliDH5α感受态细胞,提取阳性转化子的质粒,经XhoⅠ和EcoRⅠ双酶切,胶回收后得到MTG片段。利用同样的方法得到pro片段,PCR条件中延伸时间为20 s。
1.2.2 pro/MTG共表达载体pAOα-pro-MTG的构建
将分泌型表达载体 pAOα利用XhoⅠ和EcoRⅠ双酶切后,通过胶回收得到线性化质粒载体,然后与得到的MTG片段通过DNA连接酶SolutionⅠ连接后转化大肠杆菌 DH5α,获得MTG基因单拷贝诱导表达载体pAOα-MTG。利用同样的方法获得载体 pAOα-pro。将得到的载体 pAOα-pro利用BamHⅠ线性化后,通过胶回收得到线性化质粒载体;同时将构建的载体pAOα-MTG利用BamHⅠ和BglⅡ双酶切,胶回收MTG基因表达盒;将线性化质粒载体与MTG基因表达盒通过 SolutionⅠ连接酶连接后转化大肠杆菌DH5α,获得pro/MTG共表达载体pAOαpro-MTG。
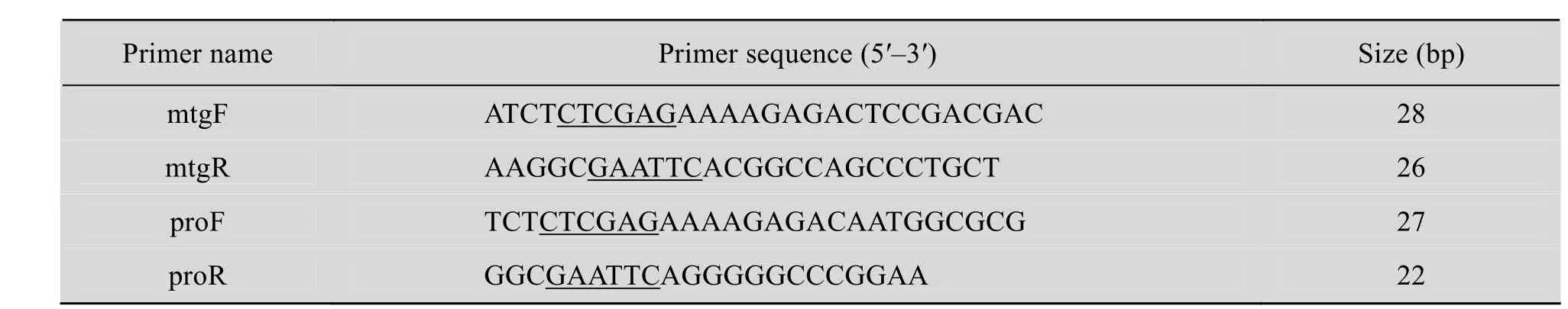
表1 引物列表Table 1 List of primers
1.2.3 多拷贝pro/MTG共表达载体的构建
将得到的载体pAOα-pro-MTG利用BamHⅠ线性化后,通过胶回收得到线性化质粒载体;同时将pAOα-pro-MTG利用BamHⅠ和BglⅡ双酶切,胶回收 pro/MTG基因表达盒;将该表达盒与线性化质粒载体通过 SolutionⅠ连接酶连接后转化大肠杆菌DH5α,获得2拷贝pro/MTG共表达载体pAOα-2pro-2MTG。同样的策略,得到3拷贝pro/MTG共表达载体pAOα-3pro-3MTG。
1.2.4 酵母的电转化及重组子的筛选
将构建的表达载体pAOα-pro-MTG、pAOα-2pro-2MTG、pAOα-3pro-3MTG分别通过限制性内切酶StuⅠ单酶切后,胶回收得到线性化质粒,电转化毕赤酵母GS115感受态细胞。具体操作参照Invitrogen公司提供的操作手册[21]。将得到的重组子通过PCR鉴定,从而得到含有MTG基因的重组毕赤酵母表达菌株。
1.2.5 重组菌株的摇瓶表达及MTG酶活测定
将得到的重组菌株利用BMGY培养基活化,然后以相同的接种量转移菌体到BMMY中进行诱导表达,摇瓶发酵表达MTG的方法按照Invitrogen公司提供的操作手册。摇瓶培养条件为30 ℃、200 r/min,每12 h添加8‰甲醇,共诱导96 h。得到的发酵上清液用于酶活测定。MTG酶活的定义为:37 ℃时 MTG每分钟催化底物(N-CBZ-Gln-Gly, Sigma公司) 生成 1 mmol/mL谷氨酸-单羟胺酸 (氧肟酸) 为 1个酶活单位。MTG酶活的测定方法按照参考文献[21]进行。
1.2.6 重组菌株GS2MTG摇瓶发酵培养基优化
从 pH和培养基两方面优化 GS2MTG表达MTG的发酵条件。pH优化方面,将 GS2MTG在YPD中培养24 h,收集菌体并分别接种至不同pH的BMMY培养基中,将pH调至4.0、5.0、6.0、7.0和8.0,诱导培养96 h后,取样测定OD600和酶活。培养基优化方面,将GS2MTG在YPD中培养24 h,收集菌体并分别接种至BMMY、BSM和12%麦芽汁培养基 (麦芽汁12 g,加蒸馏水溶解定容至100 mL),诱导培养96 h后,取样测定OD600和酶活。
1.2.7 1 L发酵罐高密度培养
高密度发酵在1 L发酵罐中进行,将经过摇瓶活化的重组子菌液作为种子液接种于 700 mL发酵培养基中,将发酵的参数设定为pH 6.0,搅拌转速100~750 r/min,通气量1 L/min 和温度30 ℃。发酵约24 h后,当溶氧值升高并维持较高水平时,开始采用流加策略补加50%甘油,维持溶氧值在 10%左右。待发酵液OD600值达到250~300时停止补料,开始补加100%甲醇诱导,根据溶氧水平控制补料速率,整个发酵过程中控制溶氧水平为5%~10%。发酵过程中每24 h取样测定OD600和酶活。
2 结果与分析
2.1 基因克隆和载体构建
以茂原链霉菌菌株基因组为模板,利用引物mtgF和mtgR,proF和proR通过PCR得到MTG成熟肽基因和 pro基因,PCR产物大小分别为1 021 bp和 160 bp,电泳结果显示与预期相符(结果未显示)。PCR产物分别连接T载体转化大肠杆菌DH5α感受态细胞,提质粒后测序,确认MTG基因和pro基因序列与公布序列完全一致。按方法1.2.2所述,构建获得pro/MTG共表达载体pAOα-pro-MTG (图1),作为基本的表达单元。为考察拷贝数对MTG产量的影响,进一步按方法1.2.2所述,分别构建得到2拷贝、3拷贝表达载体,分别命名为 pAOα-2pro-2MTG、pAOα-3pro-3MTG,并通过BamHⅠ和BglⅡ双酶切验证,切出片段大小与理论值完全相符 (结果未显示)。
2.2 重组毕赤酵母菌株的构建和pro/MTG拷贝数的优化

图1 共表达载体pAOα-pro-MTG质粒图Fig. 1 Plasmid map of co-expression vector pAOαpro-MTG
将得到的质粒载体pAOα-pro-MTG、pAOα-2pro-2MTG、pAOα-3pro-3MTG 分别利用StuⅠ在HIS基因处线性化,通过双交换整合到毕赤酵母基因组中。双交换会使毕赤酵母从组氨酸营养缺陷型菌株转变为非缺陷型菌株,从而使重组菌株可以在缺乏组氨酸的MD平板上生长。每个平板挑取3~5个单菌落,利用YPD培养基培养后提取基因组,通过PCR证明MTG基因已经整合到毕赤酵母基因组中,通过定量 PCR验证所整合的MTG基因拷贝数与预想值一致 (结果未显示),得到的 1~3拷贝的重组酵母菌株分别命名为GS1MTG、GS2MTG和GS3MTG。
将以上3株菌株分别接种BMMY进行摇瓶发酵,以GS115作为对照。摇瓶诱导发酵96 h后测酶活,结果如图2所示。GS1MTG、GS2MTG和 GS3MTG均实现了活性表达,它们的酶活分别达到0.18、0.25和0.22 U/mL,其中以2拷贝菌株GS2MTG产量最高,因此选取GS2MTG作为后续研究。
2.3 发酵培养条件的优化
首先考察了不同 pH值对毕赤酵母生长及MTG生产水平的影响。将GS2MTG菌株分别在pH 4.0、5.0、6.0、7.0和8.0的BMMY中诱导培养96 h,发酵结束后检测菌体的光密度值和MTG酶活。由图3可以看出,pH值的变化对于菌体生长的影响并不显著,但对MTG产量的影响显著。在pH值为6.0和7.0时,产酶量最高。特别是当pH偏酸时会显著降低MTG的酶活产量。
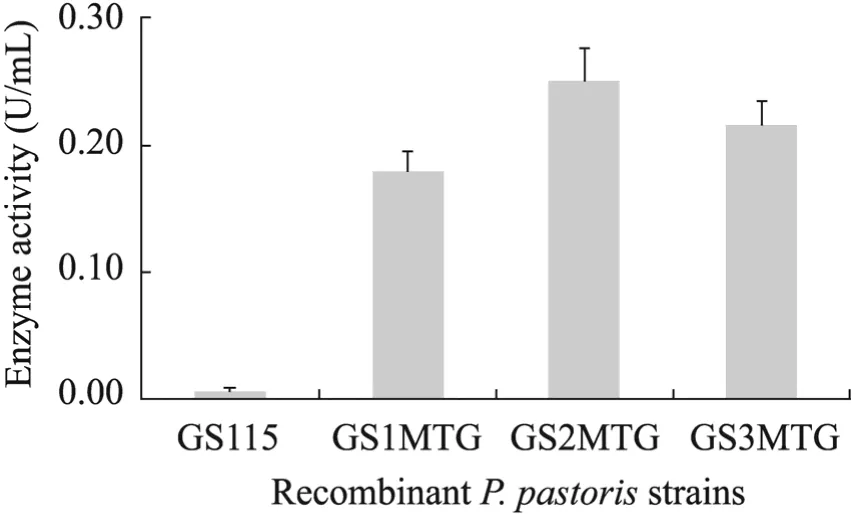
图 2 各重组毕赤酵母菌株表达 MTG酶活的比较(GS115为阴性对照,GS1MTG、GS2MTG和GS3MTG分别为含有pro/mtg共表达盒1拷贝、2拷贝和3拷贝重组菌株)Fig. 2 MTG activities of constructed recombinant Pichia pastoris strains. GS115 is utilized as negative control, GS1MTG, GS2MTG and GS3MTG are recombinant strains that contain one copy, two copies and three copies of pro/mtg co-expression cassettes.

图3 不同pH对GS2MTG生长和产酶的影响Fig. 3 Effect of different pH on GS2MTG growth and enzyme production.
由于BMMY培养基成本较高,考察了替代培养基:盐培养基 (BSM) 和麦芽汁培养基对于菌株生长和产酶的影响。由图4可以看出,在诱导培养96 h后,BSM培养基和麦芽汁培养基的细胞量分别比BMMY培养基低39%和8%。从MTG产量方面,麦芽汁培养基中的MTG活性为BMMY培养基的78%,而BSM培养基中仅能检测到微量的酶活。
2.4 重组毕赤酵母GS2MTG在1 L发酵罐中MTG的产量评估
为评估毕赤酵母菌株分泌表达活性MTG的潜力,综合以上研究结果,将 GS2MTG菌株在pH 6.0的条件下,以BMGY和BMMY为培养基诱导发酵,发酵结果见图5。整个诱导过程持续120 h,酶活最终达到7.3 U/mL。
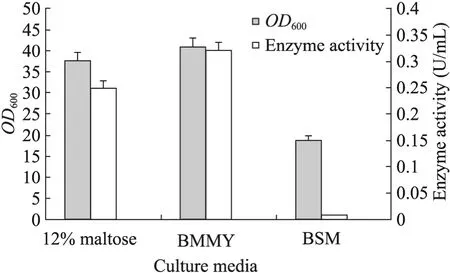
图4 不同培养基对GS2MTG生长和产酶影响Fig. 4 Effects of alternative media on GS2MTG growth and enzyme production.
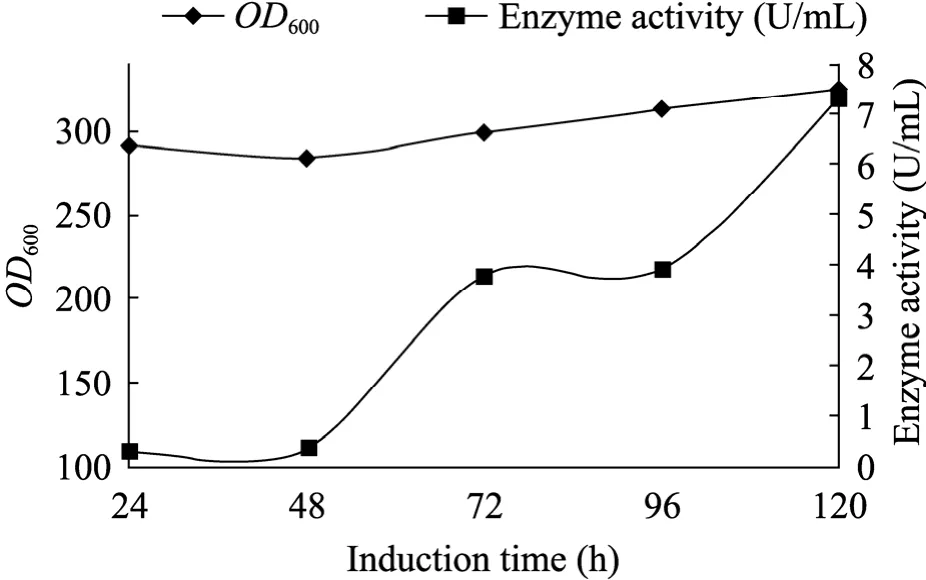
图5 不同诱导时间GS2MTG的生长和产酶情况Fig. 5 Growth and enzyme production of GS2MTG at different induction time.
3 讨论
Yurimoto等首先采用了MTG的pro序列和MTG成熟编码区共表达的策略,实现了在甲基营养型酵母C. Boidinii中分泌表达具有活性的MTG[12]。鉴于毕赤酵母在蛋白表达上的成功应用,本研究将此共表达策略应用于毕赤酵母中,成功地实现了MTG的活性分泌表达。本研究还对 pro/MTG的拷贝数进行了优化,结果表明 2拷贝的pro/MTG菌株GS2MTG,比单拷贝菌株的产量提高了约40%。但是进一步提高拷贝数没有提高MTG的表达量,反而使其有所下降。前人研究表明,增加外源基因拷贝数可以有效提高其蛋白分泌表达量,但过高的拷贝数有可能会对蛋白的表达乃至酵母宿主的生长产生负影响[22-23]。本研究结果表明,对于毕赤酵母分泌表达MTG,2拷贝的pro/MTG是最优结果。此时基因剂量已经不再是MTG分泌表达的主要限制性因素,而蛋白表达的其他环节如蛋白翻译、分泌等,可能会成为影响MTG产量的主要瓶颈。
从培养条件的初步优化实验可以看出,pH值对于MTG的酶活有显著影响,pH值低于6.0和高于 7.0都会使酶活降低,特别是在低于 6.0时,酶活下降显著,这意味着在MTG发酵培养中对于pH值的控制是十分重要的。蛋白电泳结果表明在低pH的情况下MTG蛋白表达量显著降低 (结果未显示),这说明 pH是在蛋白质表达水平影响MTG产量的。pH对MTG表达的影响可能跟MTG的降解过程有关,合适的pH可抑制酵母蛋白酶活力从而抑制其对外源蛋白的降解[24]。
从培养基优化结果来看,12%的麦芽汁培养基与BMMY培养基相比,无论是细胞量还是最终MTG产量,都只比BMMY培养基略低,一定程度上可以代替BMMY培养基。而用廉价的BSM 培养基替代 BMMY培养基的实验并不成功,不但菌株生长明显减缓,更重要的是在BSM培养基中仅能检测到微弱的MTG活性,蛋白电泳的结果也显示MTG的条带很微弱 (结果未显示)。这是因为在外源蛋白表达过程中,宿主细胞为外源蛋白提供前体和能量,其良好的生长状态是实现外源蛋白高效表达的必要条件[25]。BMMY和12%的麦芽汁培养基与BSM培养基相比,含丰富的有机氮源,酵母菌在此两种富营养培养基中生长更加迅速,前体和能量供给更加充沛,因此MTG的表达量更高。另外,有机氮源如酵母提取物、蛋白胨可以作为蛋白酶的底物,从而减少对目的蛋白的降解[26]。
最后,用最优的菌株 GS2MTG在优化后的培养条件下进行了高密度发酵,经诱导120 h,MTG产量达到7.3 U/mL,比摇瓶产量提高了近30倍,这也表明了发酵过程中严格控制的pH值、良好的溶氧环境,对于MTG的产量提高是至关重要的。该产量也是迄今为止,采用活性表达策略的报道中最高的。研究同时也表明了毕赤酵母作为MTG生产菌株的良好应用前景。
[1]Yokoyama K, Nio N, Kikuchi Y. Properties and applications of microbial transglutaminase. Appl Microbiol Biotechnol, 2004, 64(4): 447−454.
[2]Liu S, Zhang DX, Du GC, et al. Progress in expression and molecular modification of microbial transglutaminase. Chin J Biotech, 2011, 12(27):1681−1689 (in Chinese).
刘松, 张东旭, 堵国成, 等. 微生物谷氨酰胺转胺酶的表达及分子改造研究进展. 生物工程学报, 2011, 12(27): 1681−1689.
[3]Zhu Y, Tramper J. Novel applications for microbial transglutaminase beyond food processing. Trends Biotechnol, 2008, 26(10): 559−565.
[4]Ando H, Adachi M, Umeda K, et al. Purification and characteristics of a novel transglutaminase derived from microorganisms. Trends Biotechnol,1989, 10(53): 2613−2617.
[5]Cui L, Du G, Zhang D, et al. Thermal stability and conformational changes of transglutaminase from a newly isolatedStreptomyces hygroscopicus.Bioresour Technol, 2008, 99(9): 3794−3800.
[6]Pasternack R, Dorsch S, Otterbach JT, et al.Bacterial pro-transglutaminase fromStreptoverticillium mobaraensepruification,characterisation and sequence of the zymogen. Eur J Biochem, 1988, 257(3): 570−576.
[7]Zhao X, Shaw AC, Wang J, et al. A novel high-throughput screening method for microbial transglutaminase with high specificity toward Gln141 of human growth hormone. J Biomol Screen, 2010, 15(2): 206−212.
[8]Liu XQ, Yang XQ, Xie FH, et al. On-column refolding and puriwcation of transglutaminase fromStreptomyces fradiaeexpressed as inclusion bodies inEscherichia coli. Protein Expr Purif, 2007,51(2): 179−186.
[9]Yang H, Pan L, Lin Y. Purification and on-column activation of a recombinant histidine-tagged pro-transglutaminase after soluble expression inEscherichia coli. Biosci Biotechnol Biochem, 2009,73(11): 2531−2534.
[10]Masayo D, Kei-Ichi Y, Yukiko U, et al. High level expression ofStreptomyces mobaraensistransglutaminase inCorynebacterium glutamicumusing achimeric pro-region fromStreptomyces cinnamoneustransglutaminase. J Biotechnol, 2004,3(110): 219−226.
[11]Date M, Yokoyama K, Umezawa Y, et al.Production of native-typeStreptoverticilliummobaraensetransglutaminase inCorynebacterium glutamicum. Appl Environ Microbiol, 2003, 69(5):3011−3014.
[12]Yurimoto H, Yamane M, Kikuchi Y, et al. The pro-peptide ofStreptomyces mobaraensistransglutaminase functions in cis and in trans to mediate efficient secretion of active enzyme from methylotrophic yeasts. Biosci Biotechnol Biochem,2004, 68(10): 2058−2069.
[13]Itaya H, Kikuchi Y. Secretion ofStreptomyces mobaraensispro-transglutaminase by coryneform bacteria. Appl Microbiol Biotechnol, 2008, 78(4):621−625.
[14]Sommer C, Volk N, Pietzsch M. Model based optimization of the fed-batch production of a highly active transglutaminase variant inEscherichia coli.Protein Expr Purif, 2011, 77(1): 9−19.
[15]Zhao X, Shaw AC, Wang JH, et al. A novel high-throughput screening method for microbial transglutaminases with high specificity toward Gln141 of human growth hormone. J Biomol Screen, 2010, 15(2): 206−212.
[16]Kikuchi Y, Date M, Yokoyama K, et al. Secretion of active-formStreptoverticillium mobaraensetransglutaminase byCorynebacterium glutamicum:processing of the pro-transglutaminase by a cosecreted subtilisin-like protease fromStreptomyces albogriseolus. Appl Environ Microbiol, 2003, 69(1): 358−266.
[17]Liu S, Zhang DX, Wang M, et al. The order of expression is a key factor in the production of active transglutaminase inEscherichia coliby co-expression with its pro-peptide. Microb Cell Fact, 2011, 23(10): 112.
[18]Cereghino J L, Cregg J M. Heterologous protein expression in the methylotrophic yeastPichia pastoris. FEMS Microbiol Rev, 2000, 1(24):45−46.
[19]Cregg J M, Cereghino J L, Shi J, et al.Recombinant protein expression inPichia pastoris.Mol Biotechnol, 2000, 1(16): 23−52.
[20]Zhu TC, You LJ, Gong FY, et al. Combinatorial strategy of sorbitol feeding and low-temperature induction leads to high-level production of alkaline-mannanase inPichia pastoris. Enzyme Microb Tech, 2011, 49(4): 407−412.
[21]Bao YL, Pan L. Research progress of mechanism and activity assay of microbial transglutaminase .Sci Technol Food Ind, 2008, 29(7): 265−268 (in Chinese).
包莹玲, 潘力. 微生物谷氨酰胺转胺酶作用机制及检测方法研究进展. 食品工业科技, 2008,29(7): 265−268.
[22]Zhu T, Guo M, Tang Z, et al. Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeastPichia pastoris. J Appl Microbiol, 2009, 107:954−963.
[23]Guo MJ, Zhu TC, Zhang M, et al. Influences of methanol utilization phenotype and gene dosage on heterologous protein expression in recombinantPichia pastoris. China Biotechnol, 2007, 27(7):7−11 (in Chinese).
郭美锦, 朱泰承, 张明, 等. 重组毕赤酵母甲醇利用表型与基因拷贝数对外源基因表达的影响.中国生物工程杂志, 2007, 27(7): 7−11.
[24]Lin JH. High density fermentation control ofPichia pastoris. China Biotechnol, 2009, 29(5): 120−125(in Chinese).
林俊涵. 毕赤酵母高密度发酵工艺的研究. 中国生物工程杂志, 2009, 29(5): 120−125.
[25]Cos Q, Ramon R, Montesinos JL, et al. Operational strategies, monitoring and control of heterologous protein production in the methylotrophic yeastPichia pastorisunder different promoters: a review.Microb Cell Fact, 2006, 5: 17.
[26]Sinha J, Plants BA, Inan M, et al. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeastPichia pastoris: case study with recombinant ovine interferon-tau. Biotechnol Bioeng, 2005, 89:102−112.
August 6, 2012; Accepted: December 11, 2012
Taicheng Zhu. Tel:+86-10-64807351; E-mail: zhutc@im.ac.cn
国家自然科学基金 (No. 31000026),中国科学院“知识创新”工程重要方向项目 (No. KSCX2-EW-G-15-03) 资助。
Direct secretory expression of active microbial transglutaminase inPichia pastoris
Pengfei Li1, Hongbing Sun3, Lijin You3, Fuyu Gong3, Zao Chen4, Ailian Zhang2,and Taicheng Zhu3
1College of Life Science and Agriculture,Hainan University,Haikou570228,Hainan,China
2Key Laboratory of Tropical Crop Biotechnology,Ministry of Agriculture,Institute of Tropical Bioscience and Biotechnology,Chinese Academy of Tropical Agricultural Sciences,Haikou571101,Hainan,China
3Institute of Microbiology,China Academy of Sciences,Beijing100101,China
4College of Chemistry and Chemical Engineering,Xiamen University,Xiamen361005,Fujian,China
Direct secretory expression of active microbial transglutaminase (MTG) using heterologous hosts is a promising strategy, although its production level still needs to be improved for industrial production.Pichia pastorisis one of the most efficient expression systems developed in recent years. In this study, secretory expression of active MTG was successfully achieved by co-expressing the pro sequence and mature MTG genes inP. pastoris. Furthermore, we optimized the copy number of pro/MTG expression cassettes and the fermentation conditions. MTG production level reached 7.3 U/mL in 1-liter fermentor through high density fermentation, providing the feasiblity for industrial scale preparation of MTG.
microbial transglutaminase,Pichia pastoris, copy number, co-expression, high density fermentation, pro sequence
Supported by: National Natural Science Foundation of China (No. 31000026), Knowledge Innovation Program of the Chinese Academy of Sciences (No. KSCX2-EW-G-15-03).
Ailian Zhang. Tel: +86-898-66989251; E-mail: zhangailian6@yahoo.com.cn
(本文责编 郝丽芳)
