生物电化学系统还原降解氯霉素
2013-09-03孙飞王爱杰严群张光生
孙飞,王爱杰,严群,张光生
1 江南大学环境与土木工程学院,江苏 无锡 2141222 哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090
生物电化学系统还原降解氯霉素
孙飞1,王爱杰2,严群1,张光生1
1 江南大学环境与土木工程学院,江苏 无锡 214122
2 哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090
孙飞, 王爱杰, 严群, 等. 生物电化学系统还原降解氯霉素. 生物工程学报, 2013, 29(2): 161−168.
Sun F, Wang AJ, Yan Q, et al. Reductive degradation of antibiotic chloramphenicol in bioelectrochemical system. Chin J Biotech, 2013, 29(2): 161−168.
为了探讨低温 (12±2 ℃) 条件下还原降解硝基芳香类抗生素氯霉素,采用序批式生物电化学系统(Bioelectrochemical system,BES) 阴极还原的方式 (外加0.5 V电压),主要研究氯霉素在BES生物阴极与非生物阴极中的不同降解速率、代谢途径和氯霉素在电化学系统中被还原为胺类产物从而脱除细菌抗性。实验数据表明,BES反应器整体的欧姆内阻随着磷酸盐缓冲液浓度的增加而减小;当葡萄糖和污泥发酵液分别存在时,生物阴极24 h的氯霉素还原效率分别为 (86.3±1.69)%和 (74.1±1.44)%,而相同条件下的非生物阴极24 h氯霉素还原效率仅为 (57.9±1.94)%。研究结果表明,生物电化学系统还原降解氯霉素使其失去生物抗性是可行的,并且在低温地区含氯霉素废水的处理过程中,生物阴极是极具潜力的一项处理工艺。
生物电化学系统,生物阴极,氯霉素,欧姆内阻,低温
抗生素是一类环境新型污染物,在传统废水处理过程中很难被有效去除。污水处理厂未能去除的抗生素在环境中富集,将会导致含有抗生素耐药基因的多种微生物的进化,从而影响人类健康[1-2]。氯霉素 (Chloramphenicol,CAP),作为一种硝基芳香类广谱抗生素,在20世纪50年代被广泛应用于治疗人类和家禽的多种疾病。如今,在包括中国在内的许多发展中国家,CAP在污水处理厂的出水、地表水和地下水中频繁地被检测出来,检出浓度为0~1 050 ng/L不等[3],高浓度氯霉素制药废水检测浓度为150~300 mg/L[4]。因此,去除废水中残留的氯霉素微生物抗性,进而消除因抗性基因和抗性微生物进化引起的危机,是必要而紧迫的。
为了提高氯霉素去除效率,多种物理化学方法被用于含氯霉素废水的处理,如光催化降解法[5]、Fenton法[6]、微波辐射法[7]、竹炭吸附法[8]等。然而,这些方法都存在着能源浪费或造成二次污染的缺点。因此,探索新型高效的氯霉素去除方法非常重要。与上文提及的传统氯霉素去除方法相比,生物电化学系统 (BES) 因其较高的去除效率、较低运行成本和环境可持续性等优点而受到越来越多的关注[9-12]。传统的厌氧转化过程中,低温会降低污染物的降解速率[13],所以在中温带地区当冬天温度降至5~10 ℃时,探索高效稳定的低温条件下氯霉素的降解工艺尤为重要。而低温条件下生物电化学降解氯霉素目前尚无研究。
本实验研究了BES在低温条件下 (12±2 ℃)提高CAP去除效率的影响参数:分别为不同磷酸盐缓冲液体系 (PBS) 浓度条件下 BES反应器的电化学特性,当碳源 (外加电子供体) 分别为葡萄糖和污泥发酵液 (Sludge fermentation liquid,SFL) 时生物阴极CAP去除效率及其与非生物阴极的效果对比。
1 材料与方法
1.1 厌氧污泥、CAP和污泥发酵液
用于富集CAP降解微生物群落的污泥来自于太平污水处理厂 (哈尔滨,中国)。实验所用CAP (纯度≥98%) 购买于Sigma-Aldrich公司。SFL如文献所述[14]经过超声处理,之后添加到双极室电化学反应器的阴极室作为碳源和外加电子供体。
1.2 反应器结构与组装
实验所用双极室BES反应器材料为聚碳酸酯。反应器主体由两块大小相等的模块 (7 cm×7 cm×4 cm) 组装而成,模块中空呈圆柱形的腔(直径5 cm,长4 cm)。模块用螺栓连接,中间用阳离子交换膜 (Ultrex CMI-7000,膜国际,美国) 分隔,左右各用一块聚碳酸酯平板 (7 cm×7 cm×1 cm) 密封。单个极室体积为85 mL。阳极为碳刷 (直径4 cm,长3 cm,东邦,日本),阴极为碳布 (直径5 cm,非耐湿,YB-20,亿邦科技,中国)。钛丝 (直径 1 mm,宝鸡力兴钛业) 被压平紧贴于碳布用于收集电子。饱和甘汞参比电极 (SCE,0.247 V vs. SHE,217型,上海精密科学仪器,中国) 嵌入阴极室用于测量阴极电势。
1.3 反应器运行
反应器阳极与阴极微生物富集方法如文献所述[15],阳极驯化成功的标志为电位稳定在-0.4 V左右,所有富集和实验过程都在低温条件下运行 (12±2 ℃),使用直流开关电源(HY-60 A) 外加0.5 V电压。取污水处理厂污泥上层清液与阴极液按照 1∶3的体积比混合均匀,其中,阴极液含有30 mg/L CAP、500 mg/L葡萄糖、矿质元素和维他命浓缩液[14],配制溶液所用蒸馏水先煮沸除氧,药品溶解混匀之后再向溶液中曝氮气15 min。
氯霉素的还原过程在两种模式下进行:1) BES非生物阴极 (阴极液 PBS浓度分别为50 mmol/L、25 mmol/L和10 mmol/L);2) BES生物阴极 (阴极液为25 mmol/L PBS,葡萄糖或SFL作为外加电子供体)。SFL添加量相当于500 mg化学需氧量 (COD)。使用数据记录仪(型号 2700,吉时利,美国) 记录电压电势。电流 (I) 和氯霉素还原效率 (ErCAP,%) 按照前述方法计算[15]。CAP还原降解趋势用指数衰减方程拟合 (SigmaPlot v.11.0):

Ct为氯霉素浓度 (mg/L);t为反应时间 (h);C0为氯霉素初始浓度,约30 mg/L;k(h-1) 为速率常数;y0为系统偏差;氯霉素半衰期t1/2使用如下方程计算t1/2=0.693/k。
1.4 分析方法
高效液相色谱 (HPLC):氯霉素及其还原产物的浓度均用高效液相色谱 (型号 2695,Waters,美国) 检测,色谱柱为C18(色谱柱长度250 mm,色谱柱内径4.6 mm,填料颗粒直径5 μm),检测器为紫外检测器,氯霉素检测波长为275 nm,还原产物的检测波长为250 nm和310 nm。流动相甲醇与水的比例为55∶45,流速0.8 mL/min,检测温度30 ℃。
高效液相色谱-质谱联用 (HPLC-MS/MS):HPLC-MS/MS (赛默飞世尔离子色谱 Thermo Finnigan LCQ Deca XP Max LC/MS,德国) 用于氯霉素最终还原产物的鉴定。反应器0 h和96 h的样品先在转速13 000×g下离心30 min,取上层清液用甲醇稀释,然后进行检测。
电化学交流阻抗谱 (EIS):EIS是一项功能强大的技术,常用于研究反应器结构和电极材料对电化学反应过程中电子传递阻力即反应器内阻的影响。因此,实验用 EIS揭示不同磷酸盐浓度 (50 mmol/L、25 mmol/L和10 mmol/L)和生物阴极对于反应器内阻的影响。实验所用仪器为三电极系统的电化学工作站 (型号660D,华辰,美国),频率范围105到10-2Hz,电压0.5 mV,测量项目为非生物阴极、生物阴极和整个反应器的欧姆内阻和极化内阻。EIS图谱拟合软件采用Zsimpwin 3.10。
2 结果与分析
2.1 磷酸盐浓度对CAP还原效率的影响
氯霉素在不同 PBS浓度条件下降解速率常数k和半衰期t1/2如图1所示。12 h和24 h条件下ErCAP和k都随着PBS浓度的增加而增加,如表1所示,50 mmol/L,25 mmol/L和10 mmol/L PBS条件下在 24 h的 ErCAP和k分别为(59.62±2.75)%、(62.9±8.73)%、(63.24±1.95)%和0.0367±0.0013、0.0420±0.0013、0.0525±0.0020。结果表明,较高的PBS浓度可以促进电子的传递进而加速电化学反应的发生[16]。考虑到 BES在实际工程中运用的环境影响,在后续的研究中采用25 mmol/L PBS浓度作为电解液,因其具有较低的磷酸盐投加量和中等的还原效率。
2.2 生物阴极还原降解CAP
图 1和表1同时显示了生物阴极的氯霉素还原速率,数据显示,当生物阴极外加电子供体为葡萄糖和SFL时,氯霉素的降解速率常数k和氯霉素半衰期t1/2均与非生物阴极有较大差别,PBS浓度同为 25 mmol/L时,生物阴极k=0.0838±0.0051,t1/2=8.27 h,而非生物阴极k=0.0420±0.0013,t1/2=16.50 h。这说明了生物阴极强化了氯霉素还原作用,附着生长在阴极上的生物通过直接从电极获得电子或者从外加电子供体获得电子后,将电子用于还原氯霉素。同时可以看到,以SFL作为外加电子供体时,氯霉素的还原速率较葡萄糖作为外加电子供体低,其k=0.0596±0.0026,t1/2=11.63 h,原因可能是由于SFL中容易被微生物直接利用的乙酸含量较少,仅为41.50%,而微生物利用乙酸等短链脂肪酸产生H2对于阴极电化学反应具有一定的促进作用[15,17]。上述结果表明,生物阴极强化了氯霉素的还原效率,并且,若选择 SFL作为碳源和外加电子供体代替葡萄糖的添加不仅可以减少碳足迹,同时可以降低BES在规模扩大化之后的运行成本。这也预示着污泥发酵工艺耦合BES生物阴极降还原解抗生素类的微污染物将成为可能。
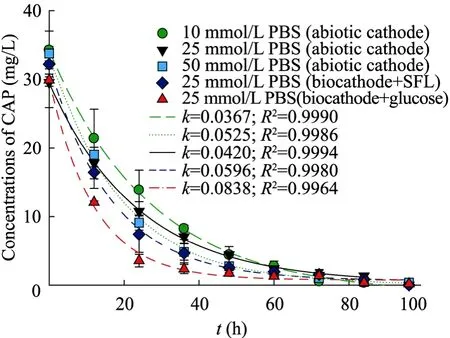
图1 不同条件下氯霉素还原降解浓度变化Fig. 1 Cathodic reductive degradation of CAP under different conditions.

表1 不同模式下的ErCAP、k和t1/2值Table 1 ErCAP and k as well as t1/2 value under different mode
2.3 电化学交流阻抗谱
实验运用 EIS技术探索了不同磷酸盐浓度对BES反应器整体欧姆内阻的影响及非生物阴极与生物阴极欧姆内阻的差异。如图 2所示,图中每一个实心圆点都代表了特定频率下的阻抗值。起始位置是高频区,代表反应器的欧姆内阻,而半圆形曲线的直径则代表极化内阻 (Rp) (或电荷传递阻力)[18]。由图 2A可知,不同的磷酸盐浓度影响BES反应器的欧姆内阻和极化内阻 (表2),随着磷酸盐浓度的提高,反应器的欧姆内阻和极化内阻同时减小,当磷酸盐浓度为 10 mmol/L、25 mmol/L和50 mmol/L时,反应器的欧姆内阻分别为 59.5 Ω、87.77 Ω 和 186.5 Ω。由图 2B 可知,生物阴极是另一种减小反应器内阻的方式,因为生物阴极的内阻远远小于非生物阴极。这说明附着在阴极电极上的微生物可以降低电子在溶液与电极之间的传递阻力,甚至有的微生物直接从电极获得电子用于底物的还原[19]。究其原因,微生物细胞膜既是细胞的保护膜,又是物质传递的通道,它可以通过主动运输等方式更迅速的向包内传递离子,这可能是生物阴极减小内阻的原因之一,更深入全面的研究还有待继续进行。
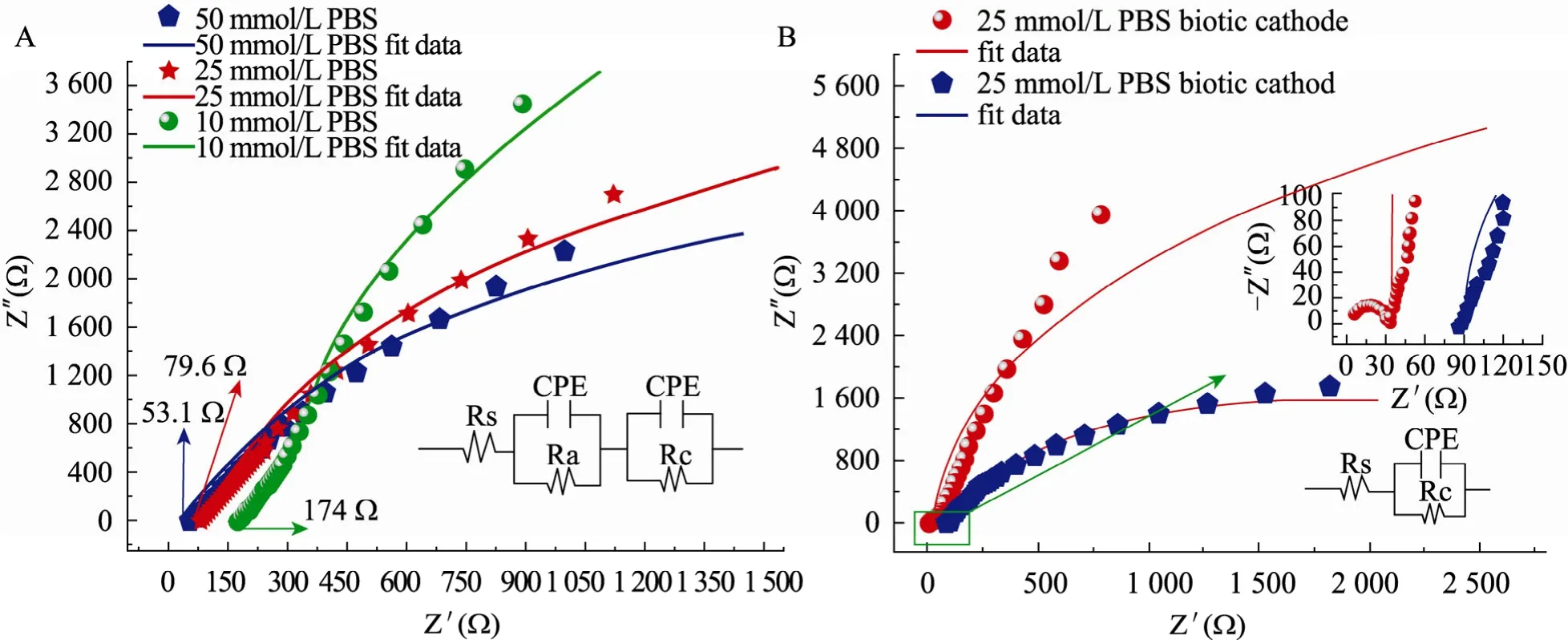
图2 不同磷酸盐浓度条件的非生物阴极 (A,整个反应器) 和生物阴极 (B,阴极) 的电化学交流阻抗谱Fig. 2 The impedance of the bioelectrochemical reactor in presence of different levels of PBS buffer (mmol/L) (A,whole cell) and in biocathode (B, cathode).
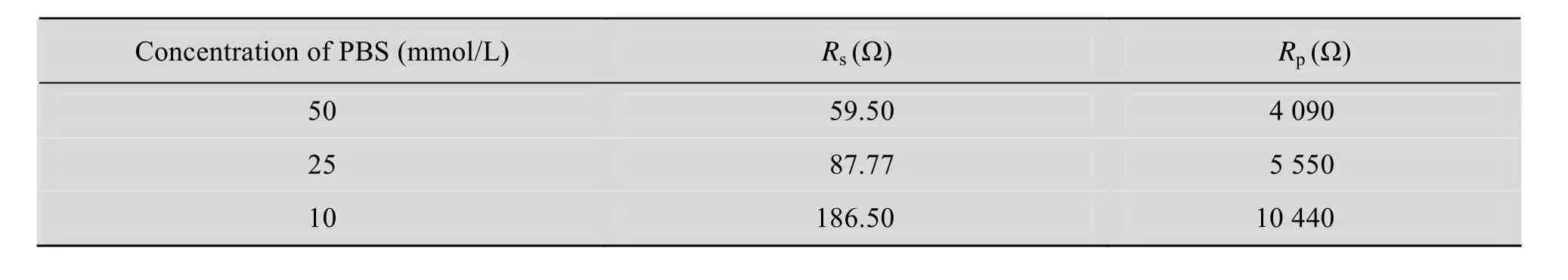
表2 不同磷酸盐浓度条件下BES反应器交流阻抗谱拟合值 (Rs:溶液内阻,Rp:极化内阻)Table 2 Fit parameters for spectra of the BES reactors at different PBS concentrations (Rs: solution resistance, Rp: polarization resistance)
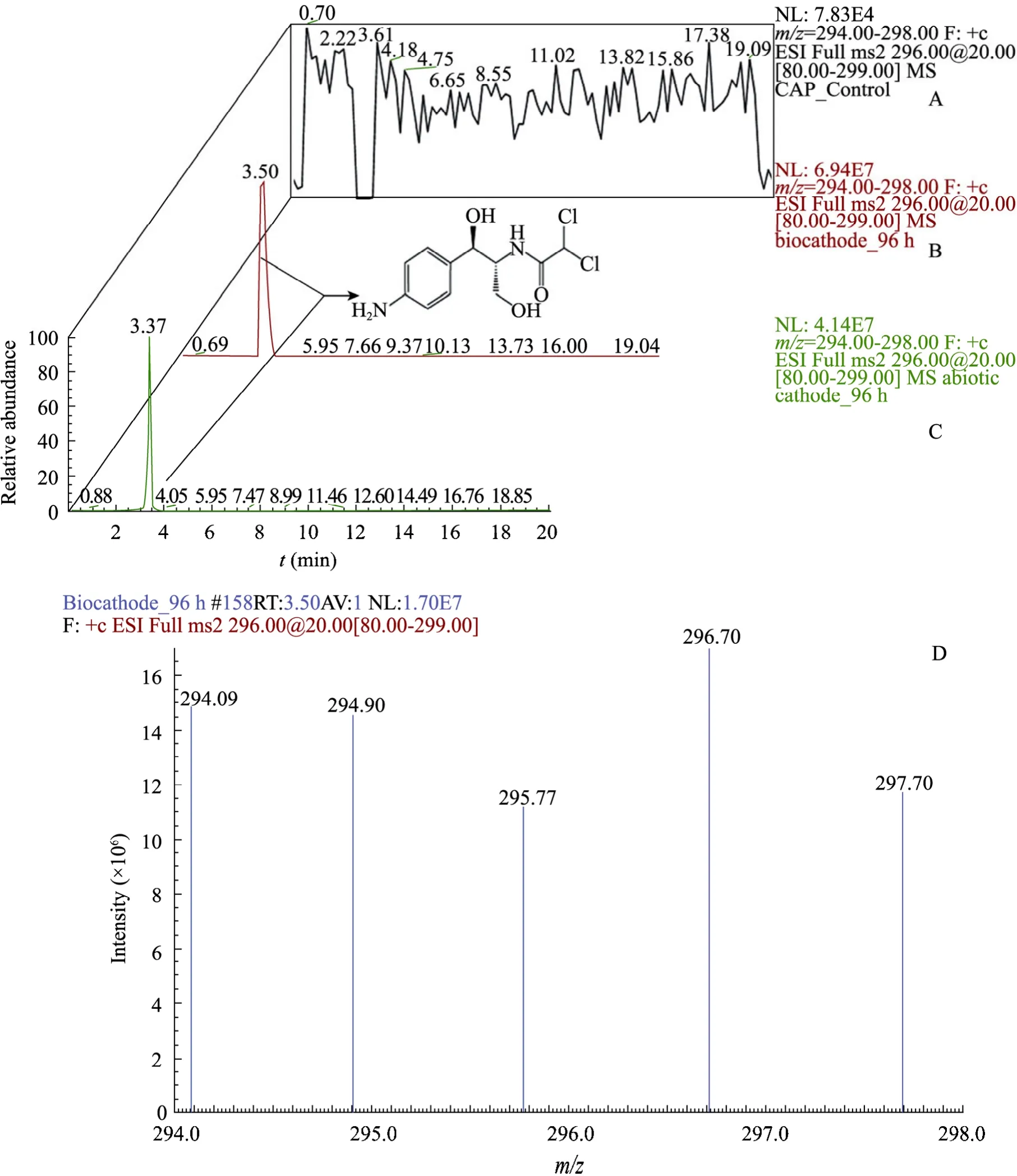
图3 氯霉素还原终产物液质联用的鉴定Fig. 3 HPLC-MS/MS identification of CAP reductive end product. (A) AM was not detected in the CAP control sample (0 h). (B, C) AM in biocathode and abiotic cathode effluent at 96 h. (D) AM had the chlorine atoms isotope characteristic and had m/z of 294, 296, and 298[M+H]+.
2.4 还原终产物
BES还原降解 CAP的终产物使用HPLC-MS/MS检测分析,结果如图3所示。其中,生物阴极样品 3.50 min (图 3B) 出峰物质和非生物阴极3.37 min出峰物质 (图3C) 初步鉴定为同一终产物。
Smith 等[20]和 Zhao 等[21]曾对氯霉素的生物还原过程进行研究,其结论显示该终产物已缺失了细菌抗性。因此,BES还原降解氯霉素使之脱除生物抗性,对于后续代谢产物的生物降解以至生物矿化都具有重大意义。
3 结 论
研究了低温条件下在BES反应器中生物电化学还原降解氯霉素的效果。生物阴极相对于非生物阴极具有较快的CAP降解速率,同时,增加PBS浓度和附着生长在电极上的生物膜都可以降低反应器的欧姆内阻和极化内阻,进而提高CAP的去除效率。另外,SFL可以用于生物阴极作为碳源和外加电子供体代替葡萄糖。综上所述,研究表明功能生物阴极可以用于低温地区还原降解含抗生素类微污染物的废水处理过程。
[1]Andam CP, Fournier GP, Gogarten JP. Multilevel populations and the evolution of antibiotic resistance through horizontal gene transfer. FEMS Microbiol Rev, 2011, 35(5): 756−767.
[2]Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol R, 2010,74(3): 417−433.
[3]Zhang T, Li B. Occurrence, transformation, and fate of antibiotics in municipal wastewater treatment plants. Crit Rev Env Sci Tec, 2011,41(11): 951−998.
[4]Ding JJ, Liu YQ, Tan YM. Experimental study on the treatment of wastewater with high concentration of chloromycetin by SBR. Tech Equipment Environ Pollution Contr, 2003, 4(6): 27−29 (in Chinese).
丁建军,刘燕群,谭佑铭. SBR 法处理高浓度氯霉素废水的实验研究. 环境污染治理技术与设备, 2003, 4(6): 27−29.
[5]Chatzitakis A, Berberidou C, Paspaltsis I, et al.Photocatalytic degradation and drug activity reduction of chloramphenicol. Water Res, 2008,42(1-2): 386−394.
[6]Badawy MI, Wahaab RA, El-Kalliny AS.Fenton-biological treatment processes for the removal of some pharmaceuticals from industrial wastewater. J Hazard Mater, 2009, 167(1-3):567−574.
[7]Lin L, Yuan SH, Chen J, et al. Treatment of chloramphenicol-contaminated soil by microwave radiation. Chemosphere, 2010, 78(1): 66−71.
[8]Fan Y, Wang B, Yuan SH, et al. Adsorptive removal of chloramphenicol from wastewater by NaOH modified bamboo charcoal. Bioresource Technol, 2010, 101(19): 7661−7664.
[9]Huang LP, Cheng SA, Chen GH.Bioelectrochemical systems for efficient recalcitrant wastes treatment. Biotechnol J Chem Technol Biot, 2011, 86(4): 481−491.
[10]Mu Y, Rozendal RA, Rabaey K, et al. Nitrobenzene removal in bioelectrochemical systems. Environ Sci Technol, 2009, 43(22): 8690−8695.
[11]Sun M, Reible DD, Lowry GV, et al. Effect of applied voltage, initial concentration, and natural organic matter on sequential reduction/oxidation of nitrobenzene by graphite electrodes. Environ Sci Technol, 2012, 46(11): 6174−6181.
[12]Wang AJ, Cui D, Cheng HY, et al. A membrane-free, continuously feeding, single chamber up-flow biocatalyzed electrolysis reactor for nitrobenzene reduction. J Hazard Mater, 2012,199(15): 401−409.
[13]Lettinga G, Rebac S, Zeeman G. Challenge of psychrophilic anaerobic wastewater treatment.Trends Biotechnol, 2001, 19(9): 363−370.
[14]Liu W, Huang S, Zhou A, et al. Hydrogen generation in microbial electrolysis cell feeding with fermentation liquid of waste activated sludge.Int J Hydrogen Energ, 2012, 37(18): 13859−13864.
[15]Wang AJ, Cheng HY, Liang B, et al. Efficient reduction of nitrobenzene to aniline with a biocatalyzed cathode. Environ Sci Technol, 2011,45(23): 10186−10193.
[16]Li YF. Effect of anion concentration on the kinetics of electrochemical polymerization of pyrrole. J Electroanal Chem, 1997, 433(1/2): 181−186.
[17]Rabaey K, Rozendal RA. Microbial electrosynthesis-revisiting the electrical route for microbial production. Nat Rev Microbiol, 2010,8(10): 706−716.
[18]He Z, Mansfeld F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energ Environ Sci,2009, 2(2): 215−219.
[19]Ter Heijne A, Schaetzle O, Gimenez S, et al.Identifying charge and mass transfer resistances of an oxygen reducing biocathode. Energy Environ Sci, 2011, 4(12): 5035−5043.
[20]Smith GN, Worrel CS. Reduction of chloromycetin and related compounds byEscherichia coli. J Bacteriol, 1953, 65(3): 313−317.
[21]Zhao X, Tian FW, Wang G, et al. Isolation,identification and characterization of human intestinal bacteria with the ability to utilize chloramphenicol as the sole source of carbon and energy. FEMS Microbiol Ecol, 2012, 82(3):703−712.
(本文责编 陈宏宇)
September 19, 2012; Accepted: December 18, 2012
Qun Yan. Tel/Fax: +86-510-85197872; E-mail: yanqun@jiangnan.edu.cn
江苏省高校科研产业化项目 (No. JHB2011-29),江苏省自然科学经费 (No. BK2012558) 资助。Abstract: In this study, we investigated reductive degradation of nitroaromatic antibiotic chloramphenicol to non-effective antibacterial amine product in fed-batch biocatalyzed electrolysis systems (BES) (applied voltage was 0.5 V)under low temperature (12±2 °C). The ohm resistance of the whole BES reactor increased when the phosphate buffer solution concentrations decreased. Efficiencies (ErCAP) of chloramphenicol reduction with biocathode (PBS, 25 mmol/L) in presence of glucose was (86.3±1.69)% within 24 h and sludge fermentation liquor was (74.1±1.44)% within 24 h. While the ErCAPof abiotic cathode under the same condition was only (57.9±1.94)% within 24 h. It suggested that biocathode could be a promising technology for reductive biodegradation of nitroaromatic antibiotics-containing wastewater in areas with relatively low annual mean temperature.
Reductive degradation of chloramphenicol in bioelectrochemical system
Fei Sun1, Aijie Wang2, Qun Yan1, and Guangsheng Zhang1
1School of Environmental and Civil Engineering,Jiangnan University,Wuxi214122,Jiangsu, China
2School of Municipal and Environmental Engineering,Harbin Institute of Technology,Harbin150090,Heilongjiang, China
biocatalyzed electrolysis systems, biocathode, chloramphenicol, ohm resistance, low temperature
Supported by: Industrialization Projects for University Scientific Research of Jiangsu Province (No. JHB2011-29), Natural Scientific Research Funding of Jiangsu Province (No. BK2012558).
