上海临港海域产蛋白酶海洋细菌的筛选及鉴定
2013-09-03宁喜斌
张 祁,宁喜斌
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
蛋白酶是水解蛋白质肽键酶的总称,其销量至少占全球酶制剂市场的60%~65%[1],已广泛应用于洗涤剂、食品、制革、医药、饲料、环境保护、胶片中银的回收等众多领域[2-4]。目前工业用蛋白酶大多由芽孢杆菌属(Bacillus)菌株产生[5-6],经过条件优化及诱变处理蛋白酶的产量及稳定性较高,但无法满足市场对特殊性能蛋白酶的需求,因此筛选新型蛋白酶产生菌株意义重大。海洋微生物是新型蛋白酶的重要来源,与陆地微生物相比海洋微生物具有独特的生理特点、代谢途径及营养利用方式,因此其产生的酶及其他代谢产物往往具有特殊性能[7]。目前从海洋环境中筛选得到的产蛋白酶菌株主要为假单胞菌属(Pseudomonas)[8]、弧菌属(Vibrio)[9]、交替假单胞 菌 属 (Pseudoalteromonas)[10-11]、 黄 杆 菌 属(Flavobacterium)[12]、希瓦氏菌属(Shewanella)[13]、海杆菌属(Marinobacter)[14]等。本研究从上海临港海域分离、筛选产蛋白酶的海洋细菌,并对其中1株蛋白酶活力较高的菌株进行鉴定及生长特性、酶学特性的初步研究。为了解上海临港海域海洋细菌及产蛋白酶菌株的多样性奠定了基础,同时为寻找新型特殊蛋白酶高产菌株开拓了新的思路。
1 材料与方法
1.1 材料与仪器
样品 2011年4~12月于上海市临港海域采集海水及海泥样品,用无菌采样器采集水面下30~100cm的海水样品及3~10cm深的海泥样品,样品采集后2h内送回实验室处理分析;福林酚试剂 上海荔达生物科技有限公司;酪氨酸 Sigma公司;柱式细菌基因组DNA抽提试剂盒、PCR反应试剂盒及PCR引物 生工生物工程(上海)股份有限公司;DNA产物纯化试剂盒 北京索来宝科技有限公司;琼脂糖 加拿大Bio Basic INC公司;EB 上海华舜生物工程有限公司;1kb GeneRuler Fermentas公司;其余试剂 均采用国产分析纯;2116E培养基(g/L)蛋白胨5,磷酸铁0.1,酵母粉1,琼脂15,海水配制,pH7.5[15];酪蛋白培养基(g/L)干酪素 5,酵母粉1,琼脂15,海水配制,pH7.5;种子及发酵培养基(g/L)蛋白胨5,酵母粉3,葡萄糖5,海水配制,pH7.5[16];海水 取自上海市临港海域,过滤沉淀,高压灭菌后,4℃保藏备用;酸性平板 用 HCl调至pH5并将琼脂量增加为25g/L;碱性平板 用1%(W/V)Na2CO3调pH10,含盐平板添加10%(W/V)的NaCl。
pH730台式pH精密测试仪 德国WTW;UV2300分光光度计 上海天美科学仪器有限公司;PTC-200 PCR仪 美国 Bio-Rad公司;GelDoc XR凝胶成像系统 美国Bio-Rad公司。
1.2 实验方法
1.2.1 海洋细菌的分离和纯化 海水和海泥样品经梯度稀释后,取0.1mL稀释液分别涂布于2116E平板和酪蛋白平板上,并分别于以下5种条件培养:A-平板 pH5,28℃培养;B-平板 pH7.5,28℃培养;C-平板pH10,28℃培养;D-平板中添加10%(W/V)的 NaCl,pH7.5,28℃培养;E-平板 pH7.5,55℃培养。根据菌株在2116E平板和酪蛋白平板上的菌落大小、形态、颜色等特征初步分离筛选。挑取单菌落于相应pH的2116E平板反复划线分离,将纯化后的菌株编号并转接于2116E斜面,4℃保存。
1.2.2 产蛋白酶菌株的筛选
1.2.2.1 产酶菌株的初筛 将保存的菌株用2116E培养基复壮几次,用接种针点种于酪蛋白平板并于相应培养条件下培养48h。测量菌落直径(d)和透明圈直径(D),计算透明圈直径与菌落直径的比值(D/d),各测3次,计算平均值。对于透明圈不明显的,可以在酪蛋白平板上滴加10%(W/V)的三氯乙酸溶液(TCA),将酪蛋白沉淀,透明圈会更明显。通过比较D/d值初步判断菌株分泌胞外蛋白酶能力的大小。
1.2.2.2 产酶菌株的复筛 挑取试管斜面活化后的菌种1环接于种子培养基中,120r/min、28℃振荡培养16h,得到种子液,再以2%(V/V)的接种量接入50mL发酵培养基中,120r/min、28℃振荡培养48h,发酵液10000r/min、4℃离心10min,上清液即为粗酶液,测定上清液中蛋白酶活力。
1.2.3 酶活力测定方法 采用福林酚显色法[17]进行蛋白酶活力的测定。具体步骤如下:1mL稀释酶液加入2%(W/V)的酪蛋白底物1mL,适当温度反应10min,加入2mL 0.4mol/L的TCA终止反应。空白对照是1mL酶液加入2mL 0.4mol/L的TCA使其失活,然后加入1mL酪蛋白底物。离心取上清1mL,加入5mL 0.4mol/L Na2CO3溶液和1mL福林酚试剂,混匀,40℃保温20min,测定OD680值。酶活数据为3次重复实验的平均值。一定条件下,每分钟催化酪蛋白水解生成1μg酪氨酸所需的酶量定义为1个酶活力单位(U/mL)。
1.2.4 生理生化鉴定 根据《伯杰氏细菌鉴定手册(第九版)》[18]并参考《常见细菌系统鉴定手册》[19]的部分方法对所筛选出的菌株进行鉴定。
1.2.5 16S rDNA鉴定及系统发育树的构建 参照文献[20]设计引物。用柱式细菌基因组DNA抽提试剂盒提取基因组DNA。PCR扩增条件:94℃预变性4min,94℃ 变 性 1min,57℃ 退 火 30s,70℃ 延 伸1.5min,30 个循环,72℃延伸7min,4℃冷却。PCR 扩增产物经1%琼脂糖凝胶电泳,扩增条带用DNA产物纯化试剂盒纯化后,送生工生物工程(上海)有限公司测序。登录GenBank数据库,Blastn搜索同源序列,选取相关序列,采用Clustal X 2.0进行多序列比对,用MEGA 5.1软件中的邻接法(Neighbor-joining,NJ)构建进化树,并用自举法检测置信度,自举数据集1000次。
1.2.6 菌株生长特性的研究
1.2.6.1 温度对菌株生长的影响 用海水配制2116E液体培养基,取SE2011的种子液0.1mL,接种于 5mL 液体培养基中,分别在15、20、25、30、35、40℃条件下120r/min振荡培养64h,每隔8h取样,测定OD600。
1.2.6.2 盐度对菌株生长的影响 用蒸馏水配制2116E液体培养基,分取SE2011的种子液0.1mL接种于含有0%、0.5%、1%、3%、5%、7%、9%(W/V)NaCl浓度的5mL液体培养基中,30℃、120r/min振荡培养24h,每隔3h取样,测定OD600。
1.2.7 酶学特性的研究
1.2.7.1 菌株SE2011所产蛋白酶最适温度的测定 将粗酶液溶于pH8.0的Tris-HCl缓冲液中,分别设定 30、40、50、55、60、70、80、90℃,8 个温度梯度,将稀释酶液与酪蛋白底物在不同温度下分别反应10min。用福林酚法测定不同温度下的酶活力,以确定其最适温度。
1.2.7.2 菌株SE2011所产蛋白酶最适pH的测定配制0.05mol/L的pH5.0~11.0缓冲溶液,缓冲液体系如下:柠檬酸盐缓冲液(pH5.0~6.0),磷酸盐缓冲液(pH7.0),Tris-HCl缓冲液(pH8.0),甘氨酸-NaOH缓冲液(pH9.0~11.0)。用不同pH的缓冲液配制2%(W/V)的酪蛋白底物并稀释粗酶液,取1mL稀释酶液于55℃测定不同pH下的酶活力,以确定其最适pH。
1.3 数据处理
采用SPSS 18.0统计软件进行单因素方差分析及Duncan多重比较(p<0.05)。
2 结果与分析
2.1 海洋细菌分离结果
对20份海水样品和10份海泥样品中的海洋细菌进行分离纯化,共获得170株海洋细菌,99株分离自2116E平板,71株分离自酪蛋白平板,表明2116E培养基更适合用于海洋细菌的分离。从样品来源分析,从海泥样品中分离得到的海洋细菌为103株,占分离菌株的60.6%,从海水样品中分离得到的海洋细菌为67株,占分离菌株的39.4%。从海泥样品中分离得到的菌株在2116E平板上颜色较为丰富,呈现白色、乳白色、黄色、橘黄色、米黄色、黄绿色、粉红色等颜色,并且菌落形态也较为多样,大多数菌落边缘较为整齐,少数呈现不规则的菱形、椭圆形、丝状等。从海水样品中分离得到的海洋细菌在2116E平板上颜色比较单一,以乳白色和橘黄色为主,少数呈现粉红色及黄绿色,菌落边缘多较为整齐。从培养条件分析,中性平板分离得到111株,产蛋白酶菌株有101株;酸性平板分离得到24株,产蛋白酶菌株有14株;碱性平板分离得到11株,产蛋白酶菌株有1株;添加10%的NaCl平板分离得到8株,产蛋白酶菌株有3株;55℃条件下培养分离得到16株,产蛋白酶菌株有8株,分离结果见图1。

表1 产蛋白酶菌株筛选结果Table 1 The screening results of protease-producing stains

图1 海洋细菌分离结果Fig.1 Marine bacteria isolation results
2.2 产蛋白酶海洋细菌的筛选结果
用点种法对全部170株菌株海洋细菌进行了筛选,其中127株可产蛋白酶,有18株菌的D/d值大于8.0,用福林酚法进行复筛,筛选结果见表1。从复筛结果可以看出,蛋白酶活力的高低与D/d值不完全呈正比关系,这与文献[21-22]得出的结论一致。分析其原因可能是每批酪蛋白平板中酪蛋白颗粒的大小、平板的厚度及含盐量的差异会影响透明圈大小;固体和液体培养条件的不同;同一发酵时间和酶作用温度不可能是每一株菌的最适产酶时间和酶作用温度,不同菌株具有不同的蛋白酶酶系等[23]。因此在点种法初筛后,进行福林酚法复筛是非常必要的。通过测定酶活力,菌株SE2011的酶活力最高,在40℃、pH7.5条件下与底物反应,酶活力可达到(747.12±0.38)U/mL,因此选择该菌作为后续研究的重点。菌株SE2011在酪蛋白平板点种见图2。
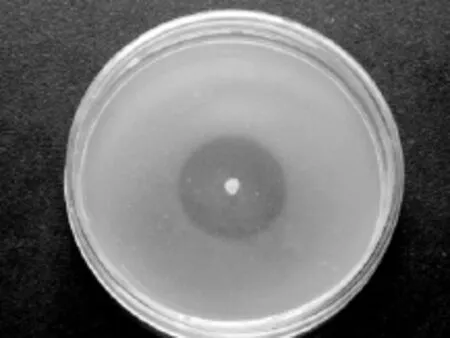
图2 菌株SE2011在酪蛋白平板培养48h形成的透明圈Fig.2 Proteolysis zone of strain SE2011 which culture at casein plates for 48h
2.3 形态及生理生化鉴定
菌株SE2011在2116E平板上生长时菌落呈淡黄色,半透明,表面光滑,湿润,两面颜色一致,边缘整齐;染色观察为革兰氏阴性杆菌(多数稍弯曲),无芽孢;生理生化测定结果见表2,菌株SE2011可水解淀粉、液化明胶,可发酵葡萄糖、蔗糖、甘露醇、山梨醇、阿拉伯糖,但不能利用鼠李糖、蜜二糖、苦杏仁苷和肌醇。氧化酶、过氧化氢酶、V.P反应、M.R反应、精氨酸双水解酶为阳性。鸟氨酸脱羧酶为阴性,不产生H2S。通过查阅《伯杰氏细菌鉴定手册》,将菌株SE2011初步鉴定为鳗利斯顿氏菌(Listonella anguillarum)。

表2 菌株SE2011的生理生化特性Table 2 Biochemical characteristics of strain SE2011
2.4 16S rDNA鉴定及系统发育树
以SE2011的基因组为模板进行PCR扩增,扩增条带见图3,经测序获得16S rDNA序列为1444bp,将序列数据与GenBank中已存在细菌的16S rDNA基因序列比对分析。比对结果表明,菌株SE2011与弧菌属细菌具有较高同源性,与Listonella anguillarum同源性高达99%。选取相关序列构建进化树,如图4所示,该菌与菌株Listonella anguillarum有较大的同源性且处在同一分支。综合形态、生理生化鉴定及16S rDNA序列比对结果,将菌株SE2011鉴定为鳗利斯顿氏菌(Listonella anguillarum)。

图3 16S rDNA PCR产物电泳图Fig.3 The electrophoresis result of PCR products of 16S rDNA

图4 菌株SE2011的系统发育树Fig.4 Phylogenetic tree of the SE2011 bacterium
2.5 温度对菌株生长的影响
海洋微生物生长的典型特征是低温性和耐盐性[23],因此有必要研究所筛选菌株的生长温度和耐盐性。由图5可知,菌株SE2011在15~30℃生长较快,在35℃和40℃生长缓慢,表明该菌为中度嗜冷菌。该菌在30℃培养16h达到稳定期,菌体的OD600约为1.9000。多重比较显示25、30℃不同培养时间OD值差异不显著(p>0.05)。
2.6 盐度对菌株生长的影响
不同盐度对菌株的影响不同,如图6所示,菌株SE2011在无NaCl或添加9%的NaCl条件下几乎不生长,在整个培养周期OD值差异不显著(p>0.05)。在盐度为0.5%~5%时生长良好,最适生长盐度为1%,说明该菌为海洋细菌或已适应海洋高盐环境的陆源细菌。在1%~3%盐度下培养9h达到稳定期,菌体OD600约为2.000。多重比较显示1%盐度和3%盐度不同培养时间OD值差异不显著(p>0.05)。

图5 温度对SE2011生长的影响Fig.5 Effect of the temperature on growth of SE2011

图6 盐度对SE2011生长的影响Fig.6 Effect of the salinity on growth of SE2011
2.7 菌株SE2011所产蛋白酶最适温度的测定
测定菌株SE2011所产蛋白酶与底物在不同反应温度下的酶活力,结果显示该酶在30~90℃时有活力,在55℃时达到最高,与其他反应温度下的酶活力差异极显著(p<0.01),表明该蛋白酶的最适反应温度为55℃,属中温蛋白酶,如图7所示。在30℃和90℃还可保留最大酶活力的34.6%和14.2%。

图7 温度对酶活力的影响Fig.7 Effect of temperature on protease activity of SE2011 crude protease
2.8 菌株SE2011所产蛋白酶最适pH的测定
菌株SE2011所产蛋白酶在pH5.0~11.0条件下酶活力变化见图8。该酶在pH8.0时酶活力达到最大,与其他pH条件下反应的酶活力差异极显著(p<0.01),表明该酶属碱性蛋白酶范畴。在 pH6.0和pH10.0时还可保留最大酶活力的28.2%和25.9%。
3 结论与讨论

图8 pH对酶活力的影响Fig.8 Effect of pH on protease activity of the crude protease from SE2011
从上海临港海域采集的海水及海泥样品经梯度稀释后分别于中性、酸性、碱性、添加10%的NaCl和55℃,5种条件下培养,共分离得到170株海洋细菌,其中中性平板分离得到的海洋细菌及产酶菌株最多,这与上海临港地区的自然环境相一致(海水温度在9~29℃,pH在8.0左右),但在此环境中也分离到了一些能耐受极限条件的海洋细菌及产酶菌株。经酪蛋白点种法初筛发现有127株可产蛋白酶,由此可以看出,上海临港海域存在种类较为丰富的具有产胞外蛋白酶能力的海洋细菌,为研究上海临港海域海洋细菌及所产胞外蛋白酶的多样性提供了有利条件。
选择D/d值大于8.0的菌株进行福林酚显色法复筛,筛选得到一株产蛋白酶活力较高的菌株SE2011。经形态学观察、生理生化鉴定及16S rDNA鉴定和系统发育分析,鉴定为鳗利斯顿氏菌(Listonella anguillarum)。
生长特性研究表明,该菌在15~30℃范围内生长良好,最适生长温度为30℃;生长盐度范围为0~7%(W/V),在无NaCl时生长不良,最适生长盐度为1%(W/V),说明其为海洋细菌。酶学性质研究表明该菌所产蛋白酶有较宽的作用温度30~90℃,最适温度为55℃;在pH6~10范围内呈现活力,最适pH为8.0。
本研究表明菌株SE2011是一株性状优良的出发菌株,后续研究的重点主要分为两个方向,一是用基因工程改良该菌,将产酶基因克隆构建重组工程菌,从而解决其在淡水中生长不良、酶产量不高而带来的生产成本问题;二是对酶的纯化,以及酶学性质的深入研究。
[1]Tari C,Genckal H,Tokatli F.Optimization of a growth medium using a statistical approach for the production of an alkaline protease from a newly isolated Bacillus sp.L21[J].Process Biochemistry,2006,41(3):659-665.
[2]肖峰,张浩,王斌,等.一株中性蛋白酶海洋细菌的筛选与初步鉴定[J].食品与药品,2011,13(3):89-92.
[3]Mehta V J,Thumar J T,Singh S P.Production of alkaline protease from an alkaliphilic actinomycete[J].Bioresource Technol,2006,97(14):1650-1654.
[4]Moreira K A,Porto T S,Teixeira M F S,et al.New alkaline protease from Nocardiopsis sp.:partial purification and characterization[J].Process Biochemistry,2003,39(1):67-72.
[5]Beg Q K,Gupta R.Purification and characterization of an oxidation- stable,thiol- dependent serine alkaline protease from Bacillus mojavensis[J].Enzyme and Microbial Technology,2003,32(2):294-304.
[6]Singh J,Vohra R M,Sahoo D K.Enhanced production of alkaline proteases by Bacillus sphaericus using fed-batch culture[J].Process Biochemistry,2004,39(9):1093-1101.
[7]Elibol M,Moreira A R.Optimizing some factors affecting alkaline protease production by a marine bacterium Teredinobacter turnirae under solid substrate fermentation[J].Process Biochemistry,2005,40(5):1951-1956.
[8]Zeng R,Zhang R,Zhao J,et al.Cold-active serine alkaline protease from the psychrophilic bacterium Pseudomonas strain DY-A:enzyme purification and characterization [J].Extremophiles,2003,7(4):335-337.
[9]Wang S L,Chio Y H,Yen Y H,et al.Two novel surfactantstable alkaline proteases from Vibrio fluvialis TKU005 and their applications[J].Enzyme and Microbial Technology,2007,40(5):1213-1220.
[10]Chen X L,Zhang Y Z,Gao P J,et al.Two different proteases produced by adeep - sea psychrotrophic bacterialstrain,Pseudoaltermonas sp.SM9913[J].Marine Biology,2003,143(5):989-993.
[11]Wang Q F,Hou Y H,Xu Z,et al.Purification and properties of an extracellular cold-active protease from the psychrophilic bacterium Pseudoalteromonassp.NJ276[J].Biochemical Engineering Journal,2008,38(3):362-368.
[12]Kim E H,Cho K H,Lee Y M,et al.Diversity of cold-active protease-producing bacteria from arctic terrestrial and marine environments revealed by enrichment culture[J].J Microbiol,2010,48(4):426-432.
[13]Zhou M Y,Chen X L,Zhao H L,et al.Diversity of both the cultivable protease-producing bacteria and their extracellular proteases in the sediments of the South China Sea[J].Microb Ecol,2009,58(3):582-590.
[14]林念炜,张锐,赵晶,等 .南极产低温蛋白酶菌株Marinobacter sp.R2的发酵条件及酶学性质研究[J].厦门大学学报:自然科学版,2004,43(6):865-869.
[15]张晓华.海洋微生物学[M].青岛:中国海洋大学出版社,2007.
[16]李丹,陈丽,李富超,等.一株产低温碱性蛋白酶海洋细菌Pseudoalteromonas flavipulchra HH407的筛选与生长特性[J].食品与生物技术学报,2007,26(6):74-80.
[17]中华人民共和国专业标准(SB/T 10317-1999).蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[18]Hot G J,Krieg R N,Sneath H A P,et al.Bergey’s manual of determinative bacteriology.9th ed[M].Baltimore:Williams&Wilkins Company,1994.
[19]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[20]Engel A S,Porter M L,Stern L A,et al.Bacterial diversity and ecosystem function of filamentous microbial mats from aphotic(cave)sulfidicspringsdominated bychemolithoautotrophic“Epsilonproteobacteria”[J].Microbiology Ecology,2004,51(1):31-53.
[21]蔡婉玲,田宝玉,郭菁.蛋白酶产生菌的筛选和紫外诱变育种[J].生物技术,2011(1):73-76.
[22]成堃,路福平,李玉,等.产碱性蛋白酶菌株的筛选、分子鉴定及其酶学性质的初步研究[J].中国酿造,2009(2):33-36.
[23]孙谧,王跃军,张云波,等.一株产低温碱性蛋白酶嗜冷海洋细YS-9412-130的分离和培养条件研究[J].海洋水产研究,2000,21(4):1-5.
