强化阿托伐他汀对接受PCI治疗的NSTE-ACS患者CIN 的干预作用*
2013-08-29梁海峰杨明韩凌马铮高亢陈萍
梁海峰 杨明韩凌 马铮 高亢 陈萍
在冠状动脉介入治疗(PCI)领域,造影剂肾病(Contrast-induced Nephropathy,CIN)已成为继支架内血栓和再狭窄之后的又一难题,有着很高的发病率[1,2]。CIN 延长患者住院时间,增加医疗费用和住院期间病死率,与远期不良事件的发生有关[3,4]。目前,临床工作中多采用Mehran评分[1]来预测CIN 的发生风险。防治措施主要集中在术前及术后的水化[5]、低渗性造影剂的选择、减少造影剂用量和避免肾毒性药物使用等方面。本课题组前期研究[6]显示,炎症反应是影响CIN 发生的一个重要因素,而他汀类药物除具有降脂作用外,还具有抑制炎症反应等作用[7]。本研究以不同炎症反应水平的非ST 抬高急性冠脉综合征(NSTE-ACS)患者为研究对象,观察不同剂量阿托伐他汀治疗对患者PCI术后炎症因子水平及CIN 发生率的影响,为CIN 的防治提供实验依据。
1 资料与方法
1.1 病例的纳入与排除
2010年2月~2012年6月,本院行择期经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)且符合入选标准的NSTE-ACS患者239例,男132例,女107例,平均年龄(65.9±8.6)岁。
入选标准:参照中华医学会心血管病分会不稳定型心绞痛与急性心肌梗死的诊断标准及ACC/AHA 不稳定型心绞痛、非ST 段抬高型心肌梗死指南[8],符合NSTE-ACS诊断标准,行PCI治疗并签署知情同意书患者。
排除标准:(1)年龄小于20岁或大于80岁者;(2)估算肾小球滤过率(Estimated Glomerular Filtration Rate,eGFR)<60ml/(min/1.73m2)者;(3)左室射血分数低于40%者;(4)近两周患急性感染性疾病者;(5)免疫性疾病处于活动期者;(6)恶性肿瘤者;(8)转氨酶超过正常上限3倍或存在慢性活动性肝病及肌病病史者;(8)阿托伐他汀过敏者;(9)应用主动脉内球囊反博(Intra-aortic Balloon Pump,IABP)辅助循环者;(10)近一周内开始应用血管紧张素转换酶抑制剂(Angiotensin-Converting Enzyme Inhibitors,ACE-I)或血管紧张素受体拮抗剂(Angiotensin Receptor Blocker,ARB)或调整剂量者;(11)一周内曾应用造影剂或造影剂过敏者;(12)应用肾毒性药物(包括非甾体抗炎药、氨基甙类抗生素、环孢霉素A、两性霉素B 等)者;(13)收缩压<90mmHg且持续1h以上或给予升压药物者;(14)PCI术前48h未停用双胍类药物者;(15)男性血细胞比容低于39%或女性低于36%者;(16)经超声或肾动脉造影证实单侧或双侧肾动脉狭窄>50%者。
1.2 病例分组及治疗
将入选的NSTE-ACS患者根据是否并发全身炎症反应综合征(Systemic Inflammatory Reaction Syndrome,SIRS)分为SIRS 组(A 组,n=68)和非SIRS对照组(B 组,n=171);再根据治疗情况将A组患者分为强化他汀治疗SIRS 组(A1组,n=34)和常规他汀治疗SIRS组(A2组,n=34);B 组患者分为强化他汀治疗非SIRS对照组(B1组,n=86)和常规他汀治疗非SIRS 对照组(B2组,n=85)。所有入选病例均给予正规冠心病二级预防治疗,行PCI术。术前6~12h,术后12~24h,给予0.9%生理盐水[1ml/(Kg/min)]水化。对比剂均选用欧乃派克(IohexolInjection,350mgI/ml,通用电气药业有限公司)。造影剂最大安全剂量参考Cigarroa 公式:体重(Kg)×5/Scr(mg/ml)。强化他汀治疗组(A1组和B1组):术前12h给予阿托伐他汀(立普妥,辉瑞制药有限公司)80mg顿服负荷量后行PCI术,术后继续阿托伐他汀40mg,每晚1次,至少10天。常规他汀治疗组(A2组和B2组):术前12h给予阿托伐他汀20mg顿服,术后继续给予阿托伐他汀20mg,每晚1次,至少10天。SIRS诊断标准:根据美国胸科医师学会和危重病医学会(ACCP/SCCM)1991年芝加哥SIRS诊断标准:(1)体温>38℃或<36℃;(2)呼吸频率>20次/min,或动脉血二氧化碳分压(PaCO2)<32mmHg;(3)外周血白细胞>12×109/L或<4.0×109/L或幼稚杆状细胞>10%;(4)心率>90次/min;符合上述标准2项及以上为SIRS。
1.3 主要观察指标
所有患者均在术前及术后3天检测超敏C 反应蛋白(hs-CRP)、白介素6(IL-6)、中性粒细胞明胶酶脂质运载蛋白(NGAL)和血肌酐。抽取患者前臂空腹静脉血,2h内3000转/min离心20min,取上清液(血清),30min内保存于-80℃低温冰箱中,集中检测(检测前室温解冻,避免反复冻融而影响检测结果)。应用简化MDRD 公式计算eGFR[ml/(min/1.73m2)]=175×Scr(mg/dl)-1.154×年龄-0.203×0.97(女性)。hs-CRP含量采用超敏乳胶增强散射比浊法,用日立7600型全自动生化分析仪测定,试剂盒由德国德赛公司提供。IL-6、NGAL测定采用ELISA 测定,试剂盒由加拿大LTD 公司提供。PCI术后3天,血肌酐较基线值升高25%或44.2μmol/L诊断为CIN[9]。
1.4 统计学处理
采用SPSS 16.0软件完成统计分析,hs-CRP水平呈非正态分布,转化为正态分布后进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组内不同时间点比较采用配对t检验;计数资料用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
两组患者在年龄、性别、高血压、糖尿病等相关疾病,临床用药及造影剂用量等情况均无统计学差异(P>0.05)。A 组不稳定型心绞痛患者所占比例低于B 组,非ST 段抬高心梗患者所占比例高于B组,差异有统计学意义(P<0.01)。见表1。
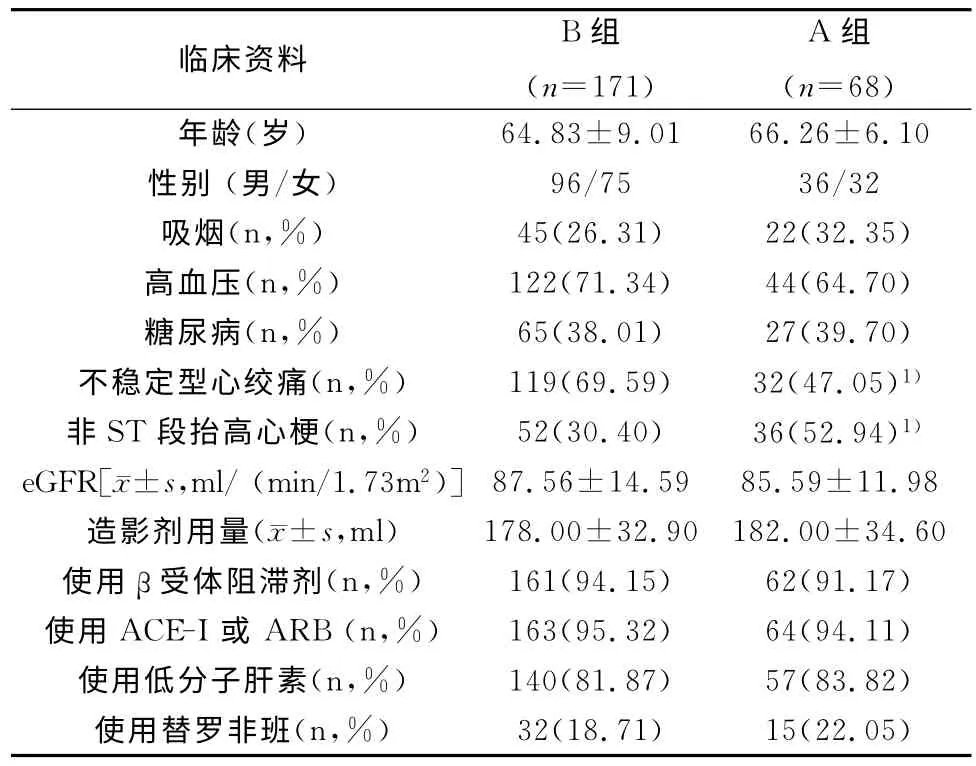
表1 两组患者临床资料比较
2.2 4组患者PCI术前及术后3天hs-CRP水平比较
术前,A1、A2组hs-CRP 水平分别高于B1、B2组,差异有统计学意义(P<0.01),A1、A2组之间及B1、B2组之间无统计学差异(P>0.05)。术后3天,A1组hs-CRP水平高于B1组,A2组hs-CRP水平高于B2组,差异均有统计学意义(P<0.05或P<0.01);A2组hs-CRP水平高于A1组,差异有统计学意义(P<0.01);B1、B2组间hs-CRP水平无统计学差异(P>0.05)。术后3天,各组hs-CRP水平均较术前明显降低,差异有统计学意义(P<0.01)。见表2。
表2 4组患者PCI术前及术后3天hs-CRP水平比较(±s,mg/L)
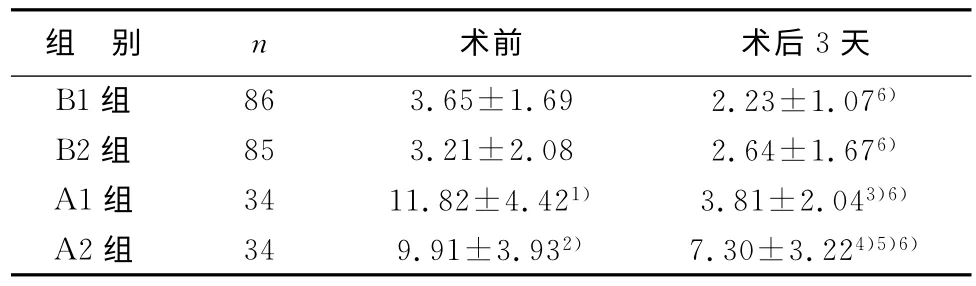
表2 4组患者PCI术前及术后3天hs-CRP水平比较(±s,mg/L)
注:与B1组术前比较,1)P<0.01;与B2组术前比较,2)P<0.01;与B1组术后3天比较,3)P<0.05;与B2组术后3天比较,4)P<0.01;与A1组术后3天比较,5)P<0.01;与同组术前比较,6)P<0.01
2.3 4组患者PCI术前及术后3天IL-6水平比较
术前,A1、A2组IL-6水平分别高于B1、B2组,差异均有统计学意义(P均<0.01),A1、A2组之间及B1、B2组之间差异无统计学意义(P>0.05)。术后3天,A2组IL-6水平高于A1组,B2组IL-6水平高于B1组,差异均有统计学意义(P<0.05或P<0.01);A1组IL-6水平高于B1,A2组IL-6水平高于B2组,差异均有统计学意义(P均<0.01)。术后3天,各组IL-6均较术前降低,差异亦有统计学意义(P<0.05或P<0.01)。见表3。
表3 4组患者PCI术前及术后3天IL-6水平比较(±s,ng/L)

表3 4组患者PCI术前及术后3天IL-6水平比较(±s,ng/L)
注:与B1组术前比较,1)P<0.01;与B2组术前比较,2)P<0.01;与B1组术后3天比较,3)P<0.05,4)P<0.01;与B2组术后3天比较,5)P<0.01;与A1组术后3天比较,6)P<0.01;与同组术前比较,7)P<0.05,8)P<0.01
2.4 4组患者PCI术前及术后3天NGAL水平比较
术前,4组患者NGAL 水平差异无统计学意义(P>0.05);术后3天,A2组NGAL 水平高于A1组,差异有统计学意义(P<0.05);B1、B2组之间NGAL水平差异无统计学意义(P>0.05);术后3天,4组患者NGAL 水平均较术前明显升高,差异均有统计学意义(P均<0.01)。见表4。
表4 4组患者PCI术前及术后3天NGAL水平比较(±s,ng/L)

表4 4组患者PCI术前及术后3天NGAL水平比较(±s,ng/L)
注:与A1组术后3天比较,1)P<0.05;与同组术前比较,2)P<0.01
2.5 4组患者PCI术后CIN 发生情况
术后3天,A2组CIN 发生率高于A1组和B2组,差异均有统计学意义(P均<0.05);其它组间CIN 发生率差异无统计学意义(P>0.05)。见表5。
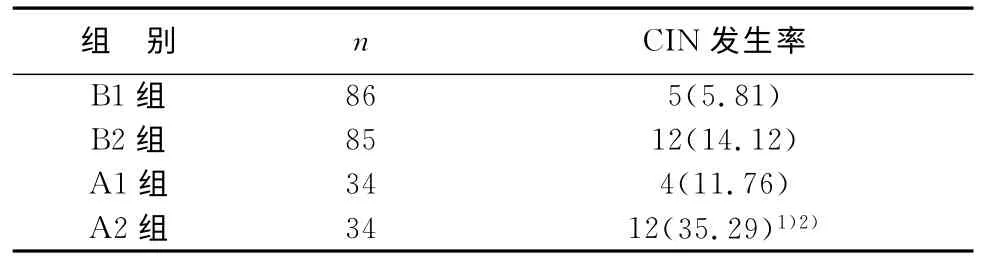
表5 4组患者CIN发生率的比较(n,%)
3 讨论
随着冠脉介入技术的不断开展,CIN 已经成为继支架内血栓和再狭窄之后的又一难题。本课题组前期研究[6]显示,NSTE-ACS患者体内炎症反应是导致CIN 发生的一个因素。他汀类药物除了有调脂作用外,还可以通过减轻肾脏的氧化应激,抑制炎症反应等途径发挥肾保护作用[10,11]。国外一项多中心注册研究[12]对29409例行PCI的冠心病患者的分析显示,术前给予他汀治疗患者发生CIN 的概率较低,并且术后需要透析的患者较少;多元分析显示,应用他汀与CIN 降低相关(OR:0.87;95%CI:0.77~0.99,P=0.03)。他汀类药物对hs-CRP 等炎症因子的抑制作用独立于血脂的变化之外并与剂量相关[13]。
本文按照SIRS诊断标准,将接受PCI治疗的NSTE-ACS患者分为不同的炎症反应群体,并给予不同剂量的阿托伐他汀治疗。结果显示阿托伐他汀可以有效地降低相关炎症因子水平,抑制炎症反应,并在此基础上降低CIN 的发生率。NGAL 是一种在中幼粒细胞和晚幼粒细胞分化阶段合成的小分子分泌蛋白,是一种反映肾小管损伤的特异性标志物[14]。本研究中,各组患者术前NGAL 无统计学差异,提示NGAL的表达与患者体内炎症反应关系不大。术后3天,4组患者NGAL 水平较术前明显升高,这与NGAL 作为肾脏的一种保护蛋白,当肾脏受到造影剂的损害时分泌增加有关。强化他汀治疗组(A1组和B1组)NGAL 升高水平低于常规他汀治疗组(A2组和B2组),与CIN 的发生情况相一致,从另一角度说明了强化阿托伐他汀治疗对PCI围手术期NSTE-ACS患者的肾脏具有保护作用。
综上所述,本文为阿托代他汀抑制炎症反应的药理作用提供了实验依据,并且进一步证实了强化阿托代他汀治疗可降低NSTE-ACS患者PCI术后的炎症反应,减少CIN 的发生。
1 Mehran R,Aymong ED,Nikolsky E,et al.A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention:development and initial validation[J].J Am Coll Cardiol,2004,44(7):1393~1399.
2 Amini M,Salarifar M,Amirbaigloo A,et al.N-acetylcysteine does not prevent contrast-induced nephropathy after cardiac catheterization in patients with diabetes mellitus and chronic kidney disease:a randomized clinical trial[J].Trials,2009,10:45.
3 Mehran R,Brar S,Dangas G.Contrast-induced acute kidney injury Underappreciated or a new marker of cardiovascular mortality[J].J Am Coll Cardiol,2010,55(20):2210~2211.
4 Mehran R,Aymong ED,Nikolsky E,et al.A simple risk score for prediction of contrast-induced nephropathy after percutaneous invention:development and initial validation[J].J Am Coll Cordiol,2004,44(7):1393~1399.
5 Rudnick MR,Gddforb S,Pathogenesis of contrast-induced nephropathy:experimental and clinical observations with an emphasis on the role of osmolality[J].Rev Cardiovasc Med,2003,4(S5):28~33.
6 梁海峰,杨明,韩凌,等.炎症反应对接受PCI治疗的非ST段抬高ACS患者造影剂肾病的影响[J].微循环学杂志,2013,23(1):21~23.
7 Bonetti PO,Lerman LO,Napoli C,et al.Statin effects beyond lipid lowering-are they clinically relevant[J].Eur Heart J,2003,24(3):225~248.
8 2007年中华医学会心血管病学分会.不稳定性心绞痛和非ST段抬高心肌梗死诊断与治疗指南[J].中华心血管病杂志,2007,35(4):295~304.
9 Mc Cullough PA.Contrast-induced acute kidney injury[J].J Am Coll Cardiol,2008,51(15):1419~1428.
10 Dangas G,Iakovou I,Nikolsky E,et al.Contrast-induced nephropathy after percutaneous coronary interventions in relation to chronic kidney disease and hemodynamic variables[J].Am J Cardiol,2005,95(1):13~19.
11 Zhang Wei,Liu Min,Wu Yichao,et al.Protective effects of atorvastatin on chronic allograft nephropathy in rats[J].Journal of Surgical Research,2007,143(2):428~436.
12 Khanal S,Attallan N,Smith DE,et al.Statintherapy reduces contrast-induced nephropathy an analysis of contemporary percutaneous interventions[J].Am J Med,2005,118(8):843~849.
13 Bonnet J,Mcpherson R,Tedgui A,et al.Comparative effects of 10mg versus 80mg atorvastatin on high sensitivity C reactive protein in patients with stable coronary artery disease:results of the CAP(ComParative Atorvastatin Pleiotro Pieeffeets)study[J].ClinTher,2008,30(12):2298~2313.
14 Trof RJ,Di Maggio F,Leemreis J,et al.Biomarkers of acute renal injury and renal failure[J].Shock,2006,26(3):245~253.
