围心脏不停跳体外循环期猪血液流变性变化*
2013-08-29黄海清彭劲松罗玉忠陈燕华涂杰
黄海清 彭劲松 罗玉忠 陈燕华 涂杰
体外循环期间微循环灌注不足是发生体外循环手术后相关并发症的重要原因。血液流变性是影响组织微循环灌注的主要因素,严重影响病情的发展[1]。无血预充血液稀释技术是减少体外循环异体用血量的常用手段,但其用于心脏不停跳体外循环时引起的血液流变性变化以及对机体微循环灌注影响的研究报道较少。本实验对心脏不停跳体外循环期猪的血液流变性变化进行观察,为完善心脏不停跳体外循环合理灌注与管理提供依据。
1 材料与方法
1.1 实验动物
猪龄3~4月、体重20~25Kg的广西本地健康杂种猪10只(广西医科大学实验动物中心提供),雌性6只,雄性4只。术前禁食12h,禁饮6h。
1.2 实验方法
1.2.1 麻醉:臀部肌肉注射氯胺酮8~10mg/Kg诱导麻醉,辅以阿托品0.05mg/Kg 肌肉注射。诱导后将猪仰平卧固定于手术台,面罩吸入纯氧,保留自主呼吸,开放耳缘静脉或肢体外周静脉后,静脉缓慢注入(硫喷妥钠25mg+γ羟丁酸钠50mg)/ml混合液1~1.5ml/Kg加深麻醉,以直式咽喉镜暴露声门,插入气管导管。气管插管成功后静脉注射琥珀酰胆碱0.5~1mg/Kg,自主呼吸消失后用ACOMA麻醉呼吸机以潮气量10~12ml/Kg、呼吸频率13~16次/min行机械通气。以100ml/h速度持续静注琥珀酰胆碱100mg+氯胺酮100mg+0.9%氯化钠溶液196ml混合液维持麻醉及肌肉松弛。用美国惠普HZWLETT PACKARD 多功能监护仪进行监测。右颈内静脉置入中心静脉导管监测中心静脉压(CVP),经股动脉置管连续监测有创动脉压,经鼻道置入温度探头监测鼻咽温度,经肛门置入温度探头监测直肠温度,置入导尿管监测尿量。体外循环期间暂停机械通气,完成实验后终止麻醉。
1.2.2 体外循环:(1)预充方法:以血液稀释后红细胞压积(Hct)20%~24%行无血预充。首次机器以6%中分子羟乙基淀粉140/0.4溶液500(或600)ml+林格液500ml+20%甘露醇溶液3~5ml/Kg+5%碳酸氢钠溶液1~2ml/Kg+肝素钠溶液1.5~2mg/Kg+10%氯化钾1~1.5ml预充。转机中根据情况必要时适当追加5%碳酸氢钠溶液和6%中分子羟乙基淀粉140/0.4溶液。(2)体外循环灌注过程:选用国产膜式氧合器、动脉微栓滤器、插管和管路。取胸骨正中切口开胸,肝素钠静脉注射使激活全血凝固时间(ACT)达360s后作术野血液吸引回收,行升主动脉,上腔及下腔静脉插管并套阻断带。ACT 达560s后经升主动脉灌注,引流上腔及下腔静脉启动体外循环,以Playstan双头滚压泵行平流灌注。转机开始后阻断上腔及下腔静脉,再切开右房及房间隔置入左心吸引管,吸引左心室腔内血液避免左心充盈。以右心吸引管吸回术野血液。始终不阻断升主动脉,持续维持冠脉血供和心跳动。完全心肺转流时流量为90~100ml/Kg/min,血压维持在8.0~11.97kPa(60~90mmHg),以α稳态管理血气,维持酸碱平衡,避免动脉氧分压不足。转机后开始降温,鼻咽温度至37℃时停止降温,维持鼻咽温度在31~36.5℃达30min后开始复温并缝合心脏,直肠温度达37℃后调整停机。所有实验猪均成功建立心脏不停跳体外循环模型[1],并完成实验研究过程,转流时间60~90min,平均(78.3±13.2)min。(3)分组及指标监测方法:转机开始前(T1)、低温维持30min(T2)、复温完成停机前(T3)和停机后20min(T4),先经股动脉采动脉血5ml为动脉血组(A 组),1min后经中心静脉导管采静脉血5ml为静脉血组(V 组)。两组标本均用肝素钠(10IU/ml)抗凝,置于玻璃试管中,3h 内送检。用北京普利生LBY-N6COMPACT 全自动血液流变仪(锥板式)测定低切变率(10s-1)、中切变率(50s-1)及高切变率(150s-1)时全血表观粘度(ηb),仪器自动计算全血还原粘度(ηre),红细胞聚集指数(RAI)、红细胞刚性指数(IR)及红细胞变形指数(TK)。用北京东西仪科技有限公司的WB-A 微量红细胞压积仪检测红细胞压积(Hct)。
1.3 统计学处理
应用SPSS 13.0统计软件包进行统计分析。计量资料以均数±标准差(±s)表示,组间比较用配对资料t检验,组内比较用重复测量资料的方差分析,均以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 组内各时点血流变指标变化
两组内在T2、T3和T4各切变率下的ηb、ηre以及Hct、RAI与T1相比,均明显下降(P<0.05);与T2相比,T4均有显著回升(P<0.05)。IR 和TK 在组内各时点的变化无统计学意义(P>0.05)。见表1。
2.2 组间各时点血流变指标比较
同一时点两组间各指标值差异均无统计学意义(P>0.05),见表1。
表1 围心脏不停跳体外循环期猪的血流变指标检测结果(±s,n=10)
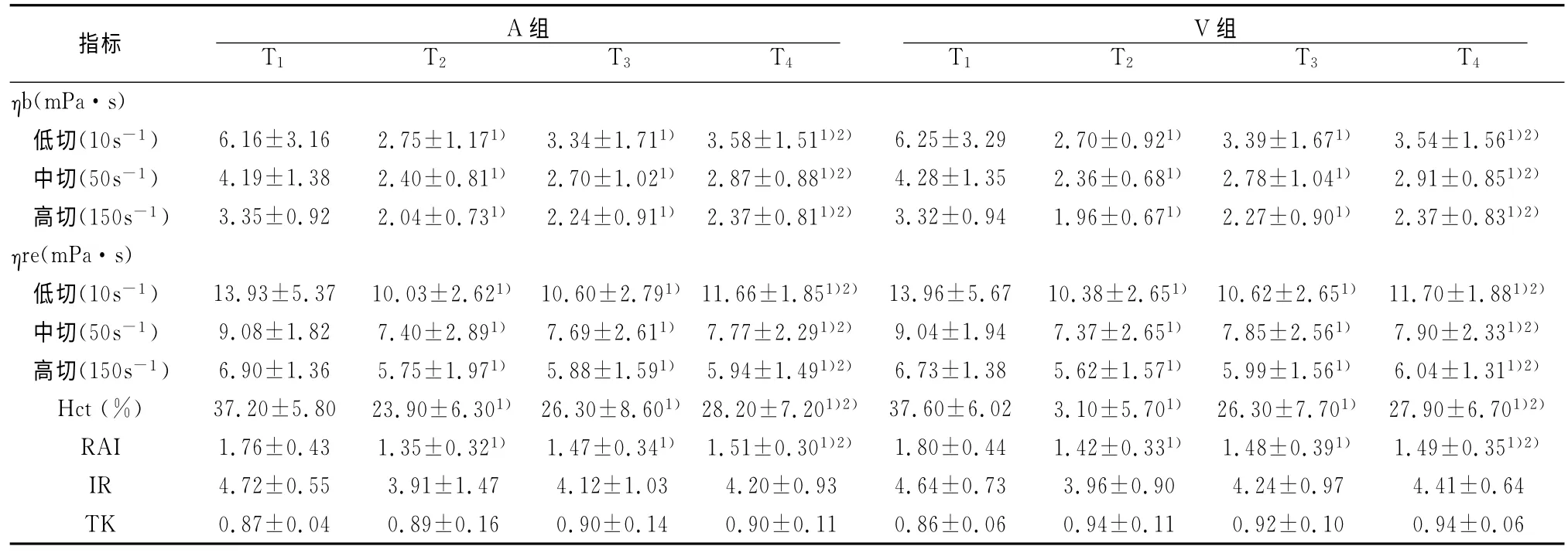
表1 围心脏不停跳体外循环期猪的血流变指标检测结果(±s,n=10)
注:与同组T1比较,1)P<0.05;与同组T2比较,2)P<0.05
3 讨论
在本研究中,无论动脉血还是静脉血,体外循环中及停机后一段时间内,均表现为ηb、ηre和Hct低于转流前水平。其原因与体外循环采用无血预充血液稀释有关,因为无血预充血液稀释,除使转流后血液的Hct明显降低外,还使血浆中高分子物质浓度有所降低,而血液Hct和血浆高分子物质(特别是纤维蛋白原)含量是直接影响血液粘度的重要因素[3]。随着体外循环的进程,炎症介质释放增多,毛细血管通透性也增加,从血管内渗出至组织内水份增加,加上主动利尿使血液有所浓缩,从而使Hct和血液粘度在体外循环后期有所回升。
红细胞聚集性增强,不但引起低切变率血液粘度升高,使血流阻力增大,还可引起临界毛细血管半径增大,导致微循环淤滞及血流速度降低;而微循环血流速度减慢又可能促进红细胞聚集,形成恶性循环[4]。因而降低血液中红细胞聚集性有利于微循环灌注。本研究中,两组标本的RAI在转机中、停机后均降低,提示体外循环期间采用的血液稀释,降低了血液中的红细胞浓度和桥联大分子浓度,较好地维持了血液的酸碱平衡和正常渗透压,从而导致红细胞聚集性降低。
保持红细胞良好变形能力是红细胞通过毛细血管,完成其运输功能的保证[5]。在本研究中,反映红细胞变形能力的IR和TK,在转流期间与转流前变化均无统计学差异,提示本研究所用心脏不停跳体外循环方法对红细胞变形能力并未造成显著的不利影响。这可能与心脏不停跳体外循环时机体未受到强烈温度刺激或血液升降温变化过程较缓和有关[6,7]。
本研究还观察到动脉血和静脉血的血液流变学指标在同一时点均无显著差异,提示一个循环周期内血液流经毛细血管时,介质因素未能对血液流变性产生显著影响,这可能与微循环灌注顺利有关。降低Hct产生的血液低粘状态虽有利于体外循环期间微循环的灌注,但同时引起的血液携氧能力降低是否会对机体带来不利影响,仍需进一步研究。
1 莫安胜,郭亚芬,林辉,等.广西巴马小型猪体外循环建立[J].中国体外循环杂志,2009,7(4):236~237.
2 Urdulashvili TT,Momtselidze NN,Mantskava MM,et al.Hemorheological,microvascular and hemodynamic disorders during coronary heart disease[J].Georgian medical news,2006,136(7):55~57.
3 周凤鑫.组织血液灌注与微循环的病理生理(3)-血液流变性障碍[J].外科理论与实践,2008,13(1):13~20.
4 曾昭炜.微血管内红细胞聚集与临床[J].微循环学杂志,2008,18(31):1~6.
5 Minetti M,Agati L,Malorni W,et al.The microenvironment can shift erythrocytes from a friendly to a harmful behavior:pathogenetic implications for vascular diseases[J].Cardiovasc Res,2007,75(1):21~28.
6 刘玉林,唐显玲,李刚.控制性深低温对家兔血液流变性的影响[J].中国微循环,2007,11(1):30~32.
7 翁庙成,刘方,陶刚,等.环境温度对大鼠血液流变特性的影响[J].医用生物力学,2011,26(5):465~470.
