TLR4/NF-κB在人结肠癌细胞SW620中的表达及CRX-526的抑制作用*
2013-08-29黄宏耀刘方方张秋莹刘国政钱进
黄宏耀 刘方方 张秋莹 刘国政 钱进
众所周知,Toll样受体(Toll-like Receptor,TLRs)是重要的细胞表面受体家族,参与机体对外源性生物的识别和免疫应答,且对肿瘤的发生、浸润和转移发挥关键作用。研究[1,2]表明,TLRs可通过识别病原相关分子模式(Pathogen-Associated Molecular Pattern,PAMPs)及某些内源性配体,引发信号传导而导致炎症介质释放,是天然免疫防御和获得性免疫系统的重要桥梁。TLR4是最早发现的TLRs家族成员之一,表达于多种细胞表面,在固有免疫中发挥着重要作用[3]。TLR4通过识别PAMPs,经过髓样分化蛋白分子(Myeloid Differentiation Factor 88,MyD88)依赖性信号传导分子激活核转录因子-κB(NF-κB)[4],使之与抑制蛋白IκBα(IΚB)解离,进入到细胞核内启动多种基因的转录,使细胞释放大量炎症相关因子,造成组织损害[5]。
结肠癌是最常见的消化道恶性肿瘤之一,死亡率高,且发病率逐年上升。研究结肠癌发生、发展的分子机制及其潜在的治疗靶点和药物,具有重要的意义。因此,本研究利用脂多糖(LPS)刺激人结肠癌SW620细胞,观察TLR4/NF-κB 通路蛋白在受LPS刺激的肿瘤细胞中的表达变化;并通过裸鼠移植瘤试验,探讨TLR4拮抗剂CRX-526对结肠癌的治疗作用。
1 资料与方法
1.1 主要实验材料和试剂
人结肠癌SW620、LPS(E.coli O111:B4)、CRX-526,Trizol Reagent(美国Invitrogen 公司);反转录试剂盒(日本Toyobo公司);荧光染料Power SYBR Green PCR Master Mix(美国ABI公司);NF-κB(p65)抗体(美国Ebioscience公司);Super-Signal ECL kit(美国Pierce公司);蛋白提取试剂盒(中国碧云天生物Beyotime 公司);IL-6、IL-8 ELISA 检测试剂盒(上海研谨生物科技有限公司);实验动物为BALB/c-nu无胸腺裸鼠,购自北京华阜康生物科技股份有限公司,28日龄,雄性。
下述引物均由上海英俊公司合成。
TLR4引物上游序列:5’-AGC CAC CTC TCT ACC TTA ATA TTG A-3’,下游序列:3’-CCG AGT GTT AGA ATA GGT TAG AAA G-5’;NFκB(p65)DH 引物上游序列:5’-AGC CAC CTC TCT ACC TTA ATA TTG A-3’,下游序列:3’-CCG AGT GTT AGA ATA GGT TAG AAA G-5’;GAPDH 18S内参上游引物序列:5’-CCG AGA AGT TTC AGC ACA TCC-3’,下游序列:3’-TGG CAG TGA TAG CGA AGG CT-5’。
1.2 实验方法
1.2.1 细胞培养和处理:培养原代SW620细胞长至80%融合时,用含0.01%EDTA 的0.25%胰酶消化,制备单细胞悬液,调整细胞浓度为2×103/ml,于37℃,5%CO2培养过夜,D-PBS洗涤两次后,LPS刺激组加入含10μg/L LPS 的RPMI 1640培养基,无刺激组加入不含LPS 的RPMI 1640培养基,再培养6h后收获细胞进行后续分析。
1.2.2 Real-time PCR 检测mRNA 表达:将上述两组再培养细胞分别按照Trizol试剂说明书提取TLR4和NF-κB(p65)总RNA,去除基因组DNA,然后根据反转录试剂盒说明书将总RNA 逆转录成cDNA,反转录体系为20μl。PCR 体系中依次加入cDNA 模板、上下游引物各900nmol/L,SYBR Green PCR Master mix 12.5μl至EP管中,补水至总体积25μl。每个检测样本设置3个平行孔,取平均值作为该样本拷贝数值评价其mRNA 表达水平。PCR 程序为:95℃变性5min,94℃、60℃、72℃各20s,45个循环。
1.2.3 Western Blotting 检测TLR4和NF-κB(p65)蛋白表达:按照蛋白提取试剂盒说明书提取1.2.1两组再培养细胞,蛋白变性后行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳电压200V。电泳完毕后进行转膜,制作滤纸-凝胶-膜“三明治”,极恒流300mA 转移70min,于加样槽中加入相应的一抗1ml(1∶300),室温下于摇床孵育,用含吐温20的磷酸缓冲盐水洗涤10min,每个加样槽中加入二抗1ml,室温下于摇床孵育1h,ECL 底物化学发光,暗室曝光5~30s,照相。电泳结果采用Gelpro 3.2凝胶光密度分析软件处理,以样本平均光密度值(IOD)与内参GAPDH 的IOD 值之比表示TLR4和NF-κB(p65)蛋白相对表达量。
1.2.4 ELISA 检测IL-6和IL-8:按照说明书梯度稀释标准品及待测样本的培养上清,37℃温育30min。洗涤液洗涤6次,拍干后加入酶标试剂50μl,37℃温育30min。洗涤液洗涤6次后,每孔分别加入显色剂A 和B 各50μl,轻轻震荡混匀,37℃避光显色15min。每孔加终止液50μl,450nm 波长依序测量各孔吸光度(OD 值),并从标准曲线上获取IL-6和IL-8含量(pg/ml)。
1.2.5 裸鼠成瘤及CRX-526抑制试验:将试验用裸鼠随机分成抑制组和非抑制组,每组20只,均于前肢上段皮下注射LPS刺激培养(1×106个)的SW620细胞。各鼠于SPF级实验室饲养,自由饮食,观察其活动程度及双目是否有神。4周后抑制组用50μg TLR4拮抗剂CRX-526每日对瘤体进行多点注射1次,连续注射5天[6,7]。非抑制组平行注射等量生理盐水,余与抑制组同样处理。4周后两组裸鼠生长良好,无死亡。麻醉处死裸鼠并摘除肿瘤,测量肿瘤体积后切取部分肿瘤组织,匀浆后分成两份,一份按1.2.2方法进行Real-time PCR 检测TLR4和NF-κB(p65)mRNA,另一份按1.2.3方法进行Western Blotting分析TLR4和NF-κB(p65)蛋白表达。
1.3 统计学处理
采用SPSS 12.0统计软件进行统计分析。各组数据用均数±标准差(±s)表示,采用两配对样本t检验和两独立样本t检验进行各组比较,P<0.05为差异具有统计学意义。
2 结果
2.1 LPS 刺激培养SW620细胞的TLR4和NFκB(p65)mRNA 和蛋白表达
结果显示,LPS 刺激组TLR4和NF-κB(p65)mRNA 的拷贝数明显高于无刺激组,差异有统计学意义(P均<0.05);LPS 刺激组TLR4和NF-κB(p65)蛋白相对表达量较无刺激组显著上升,见表1、图1。
2.2 LPS刺激培养SW620细胞的IL-6和IL-8水平
结果显示LPS抑制组IL-6和IL-8水平较无刺激组明显上调,差异有统计学意义(P均<0.05)。见表1。
表1 两组培养SW620细胞TLR4、NF-κB(p65)mRNA拷贝数和IL-6和IL-8表达水平(±s,n均=3)

表1 两组培养SW620细胞TLR4、NF-κB(p65)mRNA拷贝数和IL-6和IL-8表达水平(±s,n均=3)
注:与无刺激组比较,1)P<0.05
2.3 CRX-526对移植瘤生长和TLR4/NF-κB(p65)表达的抑制作用
2.3.1 CRX-526抑制移植瘤生长:裸鼠皮下注射肿瘤细胞后,第3天即可见肿瘤生长,及至第4周末,且边界清淅,挤压可活动。两组各有14只裸鼠成瘤,无鼠死亡,另12只未成瘤。注射CRX-5264周后,抑制组肿瘤体积分别明显小于非抑制组,差异有统计学意义(P<0.05)。见表2、图2。
2.3.2 CRX-526抑制TLR4和NF-κB(p65)mR-NA 和蛋白表达:抑制组TLR4和NF-κB(p65)mRNA 的拷贝数显著低于非抑制组(P均<0.05)。抑制组TLR4和NF-κB(p65)蛋白相对表达量明显低于非抑制组(P<0.05)。见表2、图3。
表2 两组裸鼠肿瘤体积和TLR4、NF-κB(p65)mRNA拷贝数比较(±s,n均=14)

表2 两组裸鼠肿瘤体积和TLR4、NF-κB(p65)mRNA拷贝数比较(±s,n均=14)
注:与非抑制组比较,1)P<0.05

图1 LPS对SW620细胞TLR4、NF-κB(p65)蛋白表达的影响
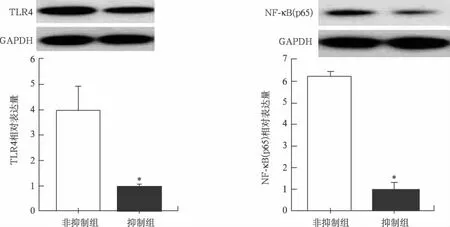
图3 TLR4拮抗剂CRX-526对移植瘤TLR4、NF-κB(p65)表达的影响
[本文图2见封2]
3 讨论
结肠癌是多种因素综合作用的结果,其病因与年龄、饮食、遗传、炎症等有关,特别是慢性结肠炎,其发展为结肠癌的几率较高[8]。TLR4不仅在炎症免疫反应中发挥关键作用,而且很可能与结肠癌的发生、发展密切相关[9]。在笔者的前期工作证实结肠癌组织标本的TLR4、NF-κB 及相关炎症因子的表达高于癌旁正常结肠组织[10,11]。本文进一步观察LPS 刺激培养结肠癌SW620细胞的TLR4和NF-κB(p65)mRNA 和蛋白的表达,并探讨TLR 抑制剂CRX-526对其的抑制作用。
本实验发现,LPS 刺激人结肠癌SW620细胞后,TLR4 mRNA 和蛋白水平均明显上调,NF-κB(p65)表达也明显增加,表明LPS 能激活TLR4/NF-κB信号通路。TLR4/NF-κB 信号通路被激活后,其下游的炎症相关因子IL-6和IL-8的表达水平随之升高,与TLR4、NF-κB(p65)的表达趋势一致,说明LPS刺激结肠癌SW620细胞后,通过激活TLR4/NF-κB信号通路能诱导IL-6和IL-8的表达。与Li等[12]研究表明的IL-6参与溃疡性结肠炎相关的结肠癌的发生,以及Lee等[13]发现肿瘤组织微环境中高表达IL-8及其受体CXCR2可促进结肠癌的发生、发展及转移的结果相同。
为了探讨TLR4是否可以作为结肠癌的治疗新靶点,本文利用SW620结肠癌细胞进行了裸鼠移植瘤试验,并用TLR4拮抗剂CRX-526对移植瘤进行多点注射。结果表明,CRX-526能有效抑制肿瘤生长,同时证实相关分子TLR4、NF-κB(p65)的表达均出现下调。提示TLR4/NF-κB 信号通路是结肠癌生长抑制的重要途径,可作为结肠癌治疗的新靶点,而且TLR4拮抗剂CRX-526对结肠癌具有潜在治疗价值。
总之,本资料对探讨炎症与肿瘤的相互关系以及TLR4/NF-κB信号通路作为结肠癌的治疗靶点获得初步结果,为今后的临床应用研究奠定了基础。
1 Heayat M,Takeda K,Rezaei N.Prophylactic and therapeutic implications of toll-like receptor ligands[J].Med Res Rev,2012,32(2):294~325.
2 Lee CC,Avalos AM,Ploegh HL.Accessory molecules for Tolllike receptors and their function[J].Nat Rev Immunol,2012,12(3):168~179.
3 Perros F,Lambrecht BN,Hammad H.TLR4signalling in pulmonary stromal cells is critical for inflammation and immunity in the airways[J].Respir Res,2011,12(1):125~132.
4 Stoll LL,Denning GM,Weintraub NL.Endotoxin,TLR4signaling and vascular inflammation:potential therapeutic targets in cardiovascular disease[J].Curr Pharm Des,2006,12(32):4229~4245.
5 Gimore TD,Wolenski FS.NF-kappa B:where did it come from and why?[J].Immunol Rev,2012,246(1):14~35.
6 Tone F.Bathen,Kristin.Omega-3fatty acids suppress growth of SW620human colon cancer xenografts in nude mice[J].Anticancer Resarch,2008,28:3717~3724.
7 Fort MM,Mozaffarian A,Stöver AG.A synthetic TLR4antagonist has anti-inflammatory effects in two murine models of inflammatory bowel disease[J].J Immunol,2005,174(10):6416~6123.
8 Li H,Xu H,SUN B.Lipopolysaccharide regulates MMP-9expression through TLR4/NF-κB signaling in human arterial smooth muscle cells[J].Mol Med Report,2012,6(4):774~778.
9 Zhou B,Zhou H,Ling S,et al.Activation of PAR2or/and TLR4promotes SW620cell proliferation and migration via phosphorylation of ERK1/2[J].Oncol Rep,2011,25(2):503~511.
10 黄宏耀,陈巍巍,刘方方,等.TLR4和NF-κB p65表达与结肠癌的关系[J].中华检验医学杂志,2010,33(10):953~957.
11 黄宏耀,陈巍巍,张秋莹,等.结肠癌组织中Toll样受体4基因表达[J].微循环学杂志,2010,20(1):65~66.
12 Li Y,Deuring J,Peppelenbosch MP,et al.IL-6-induced DNMT1activity mediates SOCS3promoter hypermethylation in ulcerative colitis-related colorectal cancer[J].Carcinogenesis,2012,33(10):1189~1196.
13 Lee YS,Choi I,Ning Y,et al.Interleukin-8and its receptor CXCR2in the tumour microenvironment promote colon cancer growth,progression and metastasis[J].Br J Cancer,2012,106(11):1833~1841.
