CGRP减轻高氧诱导的早产鼠肺泡Ⅱ型细胞损伤及对Gli1表达的影响
2013-08-28党红星王少华
党红星,杨 林,王少华,2,方 芳,许 峰*
(1.重庆医科大学附属儿童医院重症医学科儿童发育疾病研究省部共建教育部重点实验室儿科学重庆市重点实验室重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆400014;2.深圳市福田区妇幼保健院儿科,广东深圳518045)
高浓度氧疗是挽救危重新生儿的重要手段,但较长时间吸入高氧容易导致急性肺损伤(hyperoxia aute lung injury,HALI)和支气管肺发育不良(bronchopulmonary dysplasia,BPD)。HALI和 BPD 已成为早产和低体重新生儿致死致残的重要原因[1]。肺泡Ⅱ型上皮细胞(typeⅡalveolar epithelial cell,AECⅡ)具有干细胞样功能,其自我修复对肺泡的形成和分化起重要作用[2]。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是广泛分布于人体各组织的神经肽类递质,能诱导多种细胞的增殖与分化,并参与了胚胎肺发育的进程,对肺泡上皮有一定保护和刺激增殖的作用[3]。Sonic hedgehog(Shh)信号通路与细胞迁移、增殖、分化和凋亡密切相关,也是胚胎期肺脏结构形成和发育过程中至关重要的信号通路[4-5]。本研究通过观察95%O2条件下,CGRP对AECⅡ氧化损伤的影响及Shh信号通路中核转录因子Gli1的表达变化,旨在探讨高氧对AECⅡ的损伤及CGRP的保护作用是否涉及Shh信号通路,以期进一步探索HALI的发生和修复机制。
1 材料与方法
1.1 动物及试剂
SPF级孕19 d SD大鼠[第三军医大学大坪医院实验动物中心,合格证号 SCXK:(渝)2007-0005];胰蛋白酶、胎牛血清(FBS)、DMEM/F12 培养基(Hyclone公司);胶原酶 I、DEPC(Sigma公司);DNA酶I(北京鼎国生物技术有限责任公司);大鼠αCGRP、CGRP 拮抗剂(CGRP8-37)(Anaspec公司);活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、AnnexinV-FITC 凋亡检测试剂盒(南京凯基生物);BCA蛋白定量检测试剂盒(北京百泰克公司);引物探针、RT试剂、SYBR green I、荧光定量PCR试剂(ShineGene公司);RIPA裂解液、PMSF(北京普利莱生物);PVDF膜(Millipore公司)、辣根过氧化物酶(HRP)标记抗兔二抗(武汉博士德公司);Gli1和GAPDH一抗(Abbiotec公司)。
1.2 原代AECⅡ培养
早产大鼠AECⅡ的分离、培养与鉴定参照本研究室的原创方法进行[6]。细胞贴壁生长18 h后接近增殖状态,活性良好,用于实验。
1.3 AECⅡ高氧损伤模型的建立及实验分组
将AECⅡ分为6组:1)空气组;2)空气+CGRP组:培养液中预先加入10-8mol/L的CGRP;3)空气+CGRP及其拮抗剂组:培养液中预先加入CGRP和10-7mol/L的 CGRP8-37;4)高氧组:置于密闭氧仓,通入5%CO2和95%O2的混合气体;5)高氧+CGRP组:培养液中预先加入 CGRP;6)高氧 +CGRP及其拮抗剂组:培养液中加入 CGRP和CGRP8-37,然后按高氧组处理。各组细胞培养24 h后进行后续实验。
1.4 检测指标和方法
1.4.1 细胞凋亡率:细胞培养24 h后,消化并收集各组细胞,以PBS洗涤,缓冲液重悬后,按试剂盒说明书,先后加入Annexin V-FITC和PI,室温下避光孵育15 min,在流式细胞检测仪上测定细胞凋亡率。
1.4.2 细胞内 ROS活性:按试剂盒说明书,以DCFH-DA分子探针重悬细胞,37℃孵育25 min后DMEM洗涤,使用488 nm的激发波长,522 nm的发射波长在流式细胞仪上检测各组荧光强度。
1.4.3 细胞内MDA和SOD活性:将细胞悬液制成匀浆,按试剂盒说明书,分别于波长532 nm和550 nm处在紫外分光光度仪上测定吸光度 (A)值,按照与标准品A值的比值计算细胞MDA和SOD值。
1.4.4 实时荧光定量PCR检测表面活性蛋白(surfactant protein,SPC)mRNA表达:Trizol试剂提取AECⅡ总RNA,测定RNA纯度和浓度。用两步法:第1步反转录,按试剂盒说明书利用随即引物将mRNA反转录合成cDNA,反应条件:25℃ 10 min,42℃ 60 min,85℃ 5 min。第2步real-time PCR反应:以SPC和β-actin为引物(表1),在实时荧光定量PCR仪上进行。反应条件:94℃ 4 min;94℃20 s,60℃ 30 s,72℃ 30 s;循环35次。每个样本重复6次,记录观察扩增曲线和溶解曲线,确定各扩增产物为特异性目的基因,在曲线上读出CT值,以β-actin为内参照,用 2-ΔΔCT法计算 SPC mRNA 的相对表达量。

表1 PCR引物序列和扩增片段Table 1 The oligonucleotide primers and amplified product of PCR
1.4.5 Western blot检测Gli1蛋白:收集各组细胞,用RIPA裂解液和PMSF提取总蛋白,BCA蛋白定量试剂盒测定总蛋白浓度。每个样品取50 μg总蛋白,以10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳,0.8 mA/cm2条件半干电转移2 h至PVDF膜,封闭洗膜后再加入1∶100稀释的兔抗Gli1和GAPDH一抗,4℃孵育过夜后洗去一抗,以1∶3 000稀释的HRP标记的抗兔二抗37℃孵育2 h,洗膜后ECL化学发光法胶片曝光扫描。确定特异性条带后用Quantity One 4.6软件进行半定量分析,以GAPDH为内参,目的条带与内参条带的积分吸光度(AU)比值为最终结果。
1.5 统计学分析
2 结果
2.1 细胞形态学改变
倒置显微镜下观察,AECⅡ在空气各组状态类似,生长活跃,岛状分布,细胞贴壁伸展,细胞间连接紧密,呈多角形、椭圆形或立方形,胞质丰富,透亮度高,板层小体清晰可见;高氧组细胞数量显著减少,分布稀疏,停止生长,板层小体基本消失,部分细胞收缩,细胞间隙变大,脱壁细胞较多;CGRP处理后活细胞数量较高氧组明显增加,细胞形态接近空气组,板层小体可见;CGRP拮抗剂组AECⅡ形态学改变较高氧组严重,活细胞数量显著减少,空泡变性明显,细胞脱壁较严重,板层小体明显减少或消失。
2.2 CGRP对高氧诱导下AECⅡ凋亡的影响
高氧组AECⅡ凋亡率显著增加,是空气对照组的3.6倍(P<0.05);但经CGRP处理后凋亡率明显下降(P<0.05);而使用CGRP拮抗剂后凋亡率又较CGRP处理组增加(P<0.05)(图1,表2)。
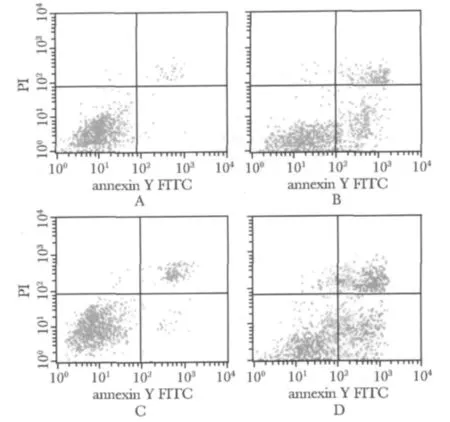
图1 流式细胞术检测AECⅡ凋亡Fig 1 Apoptosis of the alveolar epithelial cells typeⅡdetected by flow cytometry
表2 高氧诱导及CGRP干预对AECⅡ凋亡及氧化损伤的影响Table 2 Effect of hyperoxia and CGRP on apoptosis and oxidative stress injury in the alveolar epithelial cells typeⅡ(,n=6)
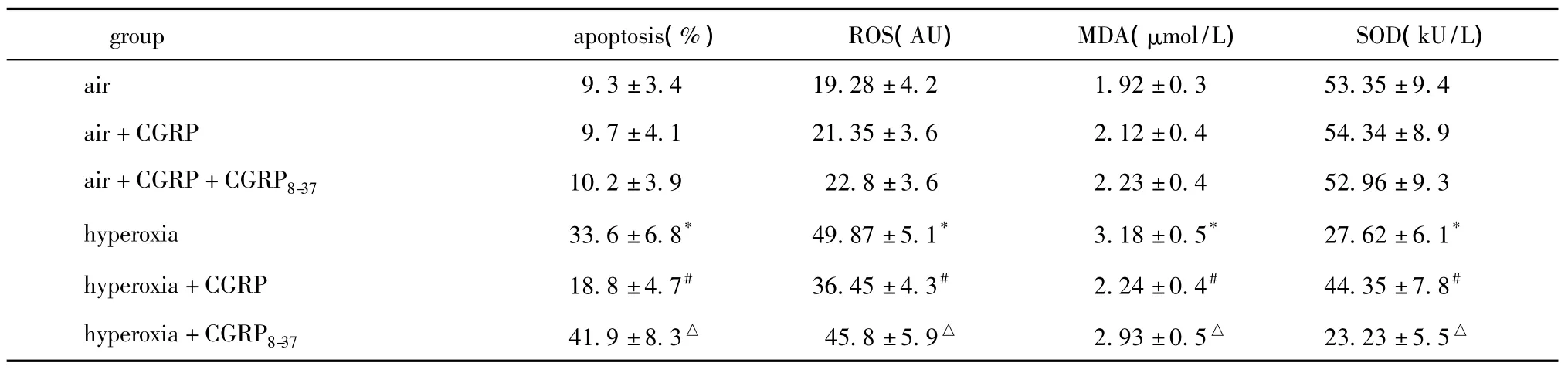
表2 高氧诱导及CGRP干预对AECⅡ凋亡及氧化损伤的影响Table 2 Effect of hyperoxia and CGRP on apoptosis and oxidative stress injury in the alveolar epithelial cells typeⅡ(,n=6)
*P<0.05 compared with air group;#P <0.05 compared with hyperoxia group;△P <0.05 compared with hyperoxia+CGRP group.
group apoptosis(%) ROS(AU) MDA(μmol/L) SOD(kU/L)air 9.3±3.4 19.28±4.2 1.92±0.3 53.35±9.4 air+CGRP 9.7±4.1 21.35±3.6 2.12±0.4 54.34±8.9 air+CGRP+CGRP8-37 10.2±3.9 22.8±3.6 2.23±0.4 52.96±9.3 hyperoxia 33.6±6.8* 49.87±5.1* 3.18±0.5* 27.62±6.1*hyperoxia+CGRP 18.8±4.7# 36.45±4.3# 2.24±0.4# 44.35±7.8#hyperoxia+CGRP8-37 41.9±8.3△ 45.8±5.9△ 2.93±0.5△ 23.23±5.5△
2.3 CGRP对高氧诱导下AECⅡ内ROS、MDA和SOD的影响
高氧组细胞内ROS水平较空气对照组增加约1.5倍(P<0.05),MDA增加近65%(P<0.05),SOD活性降低近一半(P<0.05);CGRP处理后ROS和MDA显著下降(P<0.05),SOD活性明显上升(P<0.05);而使用CGRP拮抗剂后,ROS水平和MDA活性较CGRP处理组显著升高(P<0.05),SOD则显著下降(P<0.05),甚至低于高氧组水平(表2)。
2.4 CGRP对高氧诱导下AECⅡSPC mRNA表达的影响
空气条件下的3组细胞的SPC mRNA表达水平无明显改变。与空气组比较,高氧诱导后细胞SPC mRNA表达水平降低近2/3(P<0.05);经CGRP处理后SPC mRNA表达水平显著升高(P<0.05);而CGRP拮抗剂干预后其表达水平又降低近1/2(P<0.05)(表3)。
2.5 CGRP对高氧诱导下AECⅡ Gli1蛋白表达的影响
空气条件下3组AECⅡ的Gli1蛋白表达水平无明显差异。高氧诱导下,Gli1蛋白表达下降近3/4(P<0.05);而CGRP处理后Gli1蛋白表达升高近1倍(P<0.05);但使用 CGRP拮抗剂干预后,与CGRP组比较,Gli1蛋白表达水平显著下降(P<0.05),并远低于高氧组水平(图2,表3)。
3 讨论
早期HALI发生的主要原因是肺泡上皮和毛细血管内皮细胞的氧化应激反应,并引起呼吸膜破坏和炎性细胞浸润,继之出现肺泡异常修复和肺间质非特异性增生,即BPD的发生[7]。肺泡上皮结构和功能的修复完全依赖于AECⅡ,它在逆转肺纤维化过程中起关键作用,AECⅡ的功能状态直接决定肺损伤后的转归[8]。目前尽管HALI发生的精确机制仍不十分清楚,但过度的氧化应激被认为是其中心环节,氧自由基和炎性反应可通过各种途径导致AECⅡ损伤和过度凋亡[9-10]。本研究证实了95%O2可使AECⅡ氧化抗氧化系统失衡,并导致严重的细胞损伤和功能失调。
表3 高氧诱导及CGRP干预对AECⅡSPC mRNA及Gli1蛋白表达的影响Table 3 The effect of hyperoxia and CGRP on expressions of SPC mRAN and Gli1 protien in the alveolar epithelial cells typeⅡ(,×10-3,n=6)
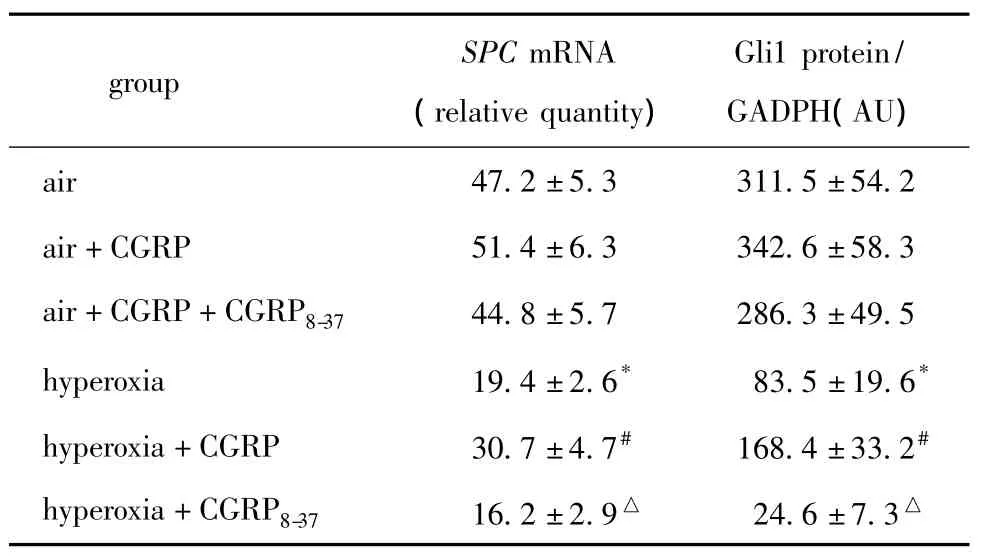
表3 高氧诱导及CGRP干预对AECⅡSPC mRNA及Gli1蛋白表达的影响Table 3 The effect of hyperoxia and CGRP on expressions of SPC mRAN and Gli1 protien in the alveolar epithelial cells typeⅡ(,×10-3,n=6)
*P<0.05 compared with air group;#P <0.05 compared with hyperoxia group;△P <0.05 compared with hyperoxia+CGRP group.
group SPC mRNA(relative quantity)Gli1 protein/GADPH(AU)air 47.2±5.3 311.5±54.2 air+CGRP 51.4±6.3 342.6±58.3 air+CGRP+CGRP8-37 44.8±5.7 286.3±49.5 hyperoxia 19.4±2.6* 83.5±19.6*hyperoxia+CGRP 30.7±4.7# 168.4±33.2#hyperoxia+CGRP8-37 16.2±2.9△ 24.6±7.3△
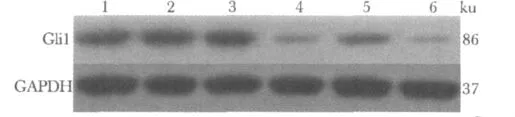
图2 各组AECⅡGli1蛋白质免疫印迹Fig 1 Western blot to test Gli1 protein
CGRP是一种含37个氨基酸残基的神经肽。最初发现其主要作用是使微血管扩张,正因为如此,CGRP长期被认为是炎性反应的诱发因子。然而近年来研究发现CGRP在保护肌肉、肾脏、胃黏膜、胰岛B细胞和肝细胞等免受ROS引起的氧化损害中起着重要的作用[11-12]。在肺脏,肺神经内分泌细胞分泌CGRP对支气管创伤的修复起着重要作用,而在炎性反应和氧化应激条件下,AECⅡ本身也可产生和分泌CGRP,且具有免疫调节,支气管保护,促进上皮和内皮增殖的作用,并与很多呼吸系统疾病相关[3,13]。本研究发现,CGRP 对 95%O2处理的AECⅡ可通过抑制ROS水平、调节氧化抗氧化酶活性缓解氧化应激导致的细胞凋亡和损害,并促进细胞增殖,部分恢复SPC表达的能力。
Shh信号通路是调节器官发育和细胞增殖的重要信号通路,该信号通路紊乱可导致器官发育障碍或肿瘤发生[5]。Glil是Shh信号通路最重要的多功能核转录因子,在绝大多数情况下对Shh信号通路起正调节作用,可将Shh信号传导至核内靶基因,并起到转录激活的关键作用[14]。已知在正常发育肺的肺泡上皮细胞有Shh信号的激活[15],本研究发现高氧能抑制AECⅡ的Gli1活性,CGRP在高氧条件下则具有保护或促进Gli1信号分子表达的作用,但使用CGRP拮抗剂后,该保护或促进作用明显减弱,而且这种改变与同条件下细胞氧化损害程度,氧化和抗氧化酶活性及SPC表达的改变大致同步。说明Gli可能与高氧诱导的AECⅡ损伤修复及细胞功能状态密切相关,提示在HALI和BPD发生发展过程中有Shh信号通路的改变,CGRP可能直接或间接参与了对Shh信号通路的调控。本研究提示的Shh信号通路中Gli1分子的变化可能为HALI和BPD的防治提示了新的研究靶点。然而由于细胞的信号网络是及其复杂的系统,多条信号通路和多种信号分子交互作用,Shh信号通路在氧化损害中的角色以及与CGRP的定位关系目前尚不清楚,进一步研究将使用RNA干扰技术和基因敲除动物进行更深入的探索。
[1] Gien J,Kinsella JP.Pathogenesis and treatment of bronchopulmonary dysplasia [J].Curr Opini Pediatri,2011,23:305-313.
[2]Ghadiali S,Huang Y.Role of airway recruitment and derecruitment in lung injury[J].Crit Rev Biomed Eng,2011,39:297-317.
[3]Kawanami Y,Morimoto Y,Kim H,et al.Calcitonin generelated peptide stimulates proliferation of alveolar epithelial cells[J].Respir Res,2009,10:18.
[4]Jacob L,Lum L.Deconstructing the hedgehog pathway in development and disease[J].Science(New York,NY),2007,318:66-68.
[5]Watson S,Serrate C,Vignot S.Sonic Hedgehog signaling pathway:from embryology to molecular targeted therapies[J].Bull du Cancer,2010,97:1477 -1483.
[6]付红敏,许峰,黄波,等.胎鼠肺泡Ⅱ型上皮细胞的分离及原代培养[J].重庆医科大学学报,2009,34:586-589.
[7]Bhandari V.Hyperoxia-derived lung damage in preterm infants[J].Seminars in Fetal& Neonatal Medicine,2010,15:223-229.
[8]Miyake Y,Kaise H,Isono K,et al.Protective role of macrophages in noninflammatory lung injury caused by selective ablation of alveolar epithelial typeⅡ Cells[J].J Immunol(Baltimore,Md:1950),2007,178:5001-5009.
[9]Ao X,Fang F,Xu F.Role of vasoactive intestinal peptide in hyperoxia-induced injury of primary typeⅡalveolar epithelial cells[J].Indian J Pediatri,2011,78:535 -539.
[10]Huang B,Fu H,Yang M,et al.Neuropeptide substance P attenuates hyperoxia-induced oxidative stress injury in typeⅡalveolar epithelial cells via suppressing the activation of JNK pathway[J].Lung,2009,187:421 -426.
[11]Feng G,Wang Q,Xu X,et al.The protective effects of calcitonin gene-related peptide on gastric mucosa injury of gastric ischemia reperfusion in rats[J].Immunopharmacol Immunotoxicol,2011,33:84 -89.
[12]Song S,Liu N,Liu W,et al.The effect of pretreatment with calcitonin gene-related peptide on attenuation of liver ischemia and reperfusion injury due to oxygen free radicals and apoptosis[J].Hepato Gastroenterol,2009,56:1724-1729.
[13]高坤祥,王云杰,张志培,等.大鼠支气管重建后肺神经内分泌细胞数量及分布的改变[J].基础医学与临床,2009,29:242-246.
[14]Ruiz IAA.Hedgehog signaling and the gli code in stem cells,cancer,and metastases[J].Sci Signaling,2011,4:pt9.DOI:10.1126/scisignal.2002540.
[15]Zhang M,Wang H,Teng H,et al.Expression of SHH signaling pathway components in the developing human lung[J].Histochemi Cell Biol,2010,134:327-335.
