溶血磷脂酸调控RhoA/ROCK2信号通路对乳腺癌细胞增殖的影响
2013-08-28段刚峰
许 海,段刚峰
(1.湖北中医药大学黄家湖医院妇科,湖北武汉430065;2.武汉市第一医院,湖北武汉430022)
乳腺癌是女性最常见的恶性肿瘤之一,其发病率在西方国家稳居女性恶性肿瘤之首,在我国近年来也呈逐年上升趋势,严重威胁着女性的健康和生命。Rho家族蛋白及其下游重要的信号靶蛋白Rho激酶2(Rho-associated kinase,ROCK2)与肿瘤发生发展的各个方面均有联系,包括肿瘤的生长和增殖、侵袭和转移细胞凋亡等,是肿瘤发生发展的重要指标[1]。RhoA/ROCK2信号通路已证实参与了乳腺癌的发生[2]。近年来研究发现,溶血磷脂酸(lysophosphatidic acid,LPA)是结构最简单的磷脂,作为细胞间信号分子,也与肿瘤发生发展密切相关[3],但二者之间的关系对乳腺癌细胞的增殖鲜有报道。本研究试图阐述溶血磷脂酸(lysophosphatidic acid,LPA)、RhoA/ROCK2信号通路对乳腺癌细胞增殖的影响及其作用机制,以期为乳腺癌的临床治疗提供新的研究方向。
1 材料与方法
1.1 材料
乳腺癌细胞系MDA-MB-231细胞 (上海富众生物科技发展有限公司);兔抗 RhoA单克隆抗体及羊抗人Rock2(C-20)多克隆抗体 (CST公司);RhoA活性检测试剂盒 (Cytoskeleton公司);ROCK特异性抑制剂Y-27632(杭州联科生物技术有限公司);牛血清白蛋白 (BSA)(Sigma公司);L-15培养基、1640培养液、新生牛血清 (武汉子心生物科技有限公司)。
1.2 方法
1.2.1 细胞培养:MDA-MB-435细胞复苏后将其接种于L-15培养基(含10%新生牛血清、100 U/mL青霉素和100 U/mL链霉素)中,并于37℃、5%CO2条件下培养。然后接种于6孔板中,细胞1×105个/孔,同样条件继续培养。
1.2.2 细胞增殖能力实验:1)LPA对癌细胞的增殖作用:取对数生长期的细胞制成单细胞悬液接种于24孔培养板中,细胞1×104个/孔,PBS冲洗,分别加入浓度为 1、5、20 和50 μmol/L的 LPA(含无血清的1640培养液),连续4 d于24、48、72和96 h收集细胞进行计数1次,并绘制细胞生长曲线图。2)Y-27632对LPA促增殖活性的影响:将上述培养后单细胞悬液随机分为对照组、观察组及抑制组。①对照组:在37℃、5%CO2条件下,以10%新生牛血清的L-15培养基培养。②观察组:选择最佳促增殖浓度50 μmol/L LPA+10%新生牛血清的L-15培养基培养。③50 μmol/L LPA+10%新生牛血清的L-15培养基 +10 μmol/L Y-27632培养,处理24 h后,静置30 min后进行细胞计数并绘制细胞生长曲线图。3)RhoA活性测定 离心收集上述细胞,重悬于50 mL的低盐结合缓冲液中,超声裂解,10 000×g离心10 min,取上清,LSAB洗3次后,置于4℃缓慢摇动2 h并保存;取细胞悬液30 μL加入500 μL低盐结合缓冲液中,4℃缓慢摇动1 h,清洗弃上清,以Pull-down法检测各组细胞内RhoA活性,具体操作步骤依照Cytoskeleton提供的RhoA活性测定试剂盒说明书进行。Western blot检测RhoA-GTP的表达,RhoA-GTP/总RhoA代表 RhoA活性。4)Western blot检测RhoA、ROCK2蛋白表达用RIPA缓冲液200 μL裂解上述细胞,考马斯亮蓝法进行蛋白定量,常规电泳、转印和封闭后,分别加入RhoA单克隆抗体及Rock2(C-20)多克隆抗体,4℃过夜,加入生物素标记的二抗(1∶5 000),室温下反应2 h。反应结束后取5 μL产物用1.5%琼脂糖凝胶(内含EB)电泳,成像系统照像,吸光度比值以均数±标准差±s)表示。
1.3 统计学分析
采用SPSS14.0统计软件处理所有数据,计数资料用均数±标准差±s)表示,两样本均数比较采用t检验。
2 结果
2.1 LPA对MDA-MB-435细胞增殖的影响
LPA可以显著促进乳腺癌细胞的增殖,并呈时间与剂量依赖性关系(P<0.05),但LPA浓度为20 μmol/L与50 μmol/L对细胞的增殖无显著差异(图1)。
2.2 ROCK 抑制剂Y-27632对LPA促增殖活性的影响
LPA可以显著促进癌细胞的增殖(P<0.05),ROCK抑制剂Y-27632可以显著抑制LPA对癌细胞的增殖活性(P<0.05)(图2)。
2.3 各组细胞内RhoA活性比较
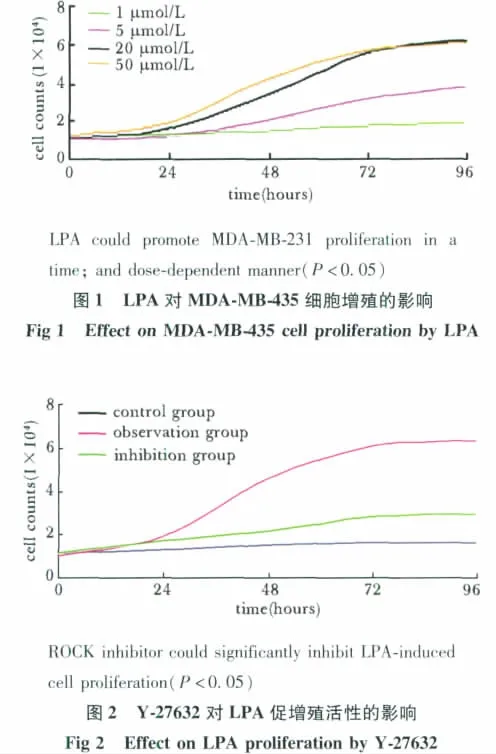
经LPA干预后,观察组RhoA活性较对照组显著增强(P<0.01);给予ROCK抑制剂后,抑制组RhoA活性较观察组显著降低(P<0.05),但仍略高于对照组(P<0.05)(图3)。
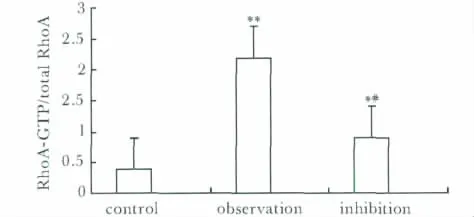
图3 各组细胞内RhoA活性比较Fig 3 RhoA activity of each group
2.4 各组细胞内RhoA、ROCK2蛋白表达
观察组的RhoA、ROCK2蛋白表达较对照组显著增强(P<0.05);抑制组RhoA、ROCK2蛋白表达较观察组显著降低(P<0.05),但仍略高于对照组(P <0.05)(图4,表1)。
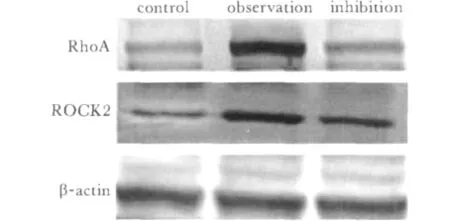
图4 RhoA、ROCK2蛋白表达电泳图Fig 4 Electrophoresis map of RhoA and ROCK2 protein expression

表1 各组细胞内RhoA、ROCK2蛋白表达比较Table 1 Comparison of RhoA and ROCK2 expression
3 讨论
肿瘤细胞的转移是肿瘤恶性程度的关键指标之一,细胞的黏附行为及细胞表面的蛋白水解酶活性直接决定着肿瘤细胞的转移特征[4]。近年来,随着分子生物学的迅速发展,人们对于乳腺癌的发生发展机制,特别是对乳癌细胞生长、增殖、侵袭和转移相关的分子信号传导机制的研究有了突破性的进展,由此开展的生物治疗在该病的治疗中也取得了令人瞩目的成绩。
LPA是一种对多种细胞具有不同生物学活性的磷脂介质,在组织中广泛存在,临床研究发现,LPA具有促进细胞增殖、迁移和耐药等生物学效应,其存在大大加剧了卵巢癌、子宫癌、及乳腺癌等妇科癌症的恶性化程度[5]。另外,LPA还能够通过刺激 Akt磷酸化、激活 NF-κB抑制肿瘤细胞的凋亡[6]。LPA可能通过Rho/Rock信号通路而上调宫颈癌HeLa细胞的迁移和黏附[7]。
越来越多的证据表明,Rho/Rock信号通路在肿瘤细胞增殖中发挥作用[8]。RhoA是 Rho/Rock信号传导通路的关键信号分子,它通过激活其下游靶分子-Rock,在细胞的形态发生,细胞极性,细胞迁移等多个方面发挥了重要的作用,并调节细胞的多种行为与功能,包括收缩、游走、黏附、生长分裂以及肿瘤细胞的转化与浸润等,参与了多种疾病的发生发展,是近年的研究热点之一[9]。研究表明,RhoA作为一种癌基因,在许多肿瘤中都高表达[10]。有资料显示,Rho蛋白家族与乳腺癌的发生有相关性,RhoA分子在乳腺癌中表达增高,并且与乳腺癌的恶性表型相关[11]。
本研究中表1显示,随着LPA浓度的增加、时间的增加,人乳腺癌细胞MDA-MB-231的增殖也随之增加,说明,LPA以剂量依赖性、时间依赖性的方式显著促进MDA-MB-231细胞的增殖,但LPA浓度为20 μmol/L与50 μmol/L对细胞的增殖无显著差异。表2显示,当使用ROCK抑制剂Y-27632后,抑制组MDA-MB-231的增殖显著低于观察组,提示ROCK抑制剂Y-27632可以显著抑制LPA对乳腺癌细胞MDA-MB-231的增殖。由于LPA是第一个被发现能通过跨膜的G蛋白偶联受体 (gprotein2coupled receptors,GPCRs)的 Gα亚单位激活RhoA的物质,RhoA通过效应物ROCK促进细胞产生收缩力以促进细胞增殖[12],同时说明 LPA可能是通过Rho/Rock信号通路促进乳腺癌细胞的增殖。另外,从图3我们可以看出,经LPA干预后,观察组RhoA活性显著强于对照组;当给予ROCK抑制剂后,抑制组RhoA活性则显著低于观察组。图4则说明观察组由于LPA的刺激,其RhoA、ROCK2蛋白表达较对照组显著增强;抑制组由于抑制剂Y-27632的干预,RhoA、ROCK2蛋白表达较观察组显著降低。结果提示,LPA在促进癌细胞的增殖的同时,也增强了RhoA的活性,上调了RhoA、ROCK2的蛋白表达,由此推测,LPA与RhoA/ROCK2信号通路都参与了乳腺癌细胞的增殖,与文献报道一致;LPA可能通过Rho/Rock信号传导通路促进了乳腺癌细胞的增殖。
综上所述,LPA可能通过调控RhoA/ROCK2信号通路促进乳腺癌细胞的增殖,为乳腺癌的临床治疗提供了新思路。
[1]Chang CJ,Chao CH,Xia W,et al.p53 regulates epithelial-mesenchymal transition and stem cell properties through modulating miRNAs[J].Nat Cell Biol,2011,13:317 -323.
[2] Bourguignon LY,Wong G,Earle C,et al.Hyaluronan-CD44 interaction promotes c-Src-mediated twist signaling,MicroRNA-10b expression and RhoA/RhoC upregulation leading to Rho-kinaseassociatedcytoskeleton activation and breast tumor cell invasion [J].J Biol Chem,2010,285:36721-36735.
[3]郭燕红,张雷,邵素霞,等.雌、孕激素对LPA3在小鼠子宫内膜围着床期表达的影响[J].基础医学与临床,2009,29:179 -182.
[4]赵威,韩海勃,林仲翔,等.转移相关分子链Actin-CD44-MMP-2在乳腺癌转移实验中的改变[J].基础医学与临床,2011,31:226-230.
[5]刘玉萍,王颖钰,钱文慧,等.溶血磷脂酸(LPA)对肿瘤转移的作用研究[J].中国药理学通报,2011,27:1044-1047.
[6]Saunders J A,Rogers L C,Klomsiri C,et al.Reactive oxygenspecies mediate lysophosphatidic acid induced signaling in ovarian cancer cells[J].Free Radic Biol Med,2010,49(12):2058-2067.
[7]孙红,朱青,任娟,等.溶血磷脂酸对宫颈癌细胞增殖、黏附、迁移和凋亡的影响[J].细胞与分子免疫学杂志,2009,25:702 -705.
[8]Zhang S,Tang Q,Xu F,et al.RhoA regulates G1-S progression of gastric cancer cells by modulation of multiple INK4 family tumorsuppressors[J].Mol Cancer Res,2009,7:570-580.
[9]Auer M,Hausott B,Klimaschewski L.Rho GTPases as regulators of morphological neuroplasticity[J].Annals of Anatomy,2011,193:259 -266.
[10]Ertel A,Dean JL,Rui H,et al.RB-pathway disruption in breast cancer:differential association with disease subtypes,disease-specific prognosis and therapeutic response[J].Cell Cycle,2010,9:4153 -4163.
[11]Grise F,Bidaud A,Moreau V.Rho GTPases in hepatocellular carcinoma[J].Biochim Biophys Acta,2009,1795:137-151.
[12]DM Pirone,Liu WF,Ruiz SA,et al.An inhibitory role for FAK in regulating proliferation:a link between limited adhesion and RhoA-ROCK signaling[J].Cell Biol,2006,174:277-288.
