噻托溴铵抑制瘦素促大鼠气道平滑肌细胞的增殖
2013-08-28朱述阳郑玉龙刘文静陈云峰倪文静
吴 瑕,朱述阳*,郑玉龙,刘文静,陈云峰,倪文静,赵 玲
(1.徐州医学院附属医院呼吸内科,江苏徐州221002;2.徐州医学院附属淮安第二人民医院呼吸内科,江苏淮安223001)
气道重塑是难治性哮喘的重要病理基础之一,其中气道平滑肌细胞(airway smooth muscle cells,ASMCs)过度增殖是气道重塑的重要环节[1]。难治性哮喘患者多伴有肥胖及高水平的瘦素[2]。瘦素(leptin)是由脂肪组织分泌的蛋白质,与其受体(OB-R)在哮喘发病机制具有重要作用。本研究前期实验表明,大鼠ASMCs表面有瘦素受体表达,瘦素能够促进体外培养的大鼠ASMCs增殖,提示瘦素及其受体参与了哮喘的气道重塑进程[3]。
噻托溴铵(tiotropium)是一种新型长效抗胆碱类药物,其扩张支气管作用持久,对于重症哮喘特别是难治性哮喘具有较好的临床疗效。近年研究发现,除了持久的支气管扩张作用以外,噻托溴铵还可以抑制气道重塑,但具体机制尚不明确[4-5]。本研究用体外培养的大鼠ASMCs,观察噻托溴铵对瘦素刺激后产生的促大鼠ASMCs增殖作用及可能机制。
1 材料与方法
1.1 材料
清洁级6~7周龄雌性SD大鼠,体质量150~200 g[徐州医学院实验动物中心提供,许可证号:SCXK(苏)2010-0003];瘦素(Alexis公司);噻托溴铵(Boehringer Ingelheim公司);兔抗大鼠瘦素受体抗体(武汉博士德公司);CCK-8法检测试剂盒(南京凯基公司);Trnzol总 RNA提取试剂盒、TIANScript cDNA第一链合成试剂盒及real time-RT-PCR两步法检测试剂盒(北京天根公司)。
1.2 方法
1.2.1 大鼠ASMCs培养及鉴定:按文献 [3]常规培养大鼠ASMCs。实验选用第4~6代细胞。培养的ASMC经形态学和α平滑肌肌动蛋白 (smooth muscle α-actin,SM-α-actin) 免疫组织化 学 方 法鉴定。
1.2.2 ASMCs增殖的 CCK-8测定:取第 5代ASMCs,随机分为:对照组,每孔加DMEM;瘦素干预组,每孔加瘦素(100 μg/L),再分别加入 15、30、60及120 μg/L的噻托溴铵。每组设置6个复孔。按文献方法[3]培养细胞后,每孔加 CCK-8 10 μL培养2 h,在波长450 nm处测各孔的吸光度(A)值。
1.2.3 瘦素受体mRNA表达测定:荧光实时定量RT-PCR法:上述各组干预24 h后收集 ASMCs,Trnzol法提取总RNA,紫外分光光度法测 RNA浓度。扩增瘦素受体基因引物序列:上游:5'-CAGATT CGATATGGCTTAAATGG-3',下游:5'-GTTAAAATTC ACAAGGGAGGCA-3',扩增产物长度474 bp。扩增内参照β-actin基因引物序列:上游:5'-CGTAAAG ACCTCTATGCCAA-3',下游:5'-AGCCATGCCAAATG TGTCAT-3',扩增产物长度为473 bp。PCR扩增条件为:94℃ 2 min,94℃ 45 s,72℃ 90 s,共进行40个循环。Ct值表示每个反应管内荧光信号达到设定阈值时所经历的循环数,每个模板Ct值与该模板起始拷贝数的对数呈线性关系,起始拷贝数越多,Ct值越小。采用相对定量方式表示各组瘦素受体mRNA表达,以每个样本目的基因Ct平均值减去内参Ct平均值,对应为每个样本的Ct值(△Ct)。
1.2.4 瘦素受体蛋白表达的测定:Western blot检测,上述各组干预24 h后提取细胞蛋白。依次经配胶、加样、电泳、电转及封闭后,加入兔抗大鼠瘦素抗体过夜,洗膜后,加入二抗 (小鼠抗兔IgG)孵育2 h,以NBT/BCIP显色后用image J软件分析条带吸光度值,以目的蛋白/内参照吸光度比值的均数±标准差±s)来表示各组蛋白表达,实验重复3次。
1.3 统计学分析
2 结果
2.1 ASMC鉴定结果
倒置显微镜下,培养的ASMCs呈梭形,平行生长,束状排列,密集与稀疏处相互交错呈峰谷状。免疫荧光染色法表明,抗平滑肌α-actin抗体呈阳性染色者,胞质内可见大量的绿色荧光,证实所培养细胞为 ASMCs(图1)。

图1 ASMCs的鉴定Fig 1 Identification of airway smooth muscle cells
2.2 噻托溴铵对瘦素促ASMCs增殖的影响
各组干预24 h后测ASMCs增殖,瘦素组较对照组A值明显升高(P<0.05)。随着噻托溴铵浓度增高,其各浓度组A值渐下降,与其浓度呈负相关(P<0.01)(表1)。
表1 ASMCs的增殖Table 1 ASMCs proliferation of different group± s,n=6)

表1 ASMCs的增殖Table 1 ASMCs proliferation of different group± s,n=6)
*P<0.05 compared with control group;#P<0.05 compared with leptin group.
group avalue control 0.967±0.005 leptin(100 μg/L) 1.065 ±0.003*tiotropium(15 μg/L) 1.061 ±0.002*30 1.053±0.003*60 1.034±0.004*#120 1.030±0.002*#
2.3 ASMCs中瘦素受体蛋白表达
与对照组相比,瘦素组瘦素受体蛋白表达显著增高(P<0.05)。随着噻托溴铵浓度增高,瘦素受体蛋白表达呈浓度依赖性逐渐下降(P<0.01)(图2,表2)。
2.4 ASMCs中瘦素受体mRNA表达
与对照组相比,瘦素组△Ct值最低,瘦素受体mRNA表达明显增强 (P<0.05);加入噻托溴铵后瘦素受体mRNA表达呈浓度依赖性下降(P<0.05)(图3,表2)。
3 讨论
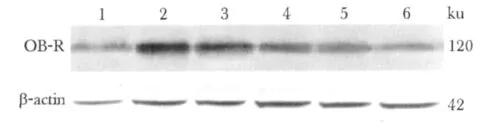
图2 Western blot检测瘦素受体蛋白表达Fig 2 The expression of leptin receptor protein
表2 瘦素受体相对表达Table 2 Relative expression of leptin receptor± s,n=6)

表2 瘦素受体相对表达Table 2 Relative expression of leptin receptor± s,n=6)
*P<0.05 compared with control group;#P<0.05 compared with leptin group.
group mRNA(△Ct)protein#control 14.03±1.84 0.327±0.011 leptin(100 μg/L) 3.62 ±1.22* 0.541 ±0.016*tiotropium(15 μg/L) 4.95 ±0.93* 0.514 ±0.017*30 8.28±1.67*# 0.468±0.025*#60 12.87±1.77# 0.331±0.023#120 12.71±1.40# 0.313±0.017
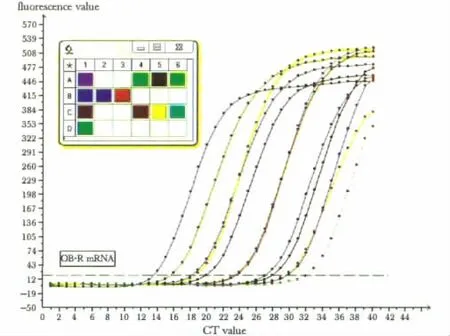
图3 瘦素受体mRNA荧光实时定量PCR扩增曲线Fig 3 Real-time PCR amplification curve of leptin receptor mRNA
肥胖是哮喘的危险因素之一,且使哮喘更易发生难以控制的类型。重症哮喘或难治性哮喘患者多有血清瘦素水平的升高[2]。瘦素是脂肪组织分泌的蛋白质,其受体(OB-R)在小鼠和人的肺泡、支气管上皮细胞及ASMCs上均有表达,研究表明瘦素与其受体在哮喘发病机制中具有促炎性反应及免疫调控等作用[6],但有关瘦素对 ASMCs的作用研究甚少。本研究证实瘦素干预后大鼠ASMCs增殖活性显著增加,与本研究前期实验[3]结果一致,提示瘦素可通过此途径参与气道重塑。研究也发现瘦素可于体外上调血管平滑肌细胞瘦素受体的表达[7],但在ASMCs中研究甚少,本研究发现,瘦素干预后可于体外上调ASMCs瘦素受体表达。
噻托溴铵是一种新型选择性M3胆碱能受体拮抗剂,它不仅可以舒张气道平滑肌,而且具有抗炎性反应、抑制气道重塑等作用。有不少报道其在哮喘特别是在难治性哮喘治疗中具有作用[4]。目前许多研究发现噻托溴铵对气道重塑有保护作用,可能的机制包括:抑制ASMCs丝裂反应[8]、使肺泡巨噬细胞合成转化生长因子-1(TGF-1)阳性表达率显著下降[9](TGF-1是气道重塑主要调控因子,直接影响气道壁胶原沉积,促进纤维化形成[10])、抑制ASMCs体积增大增厚及收缩蛋白质的表达[11]、抑制ASMCs增殖[12]等,提示噻托溴铵可通过多种途径抑制哮喘病理生理过程中气道重塑的发生,有关噻托溴铵与瘦素之间的研究甚少。本实验发现,噻托溴铵于体外可抑制瘦素促大鼠ASMCs的增殖;噻托溴铵可呈浓度依赖性下调瘦素受体mRNA及蛋白表达水平,提示噻托溴铵可能通过下调大鼠ASMCs表面瘦素受体表达来抑制瘦素的促大鼠ASMCs增殖作用,从而改善气道重塑。
本研究为噻托溴铵应用于哮喘提供了新的理论依据,临床上,对哮喘患者特别是重症哮喘患者的治疗中联合噻托溴铵可能有助于增加疗效。
[1]Hassan M,Jo T,Risse PA,et al.Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].J Allergy Clin Immunol,2010,125:1037-1045.
[2]Tanju A,Cekmez F,Aydinoz S,et al.Association between clinical severity of childhood asthma and serum leptin levels[J].Indian J Pediatr,2011,78:291-295.
[3]何淑敏,朱述阳,李慧婷,等.瘦素对大鼠气道平滑肌细胞增殖的影响[J].细胞与分子免疫学杂志,2010,27:849-855.
[4]Kerstjens HA,Disse B,Schröder-Babo W,et al.Tiotropium improves lung function in patients with severe uncontrolled asthma:a randomized controlled trial[J].J Allergy Clin Immunol,2011,128:308-314.
[5]Iwamoto H,Yokoyama A,Shiota N,et al.Tiotropium bromide is effective for severe asthma with noneosinophilic phenotype[J].Eur Respir J,2008,31:1379-1380.
[6]曹娟,陈建辉,朱述阳.瘦素对支气管哮喘大鼠气道炎症及Th1/Th2细胞因子表达作用的影响[J].中华结核和呼吸杂志,2009,32:171-176.
[7]徐成胜,吴勇波,何涛,等.瘦素、胰岛素及IL-26对平滑肌细胞瘦素受体mRNA表达的影响[J].中国组织化学与细胞化学杂志,2010,19:11-14.
[8]Haag S,Matthiesen S,Juergens UR,et al.Mauscarinic receptors mediate stimulation of collagen synthesis in human lung fibroblasts[J].Eur Respir J,2008,32:555-562.
[9]刘磊,张薇,朱莉莉,等.噻托溴铵及氨茶碱对稳定期慢性阻塞性肺病患者气道重塑的影响[J].中国医院药学杂志,2011,31:1004-1006.
[10]朴红梅,宋秋红.TGF-β抑制剂SB-431542对支气管哮喘小鼠气道重塑的干预作用[J].基础医学与临床,2011,31:1151-1153.
[11]Bos IS,Gosens R,Zuidhof AB,et al.Inhibition of allergen-induced airway remodeling by tiotropium and budesonide:a comparison[J].Eur Respir J,2007,30:653-661.
[12]Gosens R,Bos IS,Zaagsma J,et al.Protective effects of tiotropium bromide in the progression of airway smooth muscle remodeling[J].Am J Respir Crit Care Med,2005,171:1096-1102.
