高效液相色谱法同时测定郁金中5种成分
2013-08-28王丽瑶王永禄陈琳琳
王丽瑶, 王永禄, 陈琳琳
(1.安徽农业大学生命科学学院,安徽合肥 230036;2.南京工业大学药学院,江苏南京 210009)
郁金为临床常用中药,其基原复杂。2010年版《中国药典》收载郁金为姜黄属植物温郁金Curcuma wenyujinY.H.Chen et C.Ling、姜黄Curcuma longaL.、广西莪术Curcuma kwangsiensisS.G.Lee et C.F.Ling或蓬莪术Curcuma phacocaulisVal.的干燥块根,分别习称为“温郁金”、“黄丝郁金”、“桂郁金”或“绿丝郁金”[1]。郁金中的主要活性成分为姜黄素及倍半萜类成分[2]。其中姜黄素类成分主要有姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素等;倍半萜类成分主要有芳姜黄酮、bisacurone等[3-5]。不同基原郁金药材的化学成分有所不同,质量差异较大[6-7]。目前, 《中国药典》2010年版尚无郁金的定量测定内容,文献中多见对某种郁金挥发油类成分的GC-MS分析或对姜黄素的定量测定[8-12]。因此,有必要建立简单可行的分析方法对不同基原郁金的姜黄素及倍半萜类成分进行综合分析,以期为郁金的质量控制、临床用药的安全有效提供参考依据。
1 仪器与材料
Agillent 1200型高效液相色谱仪 (二极管阵列检测器、四元泵、柱温箱、化学工作站);Diamonsil C18色谱柱 (250 mm ×4.6 mm,5 μm)。对照品姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮为实验室自制,采用HPLC峰面积归一化法测定,纯度均大于98%。乙腈 (色谱纯,Merck公司);水为超纯水;其他试剂均为分析纯。从不同产地收集郁金药材共9件,经王丽瑶鉴定,安徽农业大学中药资源教研室陈琳琳教授复核,9件郁金药材分别为温郁金Curcuma wenyujinY.H.Chen et C.Ling、姜黄Curcuma longaL.、广西莪术Curcuma kwangsiensisS.G.Lee et C.F.Ling、蓬莪术Curcuma phacocaulisVal.的块根,即分别为温郁金、黄丝郁金、桂郁金及绿丝郁金。
2 方法与结果
2.1 检测波长的选择 采用二极管阵列检测器分别对5种成分进行扫描,3种姜黄素类化合物的最大吸收波长分别为姜黄素426 nm、去甲氧基姜黄素423 nm、双去甲氧基姜黄素417 nm;倍半萜类化合物的最大吸收波长分别为bisacurone B 242 nm、芳姜黄酮240 nm。为兼顾各组分的检测信号强度和灵敏度,最终选取420 nm作为姜黄素类化合物的检测波长;240 nm作为倍半萜类化合物的检测波长。
2.2 色谱条件 Diamonsil C18色谱柱 (250 mm×4.6 mm,5 μm);流动相为乙腈-0.6%冰乙酸溶液梯度洗脱 (0~10 min,27%乙腈;10~14 min,27% ~50%乙腈;14~24 min,50%乙腈;24~36 min,50%~90%乙腈);体积流量1.0 mL/min;柱温30℃;进样量20 μL;检测波长为240 nm、420 nm。在此色谱条件下,3种姜黄素类成分及2种倍半萜类成分分离良好,色谱图见图1。
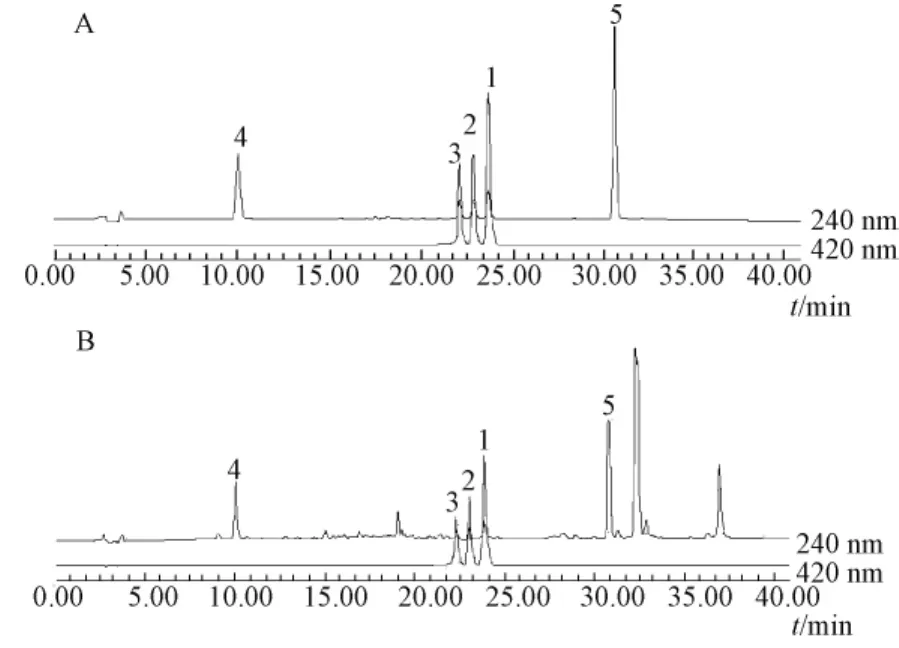
图1 混合对照品溶液 (A)和供试品溶液 (B)的HPLC图Fig.1 HPLC chromatograms of mixture referencesolution(A)and sample solution(B)
2.3 溶液的制备
2.3.1 混合对照品溶液的制备 分别取对照品姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮适量,精密称定,置20 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成含上述对照品 0.210 2、0.095 6、0.090 7、0.125 8、0.269 9 mg/mL的混合对照品贮备液。
2.3.2 供试品溶液的制备 取郁金药材细粉约1.0 g,精密称定,置100 mL具塞锥形瓶中,精密加入甲醇50 mL,称定质量,加热回流30 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液25 mL,减压回收甲醇,残渣加甲醇使溶解,转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,用微孔滤膜 (0.45 μm)滤过,取续滤液作为供试品溶液。
2.4 方法学考察
2.4.1 线性关系考察 将2.3.1项下制备的对照品贮备液由高至低逐级稀释制得系列质量浓度的对照品溶液。精密吸取不同质量浓度的对照品溶液20 μL,注入液相色谱仪,按2.2项下色谱条件测定,分别记录姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的峰面积,以对照品质量浓度为横坐标,峰面积积分值为纵坐标,绘制标准曲线,得到3种姜黄素类成分及2种倍半萜类成分的回归方程,结果见表1。
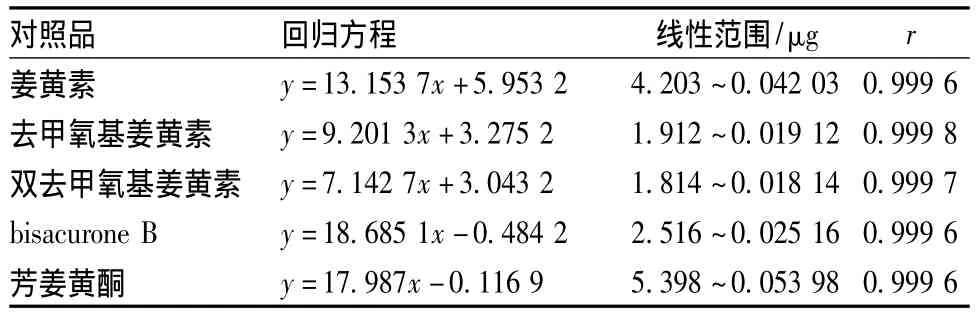
表1 3种姜黄素类成分及2种倍半萜类成分的回归方程和线性范围Tab.1 Regression equations and linear ranges for the three curcuminoids and two sesquiterpenes
2.4.2 精密度试验 精密吸取同一混合对照品溶液20 μL,注入液相色谱仪,连续进样6次,按2.2项下色谱条件测定,结果姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的峰面积RSD分别为1.24%、1.12%、1.07%、0.93%、0.86%,精密度良好。
2.4.3 重复性试验 取郁金样品约1.0 g,精密称定,共取6份,按2.3.2项下方法制备供试品溶液,分别精密吸取各供试品溶液20 μL,按2.2项下色谱条件注入液相色谱仪,测定姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的峰面积积分值,计算,结果上述5种成分的RSD分别为1.67%、1.46%、1.25%、1.36%、1.97%,重复性良好。
2.4.4 稳定性试验 精密吸取同一供试品溶液20 μL,分别在0、2、4、6、8、12 h按2.2项下色谱条件注入液相色谱仪,测定姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的峰面积积分值,结果上述5种成分的RSD分别为 2.03%、1.86%、1.92%、1.03%、0.96%,表明供试品溶液在12 h内稳定。
2.4.5 最低检测限 取混合对照品溶液逐步稀释后,注入高效液相色谱仪,以峰高为基线噪音3倍计,测得姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的最低检测限分别为0.105 075、0.095 6、0.090 7、0.062 9、0.134 95 μg/mL。
2.4.6 加样回收率实验 取已知含有量的郁金样品约0.5 g,精密称定,共取9份,分3组,每组3份,每组按样品中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮各自含有量的80%、100%、120% 分别精密加入对照品,按2.3.2项下方法制备供试品溶液,分别精密吸取各供试品溶液20 μL,按2.2项下色谱条件注入液相色谱仪,测定姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮,计算加样回收率。结果上述5种成分的平均加样回收率分别为 97.05%、97.35%、98.76%、101.28%、97.27%,RSD分别为1.79%、1.06%、0.95%、1.38%、1.85%,方法准确性良好。
2.5 样品测定 取郁金样品约1.0 g,精密称定,按2.3.2项下方法每个样品平行制备供试品溶液2份,分别精密吸取各供试品溶液20 μL,按2.2项下色谱条件测定姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、bisacurone B、芳姜黄酮的峰面积积分值,根据标准曲线计算,结果见表2。
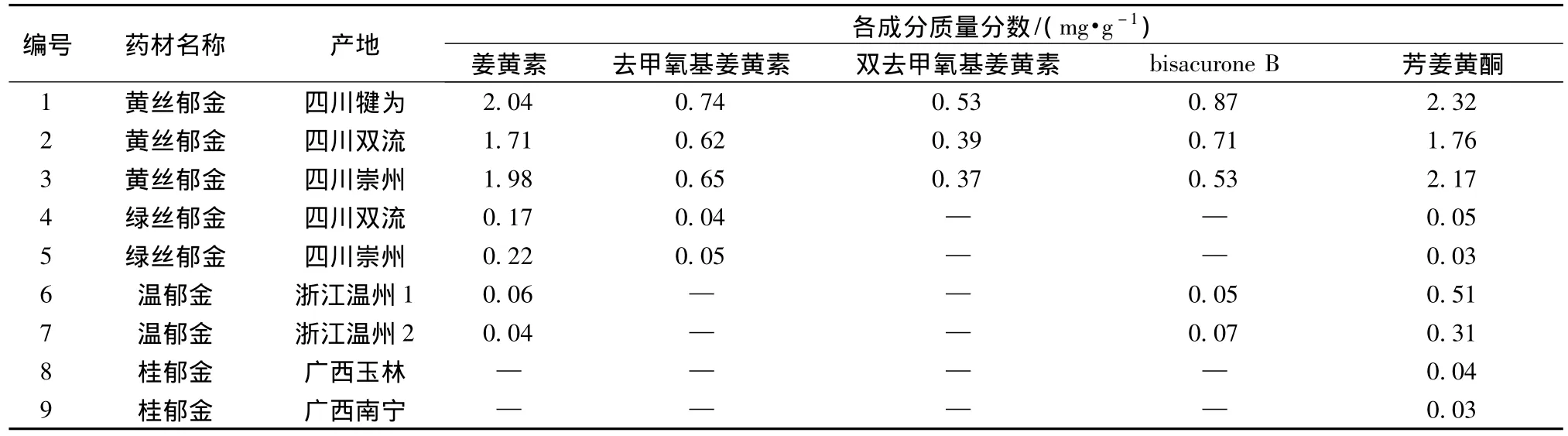
表2 郁金中5种成分的测定结果Tab.2 Results of determination of five compounds in Curcumae Radix
3 讨论
3.1 供试品制备条件的优化 在供试品溶液制备过程中,分别对提取方式 (回流、超声)、提取溶剂 (甲醇、乙醇、乙酸乙酯)及用量、提取时间进行了考察,结果表明用50 mL甲醇加热回流提取0.5 h为最佳提取条件。
3.2 流动相的选择 分别采用乙腈-水、甲醇-水、乙腈-0.6%冰乙酸、乙腈-0.1%磷酸等系统进行梯度洗脱实验。结果表明,如果流动相中不加酸,姜黄素类化合物的峰形较差。乙腈-0.6%冰乙酸系统的条件为最佳,冰乙酸对色谱峰峰形的改善具有较好的效果,且基线稳定,分析周期短,得到了满意的分析结果。
3.3 不同基原郁金药材测定结果分析 对不同基原郁金药材测定结果进行分析,发现黄丝郁金药材中各指标成分的量均较高,其它3种郁金药材中各指标成分量均较低。结合已有研究结果[6],认为不同种姜黄属植物的块根均作为郁金药用质量相差甚大,难以保证临床用药的安全有效,有必要对药材质量做进一步的规范;同时建议种植高品质的郁金品种。
3.4 小结 本实验建立了HPLC法同时测定郁金药材中3种姜黄素类成分和2种倍半萜类成分;测定了9批4种不同基原的郁金药材,反映了不同基原郁金药材质量的优劣。该方法简便、快速、准确,能够为郁金药材的质量评价提供一定的参考。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:193.
[2]宿树兰,欧阳臻,金晓勇.姜黄属几种药材的红外指纹图谱鉴别研究[J].中成药,2006,28(10):1408-1410.
[3]Wang L Y,Zhang M,Zhang C F,et al.Diaryl derivatives from the root tuber ofCurcuma longa[J].Biochem Syst Ecol,2008,36(5-6):476-480.
[4]王丽瑶,张 勉,张朝凤,等.黄丝郁金中的生物碱和倍半萜类成分[J].药学学报,2008,43(7):724-727.
[5]葛跃伟,高慧敏,王智民.姜黄属药用植物研究进展[J].中国中药杂志,2007,32(23):2461-2467.
[6]朱晶晶,张清哲,王智民,等.郁金质量标准研究[J].中国中药杂志,2010,35(16):2106-2109.
[7]林琪宇,张 娜,方道硕,等.不同品种郁金的薄层鉴别[J].四川中医,2008,26(5):34-35.
[8]Qin N Y,Yang F Q,Wang Y T,et al.Quantitative determination of eight components in rhizome(Jianghuang)and tuberous root(Yujin)ofCurcuma longausing pressurized liquid extraction and gas chromatography-mass spectrometry[J].J PharmBiomed Anal,2006,43(2):486-492.
[9]金建忠.超临界CO2萃取温郁金挥发油及其成分分析研究[J].中国中药杂志,2006,31(3):255-257.
[10]贾海英,杜守颖,李冬雪,等.高效液相色谱法测定黄丝郁金中姜黄素的含量[J].时珍国医国药,2005,16(4):318-319.
[11]彭炳先,周 欣,王道平,等.HPLC法测定姜黄、莪术、郁金中三种姜黄色素的含量[J].中药材,2004,27(11):813-815.
[12]李 敏,张 娜,林琪宇,等.黄丝郁金的质量标准研究[J].成都中医药大学学报,2008,31(1):55-59.
