治疗乙肝相关性肾炎新药大黄甘草胶囊提取工艺优选
2013-08-28崔佳丽山丽梅赵艳玲王伽伯李宝才肖小河
崔佳丽, 山丽梅, 赵艳玲, 张 萍, 王伽伯, 李宝才, 肖小河
(1.解放军302医院全军中医药研究所,北京 100039;2.昆明理工大学生命科学与技术学院,云南昆明 650224;3.解放军302医院中西医结合医学中心,北京 100039)
自1971年 Combes等[1]首次描述了第一例具有持续HBsAg血症的患者发生了膜性肾病至今,肾小球肾炎已被公认为是乙型肝炎病毒 (HBV)感染引起的最常见肝外病变,又称HBV相关性肾炎。在我国,HBV相关性肾炎发病率很高,约为乙肝患者的16.6%~32%,此病发病机制尚不明确,临床治疗需要兼顾肝病和肾病,既需要抑制肾脏的免疫反应,又不能因免疫抑制使乙型肝炎病毒复制增强,用药矛盾突出,临床上治疗难度大,尚缺乏有效治疗药物。
解放军302医院是全国最大的三级甲等传染病医院。在长期临床应用中总结出应用大黄甘草方治疗HBV相关性肾炎的协定处方,临床效果显著。大黄甘草汤是临床常用经典方 (张仲景《金匮要略》),由大黄、甘草两味药组成。其有效治疗HBV相关性肾炎的机制可能与大黄蒽醌和甘草酸均具有明确的抗乙肝病毒和免疫调节[2-6]双重作用相关。大黄甘草汤临床应用剂型主要为汤剂、散剂,而其临床治疗HBV相关性肾炎的剂型为汤剂、水煎服,不便于患者应用,故在大黄甘草汤治疗HBV相关性肾炎临床疗效肯定的基础上,将其开发为首个治疗HBV相关性肾炎的中药制剂-大黄甘草胶囊,具有一定社会及经济意义。本实验结合2010年版《中国药典》[7]中有关大黄、甘草含量测定相关规定,将大黄酸等5种蒽醌、甘草酸作为优选大黄甘草汤最优提取方式的指标成分,应用正交试验法优选大黄甘草胶囊的提取工艺,以浸膏得率、总蒽醌 (大黄酸等5种蒽醌单体之和)、甘草酸含量为指标采用综合评分法[8]来进行工艺条件优化。
1 仪器与试药
Agilent 1200 HPLC高效液相色谱仪 (Agilent,四元梯度泵,自动进样,Angilent工作站),AL204电子天平 (瑞士梅特勒-托利多公司)。
大黄、甘草饮片由解放军第302医院中药房提供,经肖小河研究员鉴定为蓼科植物药用大黄Rheum officinaleBaill.、光果甘草Glycyrriza glabraL.的干燥根和根茎。对照品大黄素 (批号:110795-200505)、大黄酚 (批号:110796-200716)、大黄酸 (批号:110757-200206)、大黄素甲醚 (批号:110758-200610)、芦荟大黄素 (批号:110799-200806)、甘草酸单铵盐 (批号:110799-200615)购自中国药品生物制品检定所,甲醇、乙腈 (色谱纯,Sigma公司)。其余试剂均为分析纯。
2 方法与结果
2.1 5种蒽醌单体及甘草酸测定
2.1.1 色谱条件 蒽醌类成分:Kromasil C18色谱柱 (250 mm×4.6 mm,5 μm)。流动相为甲醇-0.1%磷酸水溶液(85∶15),体积流量1.0 mL/min;检测波长254 nm;进样量 10 μL;柱温25 ℃[9]。
甘草酸:Kromasil C18色谱柱 (250 mm×4.6 mm,5 μm)。流动相为乙腈-0.1% 磷酸水溶液 (乙腈:0~5 min,19%~25%;5~19 min,25%~50%;19~20 min,50%~100%),体积流量1.0 mL/min;检测波长250 nm;进样量10 μL;柱温 25 ℃[7]。
色谱图见图1。

图1 大黄甘草汤中5种蒽醌单体、甘草酸HPLC图
2.1.2 对照品溶液的配制 精密称取大黄素等5种对照品适量,置于同一量瓶中,甲醇溶解,稀释至刻度。作为含大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚各50 μg/mL的混合对照品溶液贮备液。对照品溶液为此贮备液按一定比例稀释,含各成分10 μg/mL。
精密称取甘草酸铵对照品适量,置于量瓶中,加入甲醇溶解并稀释至刻度,摇匀。得到含甘草酸铵100 μg/mL的对照品溶液。
2.1.3 供试品溶液的制备 取过60目大黄甘草汤浸膏粉末约0.2 g,精密称定。
用于蒽醌单体测定的样品溶液:加入25 mL甲醇加热回流1 h,放冷,用甲醇补足减失的质量,摇匀,滤过。精密量取续滤液5 mL,挥去甲醇,加8%盐酸溶液10 mL,超声2 min,再加入CHCl310 mL,加热回流处理1 h,放冷,置分液漏斗中,分取CHCl3层,酸液再用CHCl3萃取3次,每次10 mL,合并CHCl3液,减压回收溶剂至干,残渣加甲醇使溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,过0.22 μm滤膜,即得。
用于甘草酸测定的样品溶液:置于10 mL量瓶中,以甲醇溶解,超声处理 (功率250 W,频率40 kHz)60 min,甲醇定容至刻度,摇匀,过0.22 μm滤膜,即得。
2.1.4 线性关系考察 分别精密量取蒽醌类、甘草酸单铵盐对照品溶液 0.02、0.40、0.80、1.20、1.60、2.00 mL,置于10 mL量瓶中,甲醇定容,10 μL进样测定。以标准溶液质量浓度X对色谱峰面积Y进行线性回归,得回归方程,结果见表1。
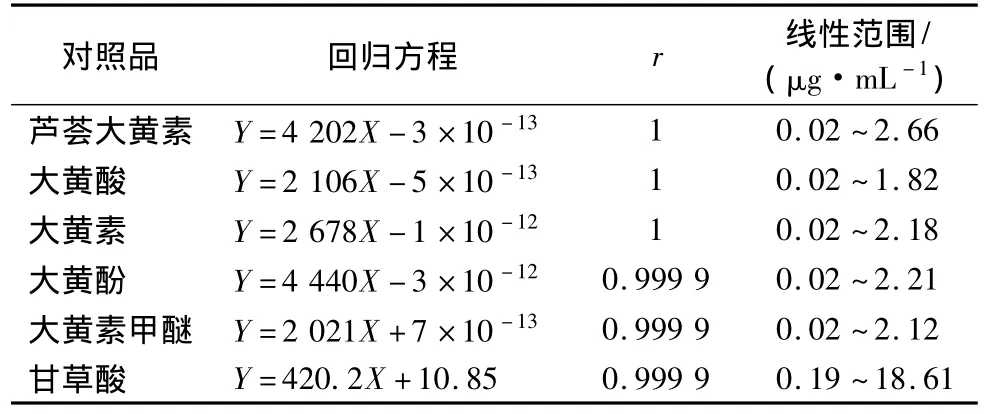
表1 标准曲线
2.1.5 精密度试验 取同一质量浓度的对照品溶液连续进样5次,测定峰面积,计算得6对照品RSD值范围为0.22%~0.81%。表明该方法精密度良好。
2.1.6 重复性试验 将同一样品,按2.1.3项下样品制备方法平行制备6份样品溶液,测定峰面积,计算得6组分RSD值范围为0.20%~1.70%。表明本法重复性良好。
2.1.7 稳定性试验 取同一样品溶液于室温下0、2、4、6、8、12 h分别进样,测定峰面积,计算得6组分RSD值范围为0.24%~1.87%。表明样品溶液在12 h内稳定。
2.1.8 回收率试验 精密称定已知量的同一提取物样品3份,分别精确加入6种对照品溶液,各份均按2.1.3项下方法制备样品,测定峰面积,计算回收率,结果见表2。

表2 回收率实验
2.2 提取方法 根据L9(34)正交试验因素水平表,分9组实验,每组取日处方量13.5 g(大黄9 g、甘草4.5 g),精密称定。置250 mL圆底烧瓶中,按安排表中实验条件,加热回流提取,各提取液60℃旋蒸并干燥至恒定质量。
2.3 正交试验设计 依据L9(34)正交试验设计,综合考虑总蒽醌、甘草酸、浸膏提取率三项指标,考察溶剂量、提取时间、提取次数对上述指标的影响,结合临床实际应用,选取各水平,见表3。

表3 L9(33)正交试验因素水平
2.4 正交试验结果 按照L9(34)正交设计表的条件进行试验,分别测得大黄酸等5种蒽醌单体、甘草酸的量和浸膏得率,并进行多指标综合评分。评分时以各指标的最大值为参照将数据进行归一化,再给出不同的权重。总蒽醌和甘草酸的权重系数分别设为0.4和0.4。在原大黄甘草汤方在临床应用中日服用量较少、效应成分不很明确的前提下,浸出物得率越高则指标成分提取量越高,因此设定浸出物得率的权重系数为0.2。以综合值进行统计分析,其中综合评分M=0.4X×100/135.15+0.4Y×100/95.15+0.2Z×100/45.55。依据综合评分结果输入SPSS系统进行分析。
结果见表4。SPSS数理统计软件方差综合分析见表5。

表4 L9(34)正交试验设计及实验结果

表5 L9(34)正交试验方差分析结果
2.5 正交试验结果分析 以综合评分为标准,在所选因素水平范围内,由表4、5直观分析结果显示,各因素主次顺序为C>A>B,各因素的影响水平为:A因素以第三水平影响最大,B因素以第一水平影响最大,C因素中以第三水平影响最大。综合分析表结果表明,只有C因素即提取次数对综合分析结果有显著性影响 (P<0.05),A(溶剂量)因素与B(提取时间)因素对试验结果无显著性影响 (P>0.05)。考虑实际应用,确定最优提取方法为A1B1C3,即加水量8倍,每次1 h,提取3次。
2.6 验证试验 按处方量10倍精密称取药材饮片135 g,按优选出的提取方法进行3批验证试验并测定各指标成分,结果见表6。

表6 验证实验结果
验证试验结果证明,本调配方法稳定可靠。
3 讨论
优选提取工艺的目的是将可能发挥药效的部位得到最大程度的提取。本实验采用的多指标综合评价分析结果较单一指标的评价更为科学合理。用多指标正交实验进行工艺优选时,首先要针对指标间的重要性差异给出各指标权重,综合评分后再进行统计分析。本实验中大黄和甘草在正交实验中所得大黄总蒽醌、甘草酸的量随提取条件变化的趋势相同,故将这两者有效成分的量权重均定为0.4。在原大黄甘草汤方在临床应用中日服用量较少、效应成分不是很明确的前提下,浸出物得率越高则指标成分提取量越高,因此设定浸出物得率的权重系数为0.2。根据这一思路,本实验在充分尊重大黄甘草汤临床治疗HBV相关性肾炎应用的基础上,应用正交实验设计对大黄甘草胶囊进行提取工艺的优选,为其开发为治疗HBV相关性肾炎的首个中药制剂做基础研究。
本实验采用因素为溶剂量、提取时间和次数的正交设计法,以浸膏得率、总蒽醌、甘草酸的量为指标,综合分析得到最佳理论组合为A1B1C3,并经验证试验最终确定提取工艺为8倍量水提取3次,每次1 h,即A1B1C3。其中提取次数对浸膏得率、总蒽醌、甘草酸的量影响最大,有显著性差异 (P<0.05)。溶剂量、提取时间三项水平间没有显著性差异 (P>0.05),影响较小。结果表明提取工艺简单,可靠,可作为治疗HBV相关性肾炎的新中药制剂大黄甘草胶囊的提取工艺。
[1]Combes B,Shorey J,Barrera A,et al.Glomerulonephritis with deposition of Australia antigen-antibody complexes in glo-merular basement membrane[J].Lancet,1971,2(7718):234-241.
[2]李 文,邹正宇,查 赣,等.170种中草药抗乙型肝炎病毒的实验研究[J].世界华人消化杂志,1999,7(1):89-90.
[3]南海江,许旭东,陈士林,等.大黄属植物研究进展[J].天然产物研究与开发,2009,21:690-701.
[4]胡志厚.甘草酸类药物的研制及应用[J].药学学报,1988,23(7):553.
[5]马 迪,唐 阁.大黄免疫功能的研究进展[J].中医药学刊,2006,8:1505-1507.
[6]掘笼大之.甘草酸对自身免疫性疾病的治疗作用[J].国外医学 (中医中药分册),2002,24(2):126.
[7]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[8]贺福元,彭关富,罗杰英,等.多指标全概率评分法对鹤蟾颗粒剂提取工艺的研究[J].中国中药杂志,2001,26(4):251-252.
[9]Wang Jiabo,Li Huifang,Jin Cheng.Development and validation of a UPLC method for quality control of rhubarb-based medicine:Fast simultaneous determination of five anthraquinone derivatives[J].J Pham Biomed Anal,2008,47(4-5):765-770.
[10]李 丽,周 军,张 莹,等.多指标全概率评分法优化痛风宁颗粒提取工艺[J].中成药,2007,29(2):281-283.
