大黄酸肠溶缓释微丸的制备及体外释放度考察
2013-08-28赵一洁张丹参张夏微
赵一洁, 张丹参, 张 力, 张夏微, 金 灿
(河北北方学院药理学教研室,河北张家口 075000)
大黄酸是大黄、芦荟、虎杖等的主要有效成分之一[1],属单蒽核类 1,8-二羟基蒽醌衍生物,其结构式中含有二个羟基和一个羧基,极性较强,具有电化学氧化还原性质[2]。大黄酸在抗炎、抗菌、抗肿瘤、抗氧化、降糖调脂等多方面具有活性[3],但由于其水溶性差,半衰期短,胃肠刺激大[4-5]等因素,因此限制了其在临床中的应用发展。海藻酸钠是一种天然的多糖类高分子化合物,从海藻中提取,有良好的生物相容性和降解性,与大多数多价阳离子反应会形成交联,形成网状蛋格结构[6],广泛应用于医药软膏基质或混悬剂的增黏剂,尤其在缓释制剂的片剂、胶囊、微丸、微囊中非常重要[7]。国外对海藻酸钠在药剂领域中的应用研究比较活跃[8-10],海藻酸钠及其降解产物均无毒,和二价钙离子在温和条件下可形成符合多重性能要求的凝胶[11],其价格便宜,来源丰富,因此广泛应用于医学工程。本实验正是利用海藻酸钠可与钙离子形成凝胶微丸的特点,制备大黄酸肠溶凝胶缓释微丸并对其体外释放度进行考察。
1 仪器与试药
Waters 600高效液相色谱仪,2996二极管阵列检测器,美国Waters公司;BT100-2J蠕动泵,保定兰格恒流泵有限公司;RC806溶出试验仪,天大天发科技有限公司制造;85-2A数显恒温测速磁力搅拌器,金坛市金南仪器厂;WG—71电热鼓风干燥箱,天津市泰斯特仪器有限公司;PHS-3C型pH剂,上海精密科学仪器有限公司;大黄酸 (质量分数>98%),南京泽朗医药科技有限公司;大黄酸对照品 (质量分数>98%),中国药品生物制品检定所;海藻酸钠,青岛明月海藻集团有限公司;氯化钙、氢氧化钠、磷酸二氢钾 (KH2PO4)、磷酸氢二钠 (Na2HPO4·12H2O)、无水甲醇等均为分析纯。
2 方法与结果
2.1 空白微丸的制备 配制2.5%的海藻酸钠溶液放置充分溶胀24 h备用,配制3%的氯化钙溶液,采用处理过的针头将溶胀好的海藻酸钠溶液以适宜的滴速和滴距滴进不断搅拌的氯化钙溶液中,骨架微丸立即形成,胶凝2 h[12]后用去离子水冲洗3次,抽滤瓶过滤后放在干燥箱中干燥即得空白微丸。通过对制备工艺的考察,调节各种影响微丸成型性的因素,制得圆整、光滑,成型性最好的微丸。
2.2 大黄酸肠溶缓释微丸的制备 配制2.5%的海藻酸钠溶液放置充分溶胀24 h[13]备用,取适量的大黄酸原料放入研钵中,将溶胀好的海藻酸钠溶液倒入研钵中一部分,充分研磨,将研磨好的大黄酸海藻酸钠溶液倒入原海藻酸钠溶液中充分搅拌,使其成为均一分散相。采用处理过的针头将含药海藻酸钠溶液通过蠕动泵以恒定的速度滴入到不断搅拌的氯化钙溶液中,骨架微丸立即形成,胶凝2 h后用去离子水洗3次,过滤后放在干燥箱中,调节温度40℃干燥24 h即得大黄酸微丸。
2.3 大黄酸定量测定方法学考察
2.3.1 溶液的制备 对照品溶液:精密称取大黄酸对照品1.00 mg置于25 mL量瓶中,用甲醇为溶剂定容到刻度,摇匀得对照品贮备液40 μg/mL。
供试品溶液:称取适量微丸 (约相当于20 mg大黄酸),加0.1 mol/L枸橼酸钠水溶液适量振摇使之溶解,定容至100 mL,精密吸取5 mL,至100 mL量瓶中,加0.1 mol/L枸橼酸钠水溶液稀释至刻度,摇匀。
2.3.2 色谱条件 Lanbo Kromasil C18色谱柱 (250 mm×4.6 mm,5 μm),流动相为甲醇-0.1%磷酸(85∶15)。检测波长432 nm。体积流量1 mL/min,柱温25℃,进样量20 μL。
2.3.3 标准曲线制备 将配制好的对照品溶液分别稀释成质量浓度为2、4、5、8、10、14 μg/mL的一系列标准品溶液,在上述HPLC条件下测定大黄酸的峰面积。以大黄酸质量浓度 (μg/mL)为横坐标,峰面积为纵坐标,绘制面积-质量浓度标准曲线,进行回归分析,求得线性回归方程Y=62 352X+14 077,r=0.999 0,表明大黄酸在2 ~14 μg/mL范围内线性关系良好。
2.3.4 精密度、重复性和稳定性实验 取10 μg/mL的对照品溶液,按照上述色谱条件测定,连续进样6次,记录大黄酸的峰面积,结果RSD为0.08%。取同一批大黄酸微丸,按上述供试品溶液制备方法制备6份溶液,在上述色谱条件下测定大黄酸,计算得大黄酸RSD为1.3%。取同一批大黄酸微丸分别在0、2、4、6、8和10 h进样,测定大黄酸,计算的大黄酸的RSD为1.9%。
2.3.5 回收率试验 取处方量辅料于25 mL量瓶中,分别各加入不同质量浓度的大黄酸对照品溶液,定容。用0.45μm微孔滤膜过滤,在上述色谱条件下进行测定,结果平均回收率为96.31%,RSD为3.12%(n=6)结果见表1。

表1 样品回收率Tab.1 Sample recovery rate
2.3.6 样品的测定 制备5批样品,对这5批样品进行定量测定。以0.1 mol/L枸橼酸钠水溶液为空白对照,在上述HPLC条件下进样,求得峰面积,带入标准曲线方程,求得大黄酸的量,见表2。空白对照以及样品的高效液相色色谱图,见图1。
2.4 体外释放度的测定 取大黄酸肠溶微丸 (相当于大黄酸20 mg),按照《中国药典》2010年版第二部附录XD溶出度测定法第一法装置进行试验。配制pH 1.2的盐酸溶液1 000 mL模拟人工胃液作为溶出介质,温度37℃,转速100 r/min,在2 h时立即将转篮升出液面。吸取2.5 mL溶液后将盐酸溶液弃去,随即移入预先热至37℃的pH6.8的磷酸盐缓冲溶液1 000 mL模拟人工肠液。分别于2、4、6、8、10、12 h时间点吸取溶出液2.5 mL,同时向溶出液中注入2.5 mL磷酸盐缓冲溶液,吸取出的溶液用0.45 μm微孔滤膜过滤,与5 mL量瓶中用无水甲醇定容,再次过0.45 μm微孔滤膜进样20 μL,于432 nm处测量峰面积,计算大黄酸微丸的释放度[14]。

表2 5个批次的药物中大黄酸质量分数Tab.2 Rhein contents in five batches
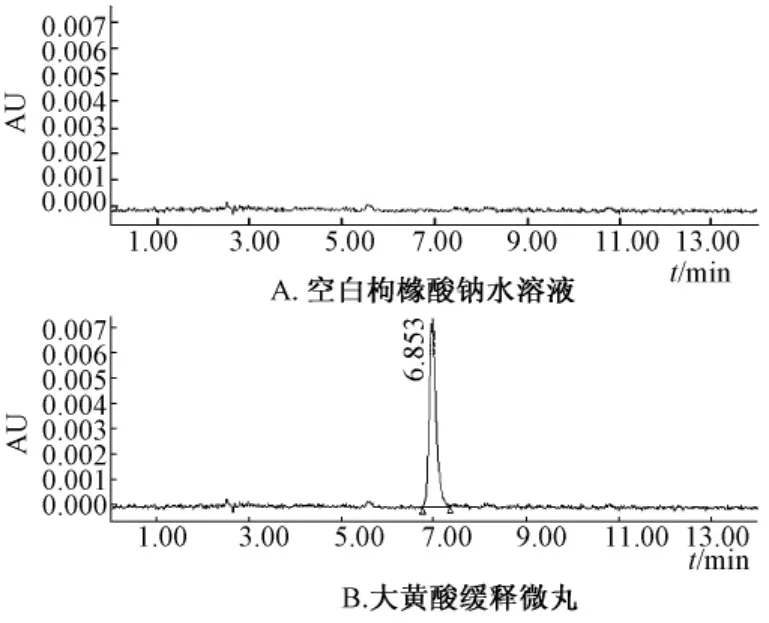
图1 空白对照和微丸的HPLC色谱图Fig.1 HPLC chromatograms of blank contrast and the pellets samples
经预实验,初步确定对微丸成型性和释放度影响最大的四种因素:海藻酸钠质量分数 (A)、氯化钙质量分数 (B)、氯化钙pH(C)及投药量(D大黄酸 ∶海藻酸钠),分别对微丸释放度的四因素进行考察,分别见图2~5。
在各影响因素中选择形态良好,在胃模拟溶液中药物释放较少或几乎不释放而在小肠模拟溶液中缓慢释放的三个水平进行正交试验。以微丸在小肠模拟溶液中10 h内的释放度为评价指标,选用L9(34)正交试验表进行试验,进一步考察四种因素对微丸形态和释放度的影响作用,优选制备微丸的工艺条件。正交试验结果通过制备微丸的形态以及微丸的释放度两方面进行综合评价,其中微丸释放度是评价的主要因素,两指标都采用10分制,10分为最好,因此,微丸形态 (D1)从不成型到形态好分为10个等级,用1~10分来评价,小肠模拟溶液释放度 (D2)=10×微丸释放度,综合评分,总分=0.3×D1+0.7×D2。因素水平表见表3,正交试验结果及方差分析见表4、表5。
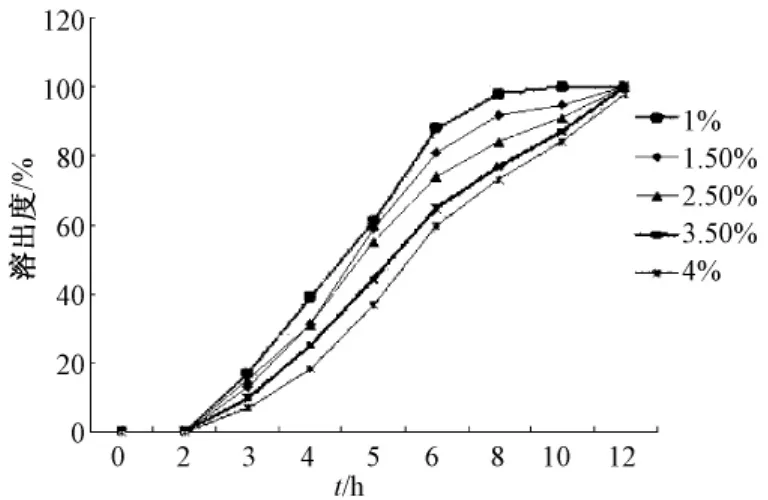
图2 海藻酸钠质量分数对微丸溶出度的影响Fig.2 Effect of alginate concentration on micropellets's dissolution
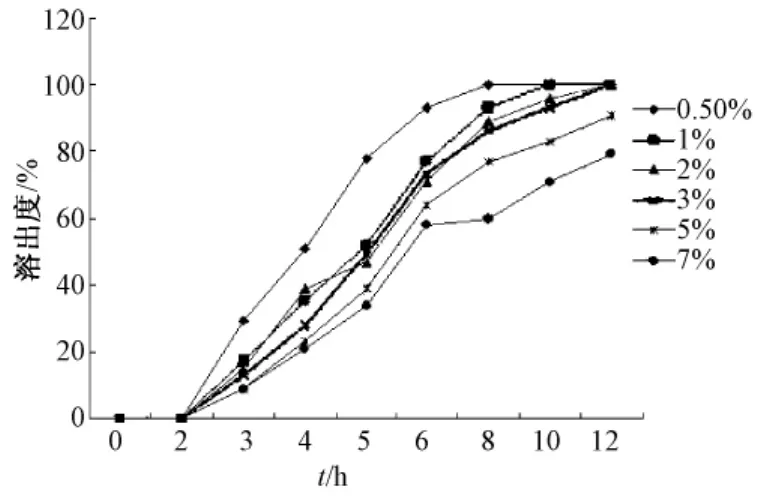
图3 CaCl2质量分数对微丸溶出度的影响FFig.3 Effect of CaCl2concentration on
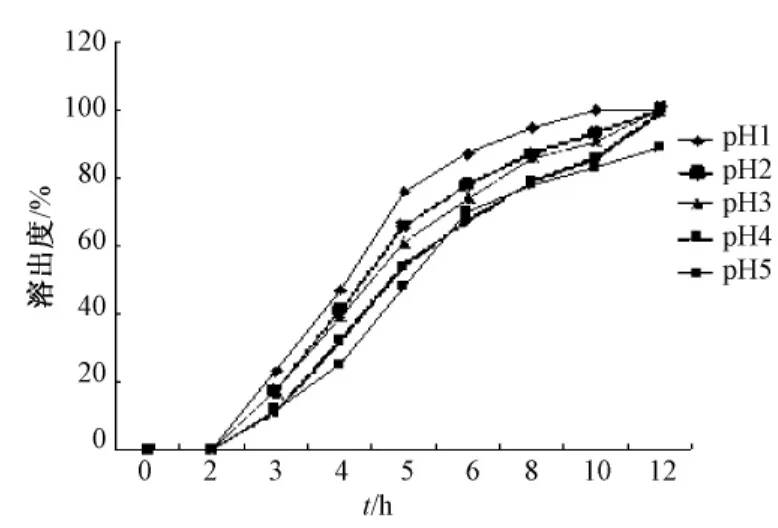
图4 CaCl2pH值对微丸溶出度的影响Fig.4 Effect of CaCl2pH on micropellets's dissolution rate

表3 因素水平Tab.3 Factors and levels
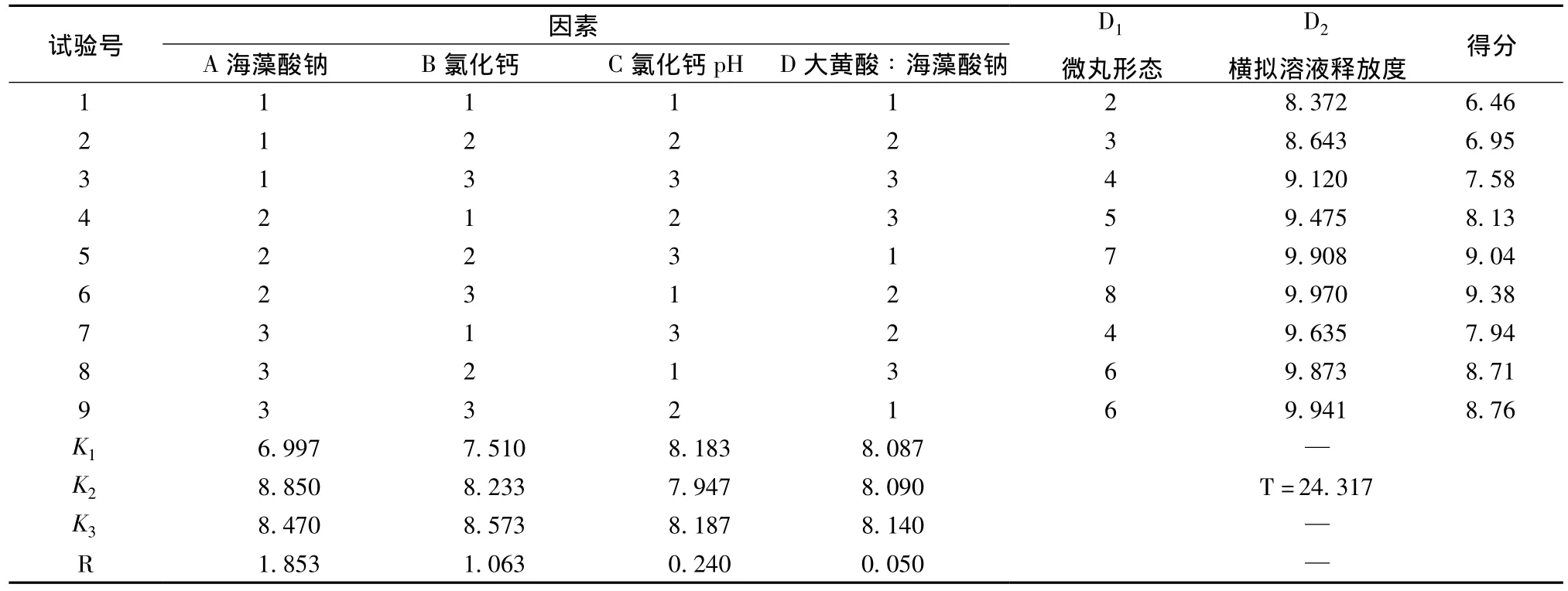
表4 正交试验结果Tab.4 Orthogonal design and experimental results

图5 投药量对微丸溶出度的影响Fig.5 Effectofdosage ofrhein on micropellets's dissolution rate

表5 方差分析结果Tab.5 Analysis of variance
极差R的大小反映了各因素对所测定指标的影响,由表4中R可知,四个因素对成丸影响的主次顺序为A>B>C>D,即海藻酸钠质量分数 (A)对微丸的成形性和包封率影响最大,且投药量(D)的大小对其的影响最小,因此将此列作为误差列进行方差分析。由表5可知,进一步的方差分析表明海藻酸钠质量分数 (A)和氯化钙质量分数(B)二因素均有显著影响 (P<0.01)。正交试验结果显示,最佳制备工艺为A2B2C2D1,即处方组成为海藻酸钠2.5%,氯化钙3%,氯化钙pH为4,大黄酸 ∶海藻酸钠为1∶15,凝胶2 h。
按最佳处方制备了5批样品,对5批样品分别进行体外释放度测定,测得微丸在胃模拟溶液中,微丸几乎不释放药物[15],释放度均 <5%,而在PBS(pH 6.8)小肠模拟溶液中开始缓慢释放,且8 h释放大约85%左右的大黄酸,符合缓释制剂的要求。且5批微丸释放曲线几乎重合,没有显著性差异,处方工艺重现性良好,释放曲线见图6。
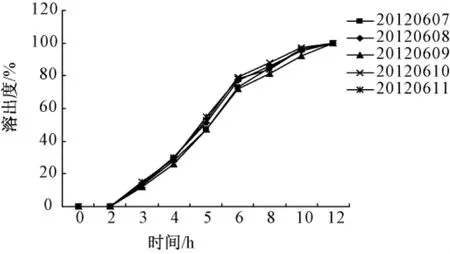
图6 5批微丸的溶出度Fig.6 Five batches pellets'dissolution
3 讨论
本实验利用海藻酸钠可与二价钙离子形成难溶性凝胶的性质制备缓释制剂,海藻酸钙凝胶微丸的制备方法有很多种,其中应用最多的为滴制法[16-17]。滴制法又分为机械和手工两种,本实验采用的是手工滴制法,其中的滴距为8 cm[18],滴距过小滴出的丸体形状不一,不圆整规则,滴距过大微丸容易漂浮在氯化钙液面上,影响微丸的进一步的胶凝反应。采用处理过的针头做滴管,选取滴管直径是1.2 mm,滴管直径过小,由于海藻酸钠比较黏稠,所以滴制过程比较难进行,滴管直径过大,滴制出的丸体不圆整,并严重拖尾。滴速是30滴/min,滴速过快容易形成串滴,微丸不能形成,滴速过慢影响整批微丸的胶凝反应时间。在微丸胶凝反应完毕后在烘箱里干燥,干燥温度过高微丸迅速失水导致丸体干燥后不圆整,干燥温度过低使整个干燥过程时间过渡延长,所以选用40℃,24 h干燥,得粒径1mm左右的微丸。
影响海藻酸钙凝胶微丸释药行为的因素很多[19],本实验对微丸溶出度影响最大的是海藻酸钠质量分数、氯化钙质量分数、氯化钙pH以及投药量。在预实验中,海藻酸钠质量分数低于1%无法滴制成丸,而高于3.5%,滴制过程就很难进行,而且滴制出的微丸拖尾严重。氯化钙的质量分数低于0.5%无法滴制成丸,高于10%滴制出的微丸就漂浮于液面,胶凝过程无法很好完成。由于大黄酸对pH特别敏感,所以氯化钙溶液的pH值高于7,就会使滴制出的微丸表面被氧化变色,所以氯化钙的pH值不能高于7。由于大黄酸水溶性很差,几乎不溶于水,所以投药量越大,溶出度越小,但是投药量过大会影响微丸包封率,所以选用与海藻酸钠的比例为1∶15。
海藻酸钙凝胶微丸是近年来发展起来的新型剂型,它作为口服药物的缓控释载体在国内外已受到广泛关注[20]。大黄酸在水中的溶解度很低,溶出速率慢以及较强的肝首过效应,使其生物利用度很低[21],近年来有关海藻酸钙凝胶微丸作为口服药物缓释载体的报道也很多,选择模型药物的范围也很广,但是海藻酸钙凝胶微丸尤其适用于难溶性药物及大分子药物[22-23],因此本实验将大黄酸制备成了海藻酸钠缓释微丸,达到了将药物的缓慢释放的目的。其能否提高药物的生物利用度,改善药物的吸收还有待进一步研究。
[1]He Z H,He M F,Ma S C,et al.Anti-angiogenic effects of rhubarb and its anthraquinone derivative[J].J Ethnoph armacol.2009,121(2):313-317.
[2]李自林,王 琰,郑莜梅,等.线性扫描极谱法测定大黄酸[J].重庆师范学院学报:自然科学版,1998,15(3):213-216.
[3]笪红远,江振洲,王翠芬,等.大黄酸和大黄素在体外对人肾小管上皮细胞的毒性作用研究[J].中草药,2009,40(1):102-105.
[4]张锦雯,孙建国,王广基,等.大黄酸在大鼠和比格犬体内的吸收动力学研究[J].中国临床药理学与治疗学,2010,15(5):511-517.
[5]邹世洁,崔 巍,张宇鹏,等.大黄酸对胃黏膜上皮细胞生长、增殖和凋亡的影响[J].世界华人消化杂志,2001,9(4):447-448.
[6]张良珂,袁 佩,张 彦,等.不同离子交联剂对海藻酸凝胶微丸溶胀和释药性质的影响[J].中国药学杂志,2008,43(8):606-609.
[7]魏靖明,张志斌,冯华林,等.海藻酸钠作为药物载体材料的研究进展[J].化工新型材料,2007,35(8):20-22.
[8]Efentakis M,Koutlis A.Release of furosemide frommultiple units and single-units of different viscosity grades of sodium alginate solid dosage forms[J].Pharm Dev Tech,2001,6(1):91-98.
[9]Chan L W,Paul W,Heng S.Effects of aldehydes and methods of cross-linking on properties of calcium alginate microspheres prepared by emulsification[J].Biomaterials,2002,23(5):1319-1326
[10]Gilchrist T,Martin A,Wound treatment with Sorbsan -an alginate wound dressing[J].Biomaterials,1994;15:317-320.
[11]李红兵.海藻酸钠理化性质研究和特种品种制备 [D].天津:天津大学化工学院,2005.
[12]马 燕,李卫中,葛月宾.海藻酸钙凝胶微丸体外释药机制的考察[J].中国药学杂志,2009,44(20):1564-1566.
[13]王 茹.酶触型结肠靶向吲哚美辛微丸的研制 [D].石家庄:河北医科大学,2009.
[14]YBH18552006,国家食品药品监督管理局标准[S].
[15]马 萍,孙淑英,辛艳茹.硝苯地平缓释微丸的体外释药机制[J]. 解放军药学学报,2003,19(6):424-426.
[16]马 燕,李卫中,葛月宾.海藻酸钙凝胶微丸体外释药机制的考察[J].中国药学杂志,2009,44(20):1564-1566.
[17]蒋慧明.海藻酸钙-壳聚糖胃漂浮缓释微丸的研究[D].重庆:重庆医科大学,2011.
[18]马 萍,祝 力,孙淑英,等.海藻酸钙凝胶微丸作为口服缓释给药载体的研究[J].沈阳药科大学学报,2001,18(6):406-408.
[19]张良珂,张 彦,田 睿,等.阿西美辛海藻酸钙凝胶微丸释药影响因素考察[J].中国医院药学杂志,2007,27(12):1671-1674.
[20]马 萍,孙淑英.一种新的缓释载体——海藻酸钙凝胶小球的研究概况[J].国外医药——合成药·生化药制剂分册,1998,19(3):190-92.
[21]Vasconcelos T,Sarmento B,Costa P.Solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs[J].Drug Discov Today,2007,12(23):1068-1075.
[22]Østberg T,Graffnet C.Calcium alginate matrices for oral multiple unit administration:III.Influence of calcium concentration,amount of drug added and alginate characteristics on drug release[J].Int J Pharm,1994,111(3):271.
[23]Østberg T,Graffnet C.Calcuim alginate matrices for oral multiple unit administration:Ⅳ.Pilot investigations of production method[J].Acta Pharm Nord,1992,4(4):201.
