羟基喜树碱/羟丙基-β-环糊精包合物凝胶骨架缓释片的制备及体外释放
2013-08-28宋文霞索绪斌邓妍芳黄旖旎
宋文霞, 索绪斌*, 邓妍芳, 黄旖旎, 张 涵
(1.广东药学院中药学院,广东广州 510006;2.广州市茗川生物科技有限公司,广东广州, 510006)
羟基喜树碱 (10-hydroxycamptothecine,HCPT)是我国特有的珙垌科乔木喜树种子中分离提取的一种纯天然微量生物碱[1],通过选择性抑制拓扑异构酶Ⅰ而干扰DNA的复制,具有高效低毒、广谱抗癌的特点[2],且与其他常用抗肿瘤药无交叉耐药性。临床用于膀胱癌、直肠癌、肝癌、胃癌、卵巢癌、白血病及头颈部肿瘤等,均具有非常好疗效[3-4]。羟基喜树碱由于水溶性差,生物利用度较低,临床上使用钠盐注射液,但由于其α-羟基内酯环易打开,表现出极低的抗拓扑异构酶Ⅰ的活性,限制了其在临床上的应用[5]。目前羟基喜树碱的制剂研究主要集中于片剂,胶囊,冻干粉针剂,纳米粒,脂质体,乳剂,固体分散体等剂型[6],其缓释制剂未见报道,对于难溶性药物缓释制剂而言,其最大的问题就是药物的释放。本项目为了改善羟基喜树碱缓释制剂的体外释放的行为,降低在中性环境中HCPT开环比例。本实验采用羟丙基-β-环糊精 (HP-β-CD)将药物包合后,然后制成羟基喜树碱/羟丙基-β-环糊精包合物(HCPT/HP-β-CD)凝胶骨架缓释片,可以有效保护HCPT结构中 E环上的 α-羟基内酯环[7],利用HP-β-CD对HCPT包合作用的增溶性[8-9],可以持续缓慢释放药物,达到《中国药典》对缓释制剂的技术要求。
1 实验材料
1.1 仪器 759MC紫外可见分光光度计 (上海菁华科技仪器有限公司),BSA124S电子天平 (北京赛多利斯仪器系统有限公司);PHS—3C pH计(上海仪电科学仪器股份有限公司);KQ5200B型超声波清洗器 (昆山市超声仪器有限公司);101—1AB型电热鼓风干燥箱 (天津市泰斯特仪器有限公司);CDR—4P型差示热分析仪 (上海精密仪器有限公司);ZRS—8G智能溶出测试仪 (天津市新天光分析仪器技术有限公司)。
1.2 试剂 10-羟基喜树碱 (HCPT)(成都天源天然产物有限公司,批号:120803,纯度>99.0%,高效液相面积归一法测定);HP-β-CD(湖北兴银河化工有限公司);N,N-二甲基甲酰胺 (天津市广成化学试剂有限公司);HPMC(上海卡乐康包衣技术有限公司);淀粉;糊精;微晶纤维素;微粉硅胶;硬脂酸镁;双蒸水;其他试剂均为分析纯。
2 方法与结果
2.1 标准曲线的制备
精密称取4.0 mg HCPT,置10 mL量瓶中,加0.1 mol/L NaOH溶液定容至刻度,作对照品贮备液。制备质量浓度分别为 0.04、0.02、0.01、0.005、0.002 5 g/L等一系列对照品溶液,以0.1 mol/L NaOH为空白溶液,用紫外可见分光光度计于420 nm处检测,以药物的质量浓度对吸光度(A)进行回归,得线性回归方程。HCPT线性回归方程为A=45.812C+0.141 7,相关系数r=0.996 8,结果表明在所选定的质量浓度范围内,其吸光度与质量浓度线性关系良好。线性范围为0.002 5~0.04 g/L。
2.2 HCPT/HP-β-CD 包合物的制备[10]
取10 mL小瓶加入适量的羟丙基-β-环糊精(HP-β-CD),用乙醇溶液使溶解,加入用少量的N,N二甲基甲酰胺溶解的HCPT溶液,滴入少许的冰醋酸,置于水浴超声中超声一定时间,取出置于蒸发皿中研磨至干,加入少量水溶液 (pH=4)研磨[11],微孔滤膜过滤,得澄清透明的溶液,即为HCPT/HP-β-CD包合物的水溶液,收集滤膜上未包合的游离药物,供测。
2.3 HCPT/HP-β-CD包合物包合率的测定
取滤膜上未包合的游离药物,置于10 mL量瓶中,加入0.1 mol/L NaOH溶液定容至刻度,溶液由无色变为黄色,以0.1 mol/L NaOH为空白溶液,用紫外可见分光光度计于420 nm处检测的药物吸光度 (A)。根据下面的公式计算其包合率 (inclusion rate,DR):
式中:W未包合为滤膜上未包合的游离HCPT的质量,W总为HCPT总质量。
2.4 均匀设计优化最优工艺处方
按照上述的HCPT/HP-β-CD包合物制备方法,经过多次单因子对比试验均匀设计实验的影响因素为N,N-二甲基甲酰胺用量 (A)、羟丙基-β-环糊精的用量 (B)、水的酸碱度 (C)、乙醇体积分数(D)、超声时间 (E)等五个因素,每个因素分10个水平。选用U10(108)均匀设计表安排实验方案,以包合率作为实验考察的指标,优选出最佳处方。
均匀设计得出的线性方程如下:Y=0.012 72-0.009 09X1+0.002 09X2-0.002 59X3+0.015 46X4+0.001 20X5-0.000 06X22,相关系数R2=0.955 7,其中X1,X2,X3,X4及X5分别为N,N-二甲基甲酰胺,HP-β-CD的用量,酸碱度,乙醇的体积分数及超声时间。根据该线性方程,最佳条件为N,N-二甲基甲酰胺用量是0.11 mL,HP-β-CD的用量是17.42 mg,pH为3.67,75%乙醇,超声时间是13 min。采取最佳工艺处方,制得的HCPT/HP-β-CD包合物的包合率达80%以上,达到预期目标。
2.5 HCPT/HP-β-CD 包合物的验证[12]
2.5.1 差示热验证试验 分别取 HCPT、HP-β-CD、包合物及二者的混合物进行差示扫描热分析,以Al2O3为参比,各样品约取5.0mg,量程为+30 μV,升温范围为30~300℃,升温速率为 10℃/min,作差热分析 (DSC)图谱,见图1。
各样品的差示热分析图表明,HCPT(d)在100、270℃左右各有一个峰分别是水峰和熔融峰,HP-β-CD(c)在70℃左右有一水峰,物理混合物(b)保持了HCPT的水峰和熔融峰,基本上是HCPT和HP-β-CD的叠加,包合物 (a)图谱上无HCPT的水峰和熔融峰。说明包合物已经形成。
2.5.2 红外光谱验证试验 分别取HCPT、HP-β-CD、包合物及二者的混合物适量,样品碘化钾压片后,做红外图谱 (IR),见图2。
由红外图谱可见,包合物 (b)和混合物 (a)的IR图谱明显不同,HCPT(d)的特征峰在包合物中不再显示,包合物 (b)的图谱和HP-β-CD(c)的图谱相似。结果说明 HCPT被 HP-β-CD包裹。

图1 HCPT/HP-β-CD包合物的差示热分析图Fig.1 DSC diagramme of HCPT/HP-β-CD inclusion

图2 HCPT/HP-β-CD包合物的红外光谱图Fig.2 Infra-red spectrogram of HCPT/HP-β-CD inclusion
2.6 包合物凝胶骨架缓释片的制备[13]
按照上述制作包合物的方法,根据均匀设计筛选出的最优处方制备出HCPT/HP-β-CD包合物溶液,再用研钵研磨使成糊状,置于烘干箱烘3~4 h,得白色干燥的粉末。取包合物粉末适量,加入8%羟丙甲纤维素 (HPMC K15)及其他一些如淀粉,糊精,微晶纤维素等辅料,分别过60目筛后,混合均匀,用75%乙醇溶液作润湿剂,混合湿法制备颗粒,过20目筛得均匀的颗粒,置于60℃干燥箱干燥5~6 h,过20目筛整粒,加入1%硬脂酸镁压片得包合物凝胶骨架缓释片。
2.7 片剂中的药物的体外释放[14]
配制溶出介质 (生理盐水)250 mL置于溶出杯中,调节转速为100 r/min,温度为37℃。当溶出杯中溶出介质的温度为37℃时。将精密称定质量的药片放入溶出杯中进行溶出,分别于0、0.25、0.5、1、1.5、2、3、5、7、9、11、13、15、17、19、21、23、25 h取样,每次取样5 mL(同时补充相同温度同体积溶出介质),加入0.1 mol/L NaOH溶液定容至10 mL,超声一定时间,使药物从HP-β-CD中完全释放,继续按照测定包合率的方法测吸光度,代入标准曲线,计算药物浓度和药物的累积释放百分率,制作溶出曲线,见图3。

图3 HCPT/HP-β-CD包合物及HCPT凝胶骨架缓释片的体外释放溶出曲线图Fig.3 In vitro release of HCPT/HP-β-CD inclusion and HCPT gel matrix sustained-release tablets
2.8 药物体外释药模型拟合与结果
2.8.1 药物体外释药模型拟合 关于药物的释放模型,人们做了大量的探究的研究,建立起诸多的模型体系。药物释放,方程是Fick扩散定律为基础而提出的,这些药物释放过程是在一些边界条件和假设的基础上得到的Fick扩散定律近视解,常见的药物释放模型如下:
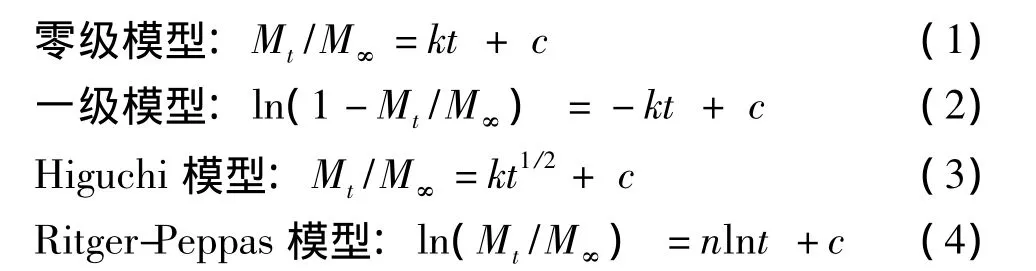
其中,t为时间,Mt为t时刻的药物释放量,M∞为最大药物释放量,Mt/M∞为t时刻的累计释放百分数;k是药物释放速度常数,随着不同药物或不同处方以及不同释放条件而变化;c为系数;n为释放常数,是表征释放机制的特征参数,与片剂的形状有关,对于圆柱形制剂,当n<0.45时,为Fick扩散;当0.45<n<0.89时,药物释放扩散与溶蚀协同作用;当n>0.89时,为溶蚀作用。
2.8.2 药物体外释药模型拟合结果 根据HCPT/HP-β-CD包合物及HCPT凝胶骨架缓释片的体外释放溶出曲线图,进行各个释放模型拟合,见图4和图5。
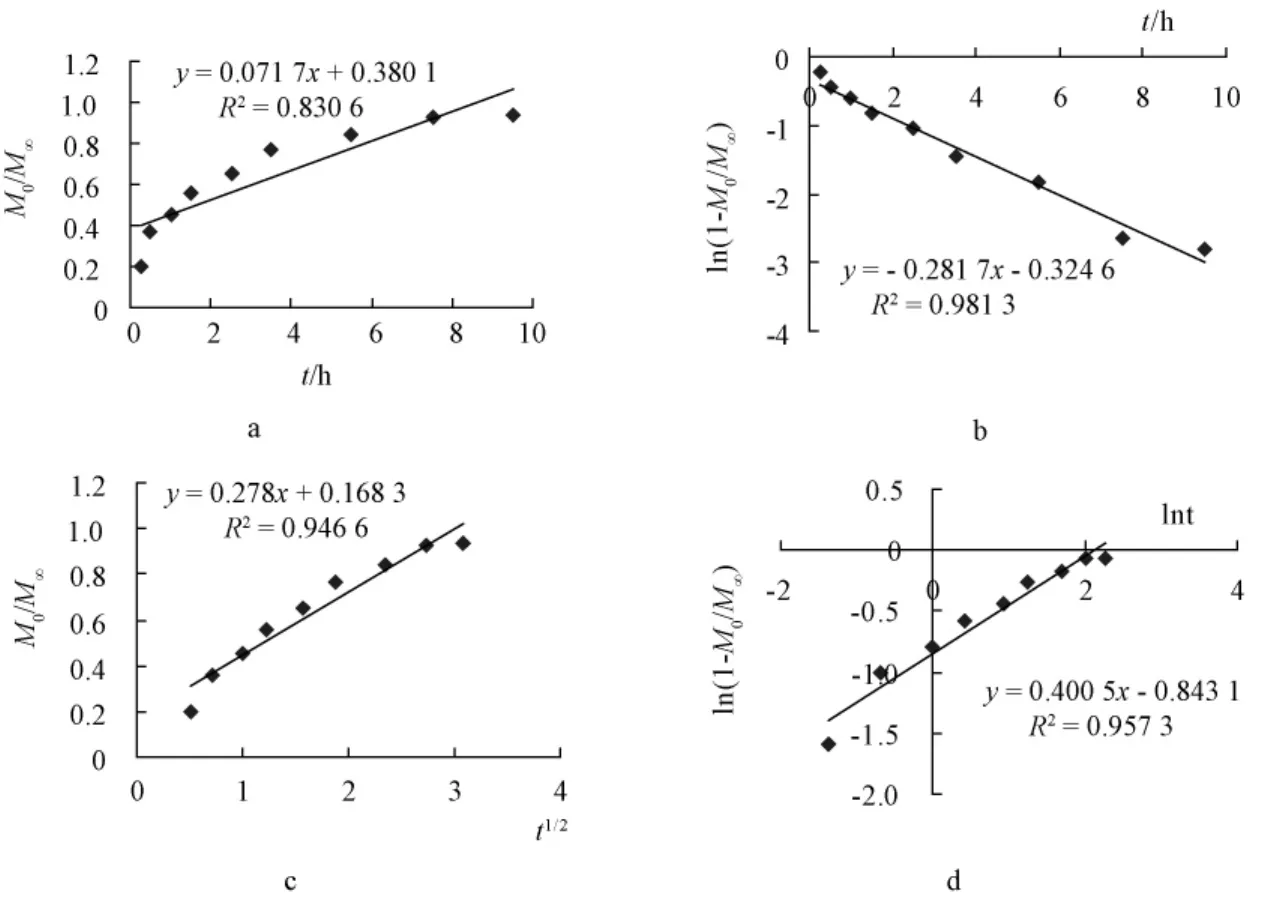
图4 HCPT/HP-β-CD包合物凝胶骨架缓释片体外释放模型拟合图Fig.4 In vitro release model fitting of HCPT/HP-β-CD inclusion gel matrix sustained-release tablets
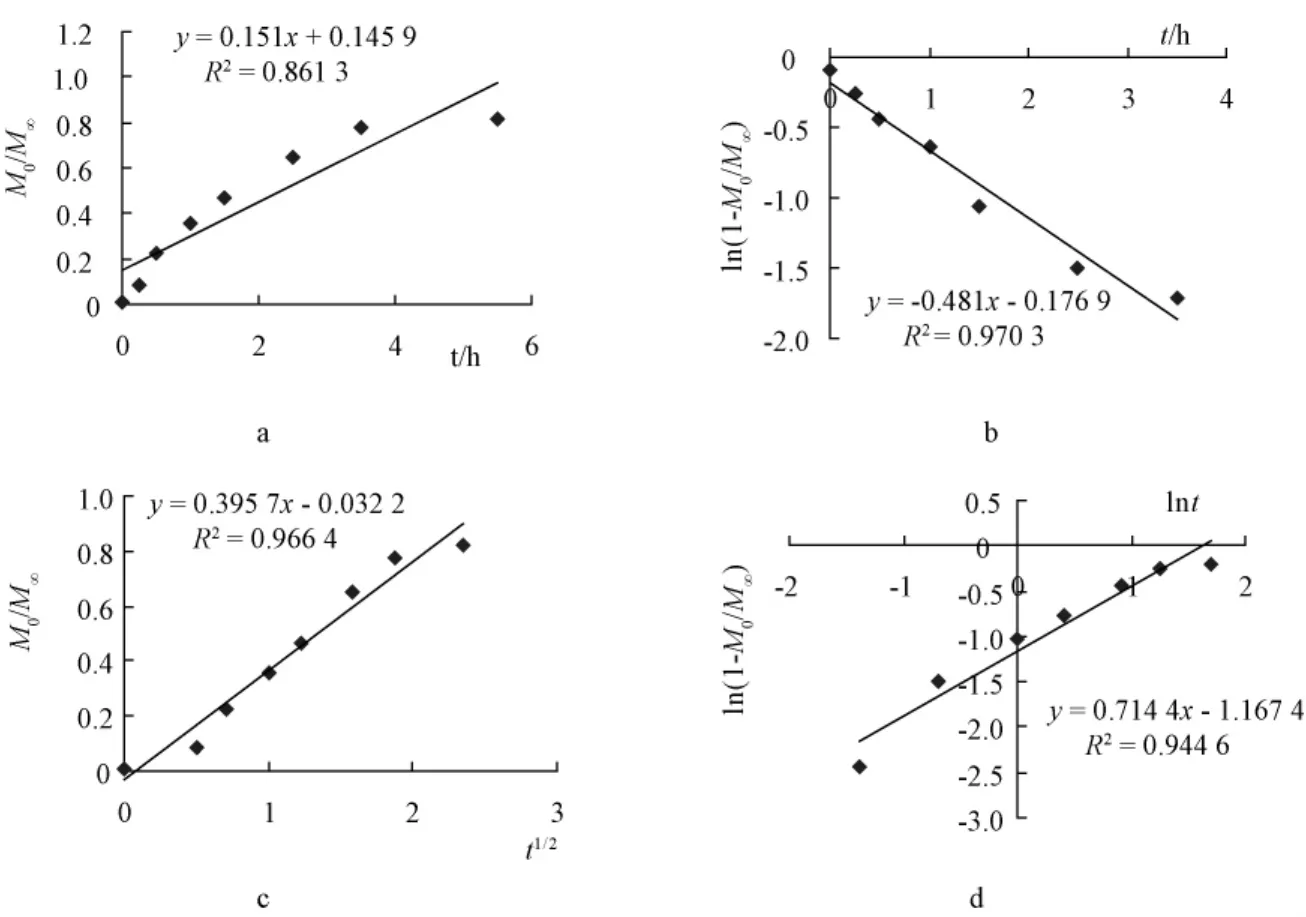
图5 HCPT凝胶骨架缓释片体外释放模型拟合图Fig.5 In vitro release model fitting of HCPT gel matrix sustained-release tablets

表1 包合物及游离药物的凝胶骨架缓释片体外释放模型拟合结果Tab.1 In vitro release model fitting of HCPT/HP-β-CD inclusion and HCPT gel matrix sustained-release tablets
由各模型结果可知,一级模型,Higuchi模型,Ritger-Peppas模型的释放度与时间有良好的相关性,以R值最大为优。由以上结果可见,两种缓释片的体外释放均为一级释放模型。HCPT/HP-β-CD包合物凝胶骨架缓释片的Ritger-Peppas体外释放模型拟合释放参数n=0.422 0<0.45,而HCPT凝胶骨架缓释片的Ritger-Peppas体外释放模型拟合释放参数为n=0.714 4,说明HCPT/HP-β-CD包合物凝胶骨架缓释片的体外释放为Fick扩散,而HCPT的凝胶骨架缓释片的体外释放符合药物释放扩散与溶蚀协同作用。
3 讨论
3.1 HCPT在酸性 (pH≤4.0)条件下主要以内酯的结构存在,在弱碱性条件下主要以开环结构存在,亲水性强;环糊精分子是略呈锥形的中空圆筒立体环状结构,在其空洞结构中,外侧上端 (较大开口端)由C2和C3的仲羟基构成,下端 (较小开口端)由C6的伯羟基构成,具有亲水性,空腔内由于受到C-H键的屏蔽作用形成了疏水区;因此适当的酸性环境有利于保护药物内酯结构,从而有利于药物HP-β-CD包合物的形成。
3.2 实验过程中包合物的制备方法采用了饱和水溶液法和超声波法相结合的方法,HCPT在水中基本不溶,加入N,N-二甲基甲酰胺可使之完全溶解成澄清溶液,加入高浓度的HP-β-CD溶液,溶液会轻微的浑浊,表示药物达到了过饱和,此时置于水浴超声中,有利于HCPT进入HP-β-CD疏水性空洞内,形成包合物。在对比N,N-二甲基甲酰胺与乙醇对药物溶解及最终形成包合效果而言,发现N,N-二甲基甲酰胺要明显优于乙醇,因此在本实验中选择N,N-二甲基甲酰胺作为药物的溶解剂。
3.3 在包合物缓释凝胶骨架片释放的过程中,对于释放出的药物检测,采取了碱性溶液加超声的方法,目的在于将药物完全从HP-β-CD释放出来。在前期验证的实验中,发现随着超声时间延长,样品紫外吸收值会增长,其原因可能是超声可以加速药物从包合物中出来进入强碱性溶液中,所以在HCPT/HP-β-CD包合物凝胶骨架缓释片释放检测的过程,超声环节必不可少。
3.4 HCPT/HP-β-CD包合物凝胶骨架片在本实验中能持续缓慢释放药物,而HCPT凝胶骨架片释放,药物释放为非漏槽条件,在释放介质中很快达到饱和,药物以游离分散于释放介质中。在检测中,由于取样有滤膜过滤,溶液中游离药物未能进入检测环节,HCPT/HP-β-CD包合物凝胶骨架片的药物释放量要明显高于单纯的HCPT凝胶骨架片。另外HCPT/HP-β-CD包合物凝胶骨架缓释片药物的释放遵循Fick扩散规律,而HCPT凝胶骨架缓释片的释放药物释放扩散与溶蚀协同作用。这可能与HP-β-CD的包合增强了药物的亲水性和水溶性有关。
[1]Zhang Ruiwen,Li Yufeng,Qiuyin Cai,et al.Preclinical pharmacology of the natural product anticancer agent 10-hydroxycamptothecin,an inhibitor of topoisomerase I[J].Cancer Chemother Pharmacol,1998,41(4):257-267.
[2]杨 眉,曾裕建.喜树碱及其衍生物的研究进展[J].现代医药卫生,2003,19(8):977-978.
[3]Zhou J J,Liu J,Xu B.Relationship between lactone ring forms of HCPT and their antitumor activities[J].Acta Pharmacol Sin,2001,22(9):827.
[4]李 苏,张 力,管忠震,等.羟基喜树碱片在肿瘤患者体内的绝对生物利用度[J].中国临床药理学杂志,2005,21(1):46-49.
[5]翁蝇美,胥 彬.喜树碱类抗癌物质对拓扑异构酶I的作用研究进展[J].肿 瘤,1991,11(2):74-77.
[6]齐 菲.羟基喜树碱剂型的研究进展[J].中国药业杂志,2005,14(9):93-94.
[7]周建军,刘 健,徐 斌.羟基喜树碱内酯形式与其抗癌活性的关系[J].中国药理学报,2001,22(9):827-830.
[8]马雪琴,董 琳,李国珊,等.环糊精的包合作用对羟基喜树碱活性内酯结构的保护[J].中国新药杂志,2010,19(14):1270-1274.
[9]宋金春,陈佳丽,黄 岭.2-羟丙级-β-环糊精对羟基喜树碱的增溶及稳定作用研究[J].中国药房,2008,19(4):269-272.
[10]周立国,魏凤玲.β-环糊精包和技术及应用[J].医学创新研究,2006,3(3):31-33.
[11]Greenwald R B,Choe Y H ,Wu D.Selective phenolic acylation of 10-hydroxycamptothecin using poly(ethylene glycol)carboxylic acid[J].Bioor Med Chem Lett,2003,13(3):577-580.
[12]马雪琴,任 勇,付雪艳.羟基喜树碱/羟丙级-β-环糊精包合作用研究[J].中国新药杂志,2007,16(17):1385-1387.
[13]崔福德.药剂学[M].北京:人民卫生出版社,2007,431-440.
[14]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:附录ⅩD.
