瘦素降低全反式维甲酸诱导的SH-SY5Y细胞tau蛋白过度磷酸化
2013-08-24邓子辉张金英郝秀华颜光涛
梁 辰,邓子辉,张金英,郝秀华,薛 辉,颜光涛
解放军总医院 基础所生化室,北京 100853
阿尔茨海默病(alzheimer disease,AD)是一种常见的神经退行性疾病,以进行性认知功能障碍为主要临床症状。临床病理研究发现AD患者的痴呆症状严重程度与脑组织中神经元纤维缠结(neurofibrillary tangles,NFTs)数量呈正相关,而NFTs的主要成分是过度磷酸化tau蛋白[1]。因此针对tau蛋白可能成为预防和治疗AD的理想途径。瘦素(leptin)是一种主要由脂肪组织分泌的分子量为16 kU的多肽。它由ob基因编码,含有167个氨基酸,而血液中的leptin是去掉N端21个氨基酸残基的信号肽后形成的146个氨基酸的多肽[2]。具有抑制食欲、增加能量消耗、促进脂肪分解、减轻体重等生物学功能。近年的研究发现,瘦素受体(ObR)在脑内广泛表达,分布在下丘脑、海马、小脑和大脑皮质等,瘦素作用于这些脑区可改变神经元或突触的结构、功能及其可塑性,影响神经元存活或增殖,并改善学习、记忆及其他认知功能[3-4]。本研究通过检测AD细胞模型中磷酸化tau蛋白水平的变化情况,探讨leptin与阿尔茨海默病的整体关系,以及leptin对磷酸化tau蛋白的调节作用。
材料和方法
1 材料 人神经纤维母细胞瘤细胞系SH-SY5Y(本实验室保存);DMEM培养基、胎牛血清、0.25%胰蛋白酶(Gibico);三羟甲基氨基甲烷(Tris)(北京益利精细化学品公司);Western Blot超敏发光液、RIPA裂解液、Trizol RNA提取试剂、BCA蛋白定量试剂盒(北京普利莱基因技术公司);一抗:p-tau(ser396)(sc-101815)、tau(TAU-5)(sc-58860)、Actin(sc-1616-R)、Ob-R(sc-8391)(Santa Cruz Biotechnology);二抗:山羊抗小鼠IgG/辣根酶标记、山羊抗兔IgG/辣根酶标记(北京中杉金桥公司)。Human Ob-Rb:94 ℃ 50 s,55 ℃ 50 s,72 ℃ 1 min,40循环,72 ℃ 10 min。Forward:5'-GCCAACAACT GTGGTCTCTC-3';Reverse:5'-AGAGAAGCACTTG GTGACTG-3'。内参GAPDH 246 bp,95 ℃ 50 s,54 ℃50 s,72 ℃ 1 min,30循环,72 ℃ 7 min。Forward:5'-CCCCTTCATTGACCTCAACTAC-3';Reverse:5'-G AGTCCTTCCAGGATACCAAAG-3'(北京赛百盛公司)。
2 MTT法检测ATRA浓度梯度对细胞活性的影响将SH-SY5Y消化、收获、计数,各组取5×104/ml细胞100 μl接种到96孔板,每组两列10个平行孔。加入ATRA浓度分别为5 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L,培养6 d后,每孔加入四甲基偶氮唑蓝(MTT,浓度为5 mg/ml)100μl,置于37 ℃、5% CO2孵箱中继续孵育4 h,弃上清,加入二甲基亚砜100 μl,震荡5 min,用酶标仪在570 nm处读取吸光度值(A值),取平均值为细胞增殖水平。
3 ATRA诱导AD模型的建立 培养SH-SY5Y细胞丰度达到60%,倒掉原有培养基,PBS冲洗3遍,加入含有ATRA(40 μmol/L)不含血清的DMEM培养基中,连续诱导6 d建立模型,加入leptin(0.5 μg/ml)作用12 h。
4 细胞形态学观察 将处于对数生长期的细胞以1×106个/孔种于6孔板中,ATRA诱导,分为对照组、模型组,分别于4 h、1 d、2 d、6 d时间点置于倒置显微镜下观察,并拍照。
5 RT-PCR检测Ob-Rb mRNA的表达 用Trizol RNA提取试剂抽提细胞中总RNA,以Ob-Rb引物在反转录酶作用下进行逆转录反应,随后进行33个循环的PCR扩增。同时,PCR扩增管家基因GAPDH作为参照。
6 Western Blot检测p-tau表达水平 用RIPA蛋白裂解液提取总蛋白,BCA法蛋白定量。蛋白上样量为30 μg,在质量分数为10%的PAGE上进行SDS-PAGE垂直电泳,电转移到硝酸纤维素(nitrocellulose,NC)膜上(100 V,1.5 h)。将NC膜放入封口塑料袋中,加入含5%脱脂奶粉(TBS/T溶解,下同),4 ℃封闭过夜后,将NC膜转入另一封口塑料袋中,分别在不同的膜中加入稀释好的一抗p-tau、Tau-5(各1∶1 000)。37 ℃孵育1 h,TBS/T漂洗NC膜3次,每次10 min。再向膜中加入辣根过氧化物酶标记的IgG抗体(1∶2 000),37 ℃孵育40 min,TBS/T漂洗NC膜3次,每次10 min。加入发光液,暗室曝光,使用凝胶扫描仪测其灰度值。使用软件计算p-tau灰度值比(p-tau 5/Tau-5),组间进行统计学分析。
7 统计学方法 采用Stata7.0软件进行统计学分析,数据以-x±s表示,组间比较用t检验, P<0.05为差异有统计学意义。
结 果
1 ATRA对细胞增殖活性的影响 MTT法检测SH-SY5Y细胞增殖水平显示,ATRA诱导组在40 μmol/L浓度下A值明显低于对照组(P<0.01),5、10、20 μmol/L ATRA诱导组A值差异无统计学意义(P>0.05),见图1。

图 1 MTT实验后各组A值(aP<0.01, vs control)Fig. 1 A value for each group after MTT assay(aP<0.01, vs control)
2 ATRA对SH-SY5Y细胞形态的影响 正常SHSY5Y细胞接种4 h时尚未分化,呈略圆形特征,并少见短形突起(图2A);贴壁生长后1 d展现出更类似于神经元的表型,大小不一,呈不规则形,圆形特征丢失,少见梭形(图2B);连续加入ATRA处理2 d,开始展现神经元的形态,即轴突开始生长(图2C);ATRA连续处理6 d,细胞呈现出成熟神经元的形态,轴突伸展并时而与相邻细胞连接(图2D)。

图 2 倒置显微镜下ATRA诱导前后细胞形态(200×)Fig. 2 Cell morphology before and after ATRA induction was observed by inverted microscope(200×)
3 ATRA诱导后ObRb mRNA表达变化 诱导组ObRb mRNA表达显著升高,提示AD模型建立后leptin发挥作用,见图3。
4 Leptin处理后p-tau蛋白表达变化 Western Blot结果显示,与空白对照组相比,ATRA诱导模型后p-tau蛋白表达水平明显增加(P<0.01),说明模型建立成功,加入leptin(0.5 μg/ml)作用12 h后,与模型相比有明显降低(P<0.01),见图4。
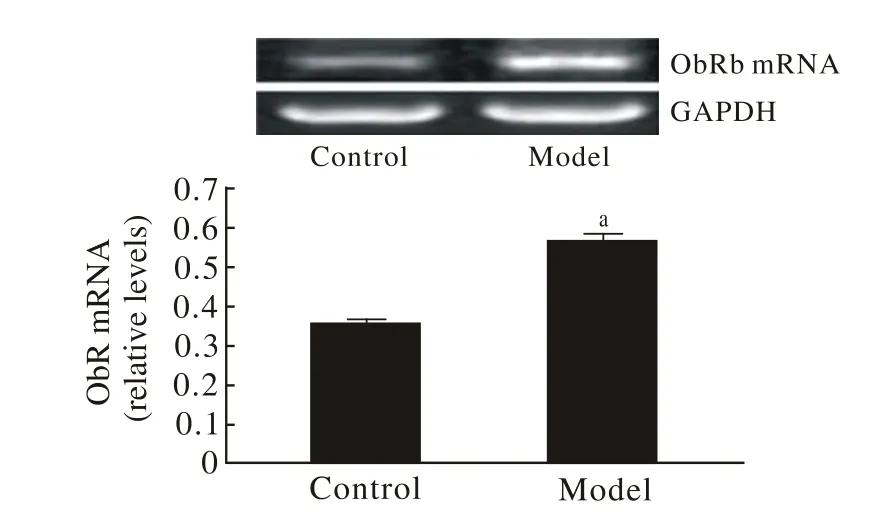
图 3 RT-PCR检测ObRb mRNA表达(P<0.01)Fig. 3 RT-PCR showing expression of ObRb mRNA(P<0.01)

图 4 Western Blot检测p-tau蛋白的表达(aP<0.01, vs control)Fig. 4 Western blot showing expression of p-tau protein(aP<0.01,vs model)
讨 论
神经纤维缠结(neurofibrillary tangles,NFTs)是AD的两种最为主要的病理特征之一,主要存在于患者的海马、杏仁核、前额叶等部位[5]。NFTs主要由过度磷酸化的tau蛋白聚集而形成,tau蛋白在亚细胞水平上主要定位于细胞质,大多在中枢神经系统区域神经元的轴突表达[6]。它通过与多种蛋白相互作用来行使其功能,例如tau蛋白可以结合并稳定微管系统,可提高体外培养神经元突触的生长速率和范围。
Tau有着不同的聚集状态,其中可溶性的寡聚体比大分子、不溶性的高度成纤维聚集体更具致病性[7]。Tau蛋白可以被多种蛋白激酶磷酸化,例如:AMP活化的蛋白激酶、应激活化的蛋白激酶、糖原合成酶激酶3、细胞周期依赖性蛋白激酶5、促分裂原活化的蛋白激酶、酪蛋白激酶、钙/钙调蛋白依赖蛋白激酶Ⅱ、微管亲和调控蛋白激酶、蛋白激酶A等[8]。迄今为止,围绕关注于tau蛋白的异常磷酸化以及tau与AD之间的关系的研究逐渐深入,干扰tau蛋白的过度磷酸化被认为是神经退行性疾病治疗的关键[9]。
瘦素主要由白色脂肪组织分泌,通过下丘脑来调节新陈代谢、摄食、能量平衡等生理活动。Vannucci等[10]研究发现db/db小鼠与正常小鼠比较其大脑体积明显缩小,并伴有神经元密度减低和功能下降,提示leptin可能参与神经系统生理活动。
本研究中,检测到细胞瘦素受体(ObRb)mRNA表达升高,提示leptin可能在此损伤中发挥直接的作用;在给予外源性leptin作用后,检测到p-tau蛋白水平也显著降低,提示leptin可能通过降低p-tau蛋白的表达对AD起到改善作用。从而认为leptin可能作为阿尔茨海默病治疗的新靶点,其作用机制值得深入研究。
1 张松江,王建人,邬力祥. 阿尔茨海默病中的β-淀粉样蛋白和Tau蛋白[J].生命的化学,2012,32(3):254-258.
2 Malendowicz LK, Rucinski M, Belloni AS, et al. Leptin and the regulation of the hypothalamic-pituitary-adrenal axis[J]. Int Rev Cytol, 2007, 263:63-102.
3 Morrison CD. Leptin signaling in brain: A Link between nutrition and cognition?[J]. Biochim Biophys Acta, 2009, 1792(5): 401-408.
4 Moult PR, Harvey J. Hormonal regulation of hippocampal dendritic morphology and synaptic plasticity[J]. Cell Adh Migr, 2008, 2(4):269-275.
5 王维治.神经病学[M].北京:人民卫生出版社,2007:1397-1405.
6 Cleveland DW, Hwo SY, Kirschner MW. Physical and chemical properties of purified tau factor and the role of tau in microtubule assembly[J]. J Mol Biol, 1977, 116(2): 227-247.
7 Morris M, Maeda S, Vossel K, et al. The many faces of tau[J].Neuron, 2011, 70(3): 410-426.
8 王建枝,田青.Tau蛋白过度磷酸化机制及其在阿尔茨海默病神经元变性中的作用[J].生物化学与生物物理进展,2012,39(8):771-777.
9 靳慧,张英东,杨霞,等.tau蛋白相关阿尔茨海默病治疗进展[J].中国老年学杂志,2012,32(6):1308-1310.
10 Vannucci SJ, Gibbs EM, Simpson IA. Glucose utilization and glucose transporter proteins GLUT-1 and GLUT-3 in brains of diabetic (db/db) mice[J]. Am J Physiol Endocrinol Metab, 1997, 272(2 Pt 1):E267-E274.
