36株多重耐药鲍曼不动杆菌对氨基糖苷类药物耐药基因的流行病学研究
2013-08-23邢丽丹糜祖煌徐鑫鑫田莎莎原鸿雁纪晓昀苏兆亮许化溪
邢丽丹,糜祖煌,徐鑫鑫,汪 汀,田莎莎,原鸿雁,张 盼,纪晓昀,苏兆亮,许化溪
2.江苏省无锡市克隆遗传技术研究所。
鲍曼不动杆菌是一类医院常见的不发酵糖革兰阴性杆菌,属条件致病菌。在人类,鲍曼不动杆菌可定植于皮肤、伤口、呼吸道和消化道,在免疫力低下时可感染机体发病[1]。近年来由于抗菌药物的大量使用和各种侵袭性诊疗操作的实施,鲍曼不动杆菌的检出率和耐药率越来越高,甚至在一些科室呈暴发流行,引起了临床和实验室医师的广泛关注。鲍曼不动杆菌具有自动上调或主动获得耐药决定因子的能力[2],其耐药性正在逐年的增高,而且临床感染多以多重耐药菌株为主,对临床治疗带来了极大的困难和挑战。对于感染鲍曼不动杆菌患者的治疗通常采用β内酰胺类、氨基糖苷类和氟喹诺酮类抗菌药物,但随着这些抗菌药物使用的增加,耐药菌株越来越多。为了解本地区鲍曼不动杆菌的流行和耐药情况,本研究对江苏大学附属医院和镇江市第一人民医院于2012年8—11月分离的多重耐药鲍曼不动杆菌的氨基糖苷类耐药基因aac(3)-I、aac(6’)-Ib、aph(3’)和16S rRNA甲基化酶基因armA 进行了检测,旨在为临床氨基糖苷类抗生素的合理应用提供参考。现将结果报道如下。
材料与方法
一、材料
临床分离的36株鲍曼不动杆菌均来自2012年8—11月江苏大学附属医院和镇江市第一人民医院36例住院患者的临床样本,剔除同一患者同一部位重复分离的菌株。患者男26例,女10例,年龄9~93岁。样本分布为:痰液34份,静脉置管1份,腹水1份。
二、方法
(一)药物敏感试验 采用K-B纸片扩散法测定多重耐药鲍曼不动杆菌对抗菌药物的敏感性,MH琼脂和药敏纸片分别为博赛生物科技有限公司和OXOID公司产品,以大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC27853作为质控菌株,并根据2010年版CLSL标准判断药敏试验结果。
(二)细菌处理 挑选纯培养菌落置入0.5 mL离心管内(内置50μL裂解液和蛋白酶K的混合物),PCR仪上55℃1 h(消化细菌菌体)后95℃10 min(破坏裂解液内的蛋白酶K),然后每管补充200μL纯水,即为DNA模板液,置于-20℃冰箱保存备用。
(三)基因检测 PCR法检测氨基糖苷类耐药基因,靶基因引物序列见表1。
PCR扩增体系为:每反应体系P1、P2引物各0.5μmol/L,dNTPs各200 mmol/L,KCl 10 mmol/L,(NH4)2SO48 mmol/L,MgCl22 mmol/L,Tris-HCl(pH9.0)10 mmol/L,NP400.5%,BSA0.02%,Taq DNA pol 1 u。总反应体积20μL(其中模板液5μL)。PCR扩增热循环参数为:93℃预变性2 min,然后93℃60 s→55℃60 s→72℃60 s,循环35个周期,最后72℃延长2 min。耐药基因检测试剂盒、靶基因PCR引物序列和阳性对照DNA由无锡市克隆遗传技术研究所提供。扩增产物经2%琼脂糖凝胶电泳后,在紫外凝胶电泳成像仪下观察,并记录结果。
(四)基因测序 PCR扩增产物在美国应用生物系统公司提供的ABI3730型毛细管全自动测序仪上测序,委托上海翰宇生物技术有限公司完成。
(五)序列比对分析 应用Chromas读序工具软件,测序结果用Chromas直接作BLAST(http://www.ncbi.nlm.nih.gov/BLAST )比对。

表1 靶基因PCR引物序列及终产物长度Table 1 Target genes and the primers used in PCR assay
结 果
一、药物敏感试验
多重耐药鲍曼不动杆菌是指对5类抗菌药物中的3类及以上耐药,包括氨基糖苷类、β内酰胺酶抑制剂、头孢菌素类、碳青霉烯类和氟喹诺酮类抗菌药物。36株多重耐药鲍曼不动杆菌的药物敏感试验结果见表2。
二、氨基糖苷类修饰酶基因检测
氨基糖苷类乙酰转移酶(acetyltransferase)基因aac (3)-1、aac (6′)-1b、磷酸转移酶(phosphotransferase)基因aph(3′)-1和16S rRNA 甲基化酶(16S rRNA methylase)基因armA 均有不同程度的检出,aph(3′)-1和armA 阳性率较高。氨基糖苷类修饰酶基因检测结果见表3。
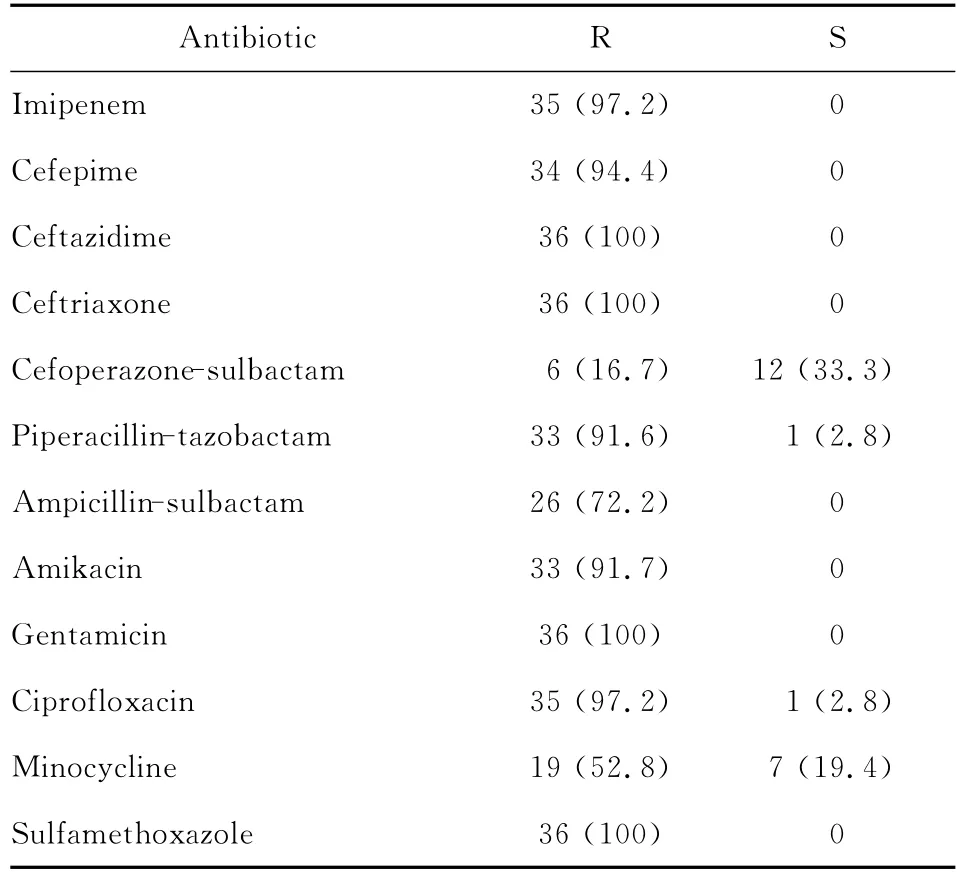
表2 36株多重耐药鲍曼不动杆菌药敏试验结果[n(%)]Table 2 Results of susceptibility testing of the 36 multidrug-resistant strains of Acinetobacter baumannii[n (%)]

表3 36株多重耐药鲍曼不动杆菌氨基糖苷类耐药基因结果[n(%)]Table 3 The prevalence of aminoglycoside-resistant genes in the 36 multidrug-resistant strains of Acinetobacter baumannii[n (%)]
对4种基因的PCR扩增产物进行DNA测序,并进行BLASTn比对分析,结果与GenBank中已注册的序列一致,同源性均≥99.0%。
讨 论
鲍曼不动杆菌是典型的条件致病菌,在医院特别是ICU常呈暴发流行[3]。鲍曼不动杆菌感染主要发生在免疫力低下的患者。常见的危险因素有长期住院尤其为长期入住ICU、多器官损害、中心静脉或动脉置管的使用、导尿管的使用、辅助通气、血液透析、急症腹部手术、肠道定植、胃造口术或空肠造口术管的使用和先前使用过任何抗菌药物等[1]。随着鲍曼不动杆菌感染患者的增多,抗菌药物的应用进一步导致了多重耐药甚至泛耐药鲍曼不动杆菌的出现。细菌对抗菌药物的耐药主要是由于耐药基因表达的各类水解酶。目前用于治疗鲍曼不动杆菌的主要抗菌药物有5类,包括头孢菌素类(头孢他啶和头孢吡肟等),碳青霉烯类(亚胺培南和美罗培南),酶抑制剂复方(哌拉西林-他唑巴坦),氟喹诺酮类(环丙沙星和左氧氟沙星)和氨基糖苷类(庆大霉素和阿米卡星)。多重耐药甚至泛耐药菌株的出现提示了菌株耐药机制的多样性。诸多文献报道了鲍曼不动杆菌的不同耐药机制。外排泵基因的表达在多重耐药鲍曼不动杆菌中发挥重要的作用[4]。外排泵的5类超家族在鲍曼不动杆菌中最流行的是能够外排很多抗菌药物的RND泵的过表达,主要是AdeABC基因的过表达[4],鲍曼不动杆菌Ade C能泵出的药物包括β内酰胺类、氨基糖苷类、红霉素、氯霉素、四环素类、氟喹诺酮类、甲氧苄啶和溴乙啶[5]。插入序列ISAbal的发现使碳青霉烯类、头孢菌素类等耐药基因高表达而导致鲍曼不动杆菌耐药[3,6]。
氨基糖苷类抗生素对不发酵糖革兰阴性杆菌、肠杆菌科及一些革兰阳性球菌均有很好的抗菌活性,与β内酰胺类抗生素联用有协同抗菌作用,在感染治疗中占有重要地位。氨基糖苷类抗生素是通过抑制蛋白与16S rRNA合成和破坏细菌细胞膜的完整性的氨基环多醇杀死细菌[7],其中主要耐药机制是产生氨基糖苷类修饰酶[8-9]。氨基糖苷类修饰酶主要包括3类作用机制各不相同的酶:乙酰转移酶修饰依赖于乙酰辅酶A的N-乙酰化,磷酸转移酶修饰依赖于ATP的O-磷酸化,核苷酸转移酶修饰依赖于ATP的腺苷化,降低了它们对核糖体亚单位的亲和力[8,10]。氨基糖苷类修饰酶经常在流动元素中编码,如质粒、转座子和整合子,它们大都隐藏在不分类的额外的耐药决定簇如ESBLs和MBLs中[8,10]。在鲍曼不动杆菌中,所有主要的氨基糖苷类修饰酶都有报道,用I类整合子编码氨基糖苷类修饰酶的基因的存在在多重耐药鲍曼不动杆菌中非常流行[11-12]。最近的研究报道了鲍曼不动杆菌中质粒介导的16S rRNA甲基化作用,这种机制可以使鲍曼不动杆菌对所有的氨基糖苷类抗生素耐药[13]。氨基糖苷类抗生素通过作用于细菌核糖体30S亚基的16S rRNA高度保守的A位点,干扰细菌蛋白质的合成,从而引起细菌死亡,而质粒介导的16S rRNA甲基化酶能够保护细菌的30S核糖体的16S rRNA不与氨基糖苷类药物结合,造成对氨基糖苷类药物的高水平耐药。
多重耐药鲍曼不动杆菌医院感染患者常有基础疾病,或曾接受广谱抗生素治疗。本研究36株多重耐药鲍曼不动杆菌大部分来自ICU,其次有呼吸内科、老年科等。药敏试验结果反映了本组多重耐药鲍曼不动杆菌的耐药情况相当严重,对亚胺培南、头孢吡肟、头孢他啶和头孢曲松的耐药率均在94.0%以上,对头孢哌酮-舒巴坦的耐药率相对较低(16.7%),可能是因为头孢哌酮和舒巴坦联合使用,舒巴坦抑制了β内酰胺酶对头孢哌酮的破坏,增强头孢哌酮的抗菌活性,而对庆大霉素的高耐药率与氨基糖苷类耐药基因有关[1]。armA为16S rRNA甲基化酶,有报道表明鲍曼不动杆菌的双圈耐药现象与armA基因诱导型表达有关[14]。氨基糖苷类耐药基因在安徽合肥、浙江宁波、上海、山东泰安、天津、湖南岳阳、江西南昌等很多地区的鲍曼不动杆菌中广泛存在[14-20],与鲍曼不动杆菌对氨基糖苷类酶的耐药关系密切。本研究在一定程度上反映了镇江地区鲍曼不动杆菌的耐药情况比较严重,多重耐药甚至泛耐药鲍曼不动杆菌的出现提示该菌将是感染治疗中的重点和难点。因此,合理使用抗菌药物是控制耐药菌医院感染的重要手段,也是目前医院感染研究的重要课题。
[1] 李朋玲,蔡培泉,糜祖煌.鲍曼不动杆菌β-内酰胺类抗生素耐药机制研究近展[J].中华临床感染病杂志,2012,5(4):247-252.
[2] Hu WS,Yao SM,Fung CP,et al.An OXA-66/OXA-51-Like carbapenemase and possibly an effux pump are associated with resistance to imipenem in Acinetobacter baumannii[J].Antimicrob Agents Chemother,2007,51(11):3844-3852.
[3] Corvec S,Poirel L,Naas T,et al.Genetics and expression of the carbapenem-hydrolyzing oxacillinase gene blaOXA-23 in Acinetobacter baumannii[J].Antimicrob Agents Chemother,2007,51(4):1530-1533.
[4] Coyne S,Courvalin P,Périchon B.Efflux-mediated antibiotic resistance in Acinetobacter spp[J].Antimicrob Agents Chemother,2011,55(3):947-953.
[5] Ruzin A,Keeney D,Bradford PA.AdeABC multidrug effux pump is associated with decreased susceptibility to tigecycline in Acinetobacter calcoaceticus-Acinetobacter banmannii complex[J].J Antimicrob Chemother,2007,59(5):1001-1004.
[6] Héritier C,Poirel L,Nordmann P.Cephalosporinase overexpression resulting from insertion of ISAba1in Acinetobacter baumannii[J].Clin Microbiol Infect Dis,2006,12(2):123-130.
[7] Shakil S,Khan R,Zarrilli R,et al.Aminoglycosides versus bacteria-a description of the action,resistance mechanism,and nosocomial battleground[J].J Biomed Sci,2008,15(1):5-14.
[8] Poole K.Aminoglycoside resistance in Pseudomonas aeruginosa [J].Antimicrob Agents Chemother,2005,49(2):479-487.
[9] Mingeot-Leclercq MP,Glupczynski Y,Tulkens PM.Aminoglycosides:activity and resistance[J].Antimicrob Agents Chemother,1999,43(4):727-737.
[10] Strateva T,Yordanov D.Pseudomonas aeruginosa-aphenomenon of bacterial resistance[J].J Med Microbiol,2009,58(Pt 9):1133-1148.
[11] Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Microbiol Rev,2008,21(3):538-582.
[12] Nemec A,Dolzani L,Brisse S,et al.Diversity of aminoglycoside-resistance genes and their association with class 1 integrons among strains of pan-European Acinetobacter baumannii cloes[J].J Med Microbiol,2004,53(Pt 12):1233-1240.
[13] Doi Y,Adams JM,Yamane K,et al.Identical of 16S rRNA methylase-producing Acinetobacter baumannii clinical strains in North America[J].Antimicrob Agents Chemother,2007,51(11):4209-4210.
[14] 汪鹏程,蔡俊,闫敏,等.鲍曼不动杆菌对氨基糖苷类药物耐药及其携带基因的探讨[J].国际检验医学杂志,2012,33(10):1155-1156.
[15] 陈琳,蔡挺,张顺,等.鲍曼不动杆菌氨基糖苷类修饰酶和I类整合酶基因研究[J].中国抗生素杂志,2008,33(1):34-40.
[16] 奚俊,应春妹.耐氨基糖苷类抗生素鲍曼不动杆菌中armA和rmtB甲基化酶基因的检测[J].中国感染与化疗杂志,2010,10(3):209-212.
[17] 姜梅杰,冯莉,张福森.多重耐药鲍曼不动杆菌中氨基糖苷类修饰酶基因及qacEΔl基因的研究[J].中华临床医师杂志,2012,6(11):3062-3064.
[18] 卓启芳,葛庚芝,毕玲,等.对下呼吸道感染鲍曼不动杆菌氨基糖苷类耐药基因检测[J].天津医科大学学报,2012,18(3):385-391.
[19] 易敏,姜习新.鲍曼不动杆菌16S rRNA甲基化酶基因和氨基糖苷类修饰酶基因检测及作用研究[J].实用预防医学,2012,19(4):605-607.
[20] 刘晓庆,陈娇,李华,等.鲍曼不动杆菌质粒上氨基糖苷类耐药基因的研究[J].中国抗生素杂志,2012,37(5):335-356.
