腰椎后路融合内固定术后早期深部感染的因素分析及治疗
2013-08-23毕连涌柳根哲李鹏洋
俞 兴,徐 林,毕连涌,柳根哲,李鹏洋,曲 弋,焦 勇
随着脊柱内固定疗法的快速发展,后路固定融合技术已广泛用于腰椎退行性病变、畸形、骨折及肿瘤转移等疾病,其优点可提供即刻稳定、矫正畸形、利于患者早期活动等,但潜在的风险如内固定失败、神经并发症、感染也随之出现。腰椎后路固定融合术后早期深部感染发生率相对较低[1],但早期内置物周围深部切口感染的处理十分棘手[2]。本研究旨在分析术后早期深部感染的特点、感染风险因素、处理方法及结果,探讨腰椎后路融合内固定术后早期深部切口感染的预防和治疗策略。
材料与方法
一、一般资料
2003年1月—2011年12月,我院共1 492例患者行腰椎后路融合内固定术,男702例、女790例,年龄11~83岁,平均(62.5±15.6)岁,其中腰椎退行性病变1 128例、腰椎骨折163例、腰椎畸形及侧弯107例、腰椎肿瘤94例。临床资料收集分析内容包括:术前状况(营养状况、合并症情况、用药情况、腰椎手术史、吸烟史);术中情况(手术时间、出血量、手术融合节段);术后情况(体温变化、伤口状况、血液相关的实验室检查结果)。根据是否发生感染将患者分为两组:感染组11例,非感染组1 481例。感染组男6例、女5例,年龄28~73岁,平均(55.5±16.3)岁,术前状况及术中情况见表1。
术后30 d内发生的感染归为早期感染,感染的诊断主要依据症状、体征、实验室检查、伤口分泌物及术中清创组织培养。深部感染,指感染累及深筋膜以下肌层、椎管硬膜外及内置物周围的蜂窝织炎和(或)脓肿形成。
二、感染风险因素评分(infection risk factor score,RFS)
将术前服用类固醇激素、免疫抑制剂、糖尿病、营养不良、返修手术、长期吸烟史(≥20支/d,持续5年以上)、既往其他部位或器官反复感染史、类风湿性关节炎病史、肥胖(体重指数>30)、手术时间≥6 h、术中出血量≥1 200 mL等11个因素确定为感染风险因素[3],每个因素记1分,对患者进行RFS。
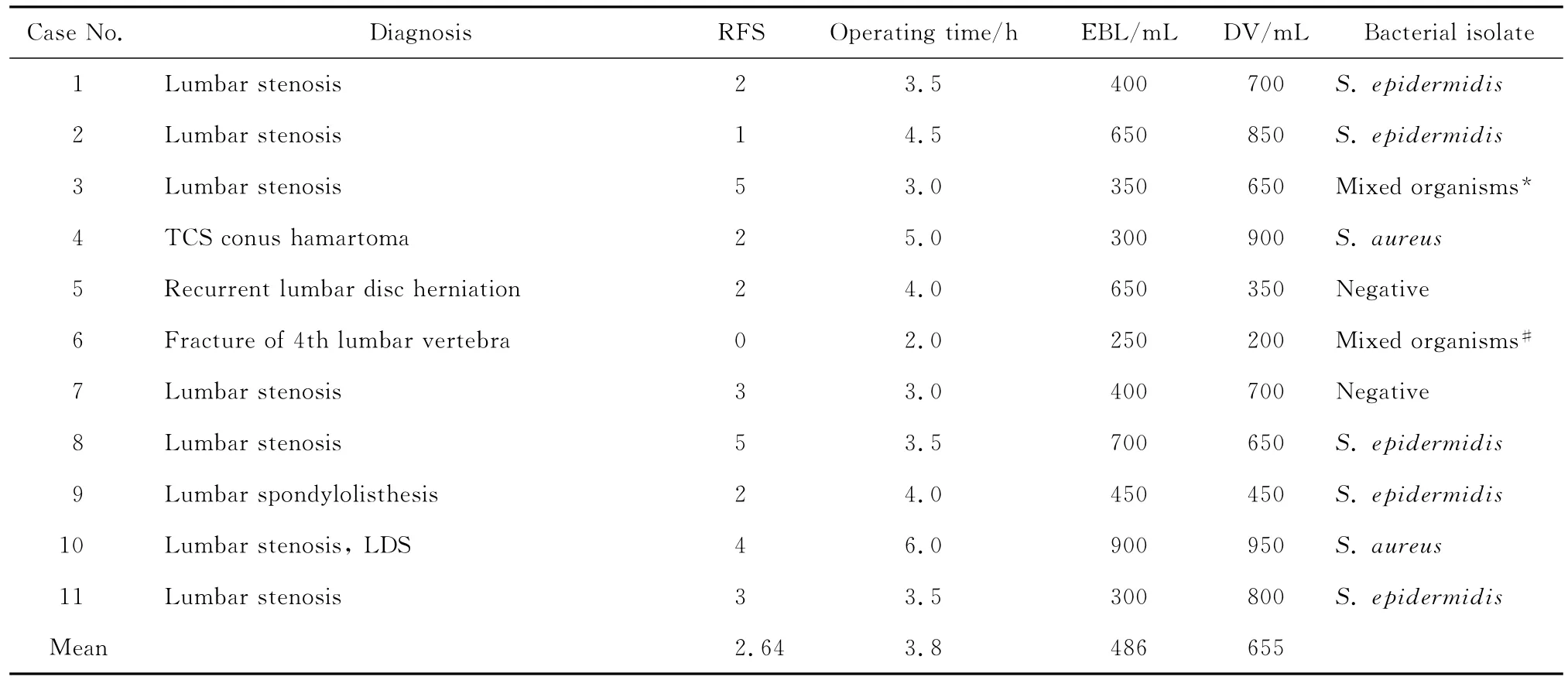
表1 腰椎后路融合内固定术后早期深部感染病例一般资料及手术情况Table 1 Clinical characteristics and surgical data in 11 patients with postoperative early deep infection after instrumented lumbar posterior spinal fusion
三、治疗方法
术前、术中取伤口深部分泌物和感染深部组织标本送检培养,为避免标本污染,送检样本均在清创冲洗后无菌操作下留取,并多部位、多次留样送检。所有早期感染患者一经诊断,即刻清创,清创切口应涵盖原手术切口全长,术中见脓液聚集在手术区域,常累及内置物周围,内置物表面无生物膜形成,彻底清除脓液、坏死组织及炎性肉芽组织,大量生理盐水、双氧水、稀释络合碘反复冲洗,更换手术器械和手套后,各置1根冲洗管和负压引流管,术后生理盐水溶液持续冲洗引流,清创术后早期2~3 d,引流液内仍有坏死或炎性组织,冲洗液要成流,每日约12 000~15 000 mL,引流物清亮后冲洗速度控制在40滴/min左右。冲洗引流液每2~3天做细菌培养,连续3次细菌培养阴性时先拔除冲洗管,引流管1 d后拔除。因术后早期感染的病原体常为一些毒力高的细菌,如金葡菌、表皮葡萄球菌(表葡菌)和一些需氧革兰阴性杆菌,故术后先静脉滴注抗菌谱涵盖术后早期感染常见病原菌的广谱抗生素(第三代头孢菌素类),再根据细菌培养结果改为敏感抗菌药物(万古霉素0.5 g静脉滴注,每6小时1次,连续1周,第2周改为0.5 g静脉滴注,每8小时1次,随后0.5 g静脉滴注,每12小时1次 ,直至停药),若细菌培养阴性则选用抗菌谱涵盖术后感染常见病原菌的第三代头孢菌素,静脉抗菌药物持续至拔除引流管后红细胞沉降率、C反应蛋白、血常规、体温等指标恢复正常及伤口愈合后3~7 d,改为口服抗菌药物(利福平0.45 g每日2次)6周。持续冲洗时间为14~25 d。其中2例患者一期清创同时取出内置物,3例清创联合持续冲洗仍无法控制感染,再次清创时取出内置物。
四、统计学分析
两组RFS用均数±标准差表示,通过SPSS 11.0统计软件进行秩和检验,P<0.05为差异有统计学意义、P<0.01为差异有显著统计学意义。
结 果
一、临床特点
1492例腰椎后路融合内固定术后早期深部感染11例(0.74%),术后5~22 d(平均9.5 d)出现发热或体温下降后再次升高,腰痛症状明显加重、平卧困难,伤口局部红肿、皮温增高、渗出淡血性增多进而部分裂开出现脓性分泌物。实验室检查白细胞计数升高(13~24)×109/L、中性粒细胞分类增高(0.74~0.92)、红细胞沉降率55~132 mm/h、C反应蛋白32~186 mg/L,分泌物或清创术中脓液培养5例为表葡菌、2例为金葡菌、1例表葡菌和阴沟肠杆菌复合感染、1例金葡菌和大肠埃希菌复合感染、2例阴性,见表2。感染组与非感染组RFS分别为2.64±0.24和 0.78 ±0.55,差异有统计学意义(P=0.032)。
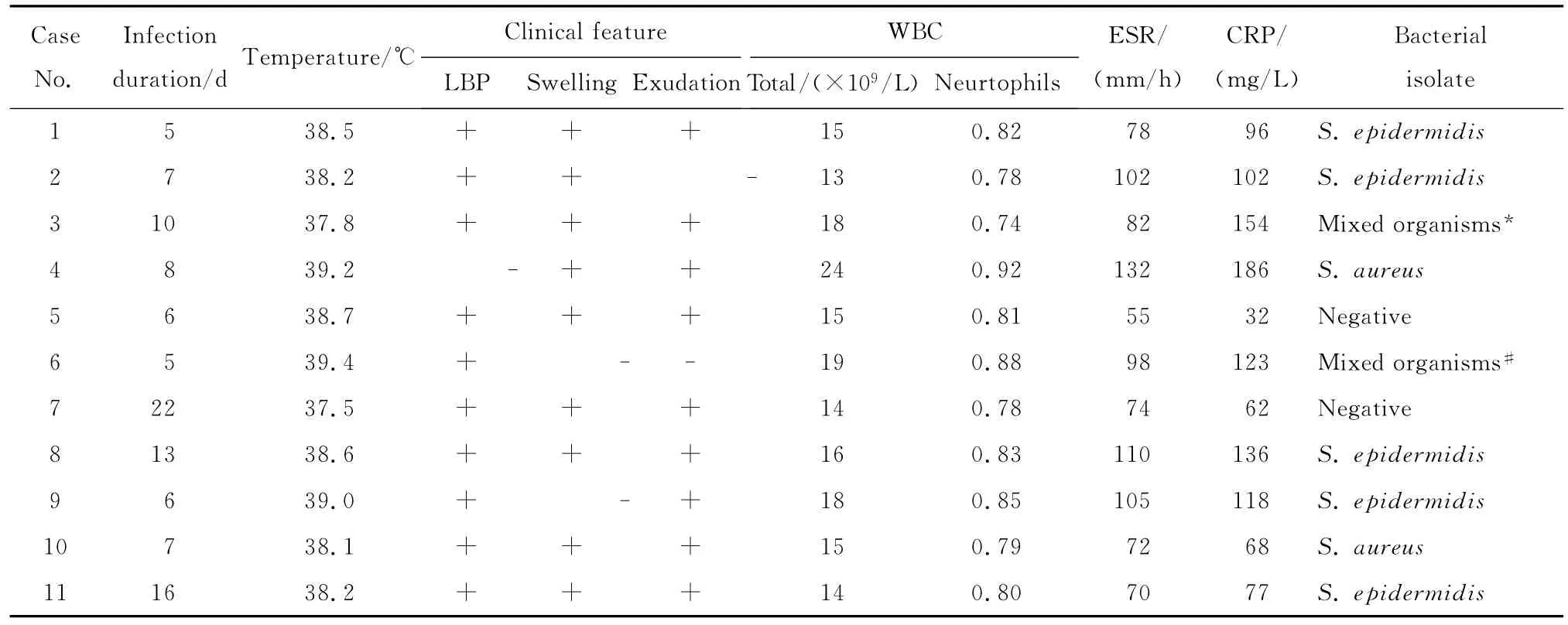
表2 腰椎后路融合内固定术后早期深部感染病例的感染相关临床资料Table 2 Infection related clinical data of the patients with postoperative early deep infection after instrumented lumbar posterior spinal fusion
二、治疗结果
9例保留内置物情况下采用彻底清创、持续冲洗负压引流结合静脉滴注抗菌药物治疗成功6例,这6例持续冲洗14~25 d(平均17.2 d),伤口清创后一期愈合(清创后2周拆线);其余3例2次清创内固定取出后持续冲洗负压引流结合静脉滴注抗菌药物治疗,2例感染彻底控制,1例伤口愈合后1个月因血液感染继发颅内感染、感染性休克死亡。2例术前长期口服激素、RFS分别为5分和4分,彻底清创同时取出内固定、持续冲洗(分别为18 d和24 d)负压引流结合静脉滴注抗菌药物(分别应用21 d和27 d),感染彻底控制。除死亡患者外,其余患者随访时间8~95个月,无感染复发。
讨 论
一、腰椎后路融合内固定术后早期深部感染的因素分析
腰椎后路融合内固定术后早期深部感染是脊柱手术严重并发症之一,与迟发感染相比,因涉及内置物是否即刻取出、若必须取出时如何维持腰椎稳定达到骨性融合等问题,处理起来相对比较棘手[2]。择期腰椎后路融合内固定术后早期深部切口感染的危险因素,可分为患者相关因素和手术相关因素两类。患者相关因素包括:糖尿病、营养不良、类风湿关节炎、长期类固醇激素服用史、长期免疫抑制剂服用史、肥胖、既往其他部位或器官反复感染史、吸烟史、返修手术等;手术相关因素包括:手术时间过长、术中失血量大等。本研究结果显示,两组RFS差异有统计学意义。因此,在进行腰椎后路融合手术前,对RFS高的患者应高度关注术后感染的可能,纠正营养不良、维持血糖平稳、戒烟、缩短手术暴露时间和控制术中出血量、术后适当延长静脉抗生素使用、密切观察伤口情况、注重伤口护理等,尽可能预防术后感染的发生。腰椎后路融合内固定手术大范围剥离椎旁肌使其失血管化,长时间的自动撑开器进一步加重椎旁肌的损伤,内固定与剥离椎旁肌之间形成较大死腔致术后血肿存留,这些因素均增加腰椎后路融合固定手术早期深部感染的概率,因此,术中应间歇松开撑开器、注意内置物切迹尽可能低(减少术后死腔)、保持术后引流通畅等均有利于降低术后早期感染发生率。
二、腰椎后路融合内固定术后早期深部感染的诊断
脊柱固定融合术后感染分为早期感染和迟发感染两类,两者界定时间不同文献存在一定差异。王岩等[4]和仉建国等[5]将术后3个月以内感染定为早期感染,3个月以后为迟发感染;Wimmer等[6]将术后20周以内发生的感染称为早期感染,20周以后定位迟发感染;田芸等[7]将术后30 d内感染称为早期感染,30 d以后为迟发感染。本研究将早期感染界定为术后30 d内感染。
腰椎后路融合内固定术后早期深部感染的诊断存在一定困难,由于腰部肌肉及皮下组织较厚,早期伤口红肿多不明显,一旦术后吸收热后体温再次升高、疼痛加重,即使伤口无任何异常表现,应立即复查血白细胞计数及分类、红细胞沉降率和C反应蛋白等指标,若血白细胞计数及分类、红细胞沉降率和C反应蛋白明显升高应高度怀疑早期深部感染的可能,密切观察伤口变化同时增加常见早期感染病原菌敏感抗生素,观察期间伤口出现分泌物增多或可疑脓性物质,在取标本送培养同时,应即刻清创探查伤口。本组腰椎后路融合内固定术后早期深部切口感染率为0.74%,相对较低,一方面与术后常规静脉预防抗生素使用有关,另一方面与注重患者术前感染风险因素评估、积极纠正易感因素、注重术中操作有关。
三、腰椎后路融合内固定术后早期深部感染的治疗
腰椎后路融合内固定术后早期深部感染一旦诊断明确,应尽早行彻底清创手术,清创切口应涵盖原手术切口全长,彻底清除脓液、坏死组织及炎性肉芽组织,大量生理盐水、双氧水、稀释络合碘反复冲洗,更换手术器械和手套后,各置1根冲洗管和负压引流管,术后生理盐水溶液持续冲洗引流。早期感染因细菌与内置物之间的黏附不稳定,通过彻底清创后持续灌洗可以使内置物表面及伤口内残存的细菌脱落,避免细菌在内置物表面形成生物膜,达到不取出内置物情况下治愈感染的目的[8]。清创术后严格卧床休息、腰部制动,静脉先滴注广谱抗生素再根据细菌培养结果改为敏感抗生素,控制血糖、纠正贫血及低蛋白血症以增加患者免疫抵抗力。对于术前长期服用类固醇激素同时RFS高(≥3分)的患者,为有效控制感染,建议清创同期取出内置物。感染组中,2例长期服用激素患者(RFS分别为4和5分)清创同期取出内置物后,持续冲洗引流结合静脉滴注抗菌药物,感染治愈,随访期间感染未再复发。除1例死亡患者外,其余10例随访期间均未见感染复发,说明早期彻底清创、持续冲洗引流结合静脉滴注抗菌药物,可早期彻底治愈感染。
总之,腰椎后路融合内固定术后早期深部感染发生率相对较低,术前高度重视患者感染风险因素评估并作积极预防,有利于降低早期感染的发生率,对早期深部感染患者保留内置物情况下,彻底清创后持续冲洗负压引流结合静脉滴注抗菌药物是一种较为有效的治疗方法,对于术前长期口服激素同时RFS≥3分患者,彻底清创同时取出内固定有利于早期彻底控制感染。
[1] Collins I,Wilson-MacDonald J,Chami G,et al.The diagnosis and management of infection following instrumented spinal fusion[J].Eur Spine J,2008,17(3):445-450.
[2] Meredith DS,Kepler CK,Huang RC,et al.Postoperativeinfection of lumbar spine:presentation and management[J].Int Orthop,2012,36(2):439-444.
[3] Levi AD,Dickman CA,Sonntag VK.Management of postoperative infections after spinal instrumentation[J].J Neurosurg,1997,86(6):975-980.
[4] 王岩,张雪松,肖嵩华,等.脊柱内固定术后深部感染[J].中华医学杂志,2006,86(25):1737-1739.
[5] 仉建国,李书纲,杨新宇,等.脊柱侧凸后路矫形融合术术后感染的治疗[J].中华骨科杂志,2001,21(8):453-456.
[6] Wimmer C,Gluch H.Management of postoperative wound infection in posterior spinal fusion with instrumentation[J].J Spinal Disord,1996,9(6):505-508.
[7] 田耘,陈仲强,周方,等.脊柱术后伤口深部感染的处理[J].中华外科杂志,2005,43(4):229-231.
[8] 胡光宇,李新锋,黄平,等.保留内置物清创联合真空负压封闭引流治疗早发性腰椎融合术后感染[J].脊柱外科杂志,2010,8(5):278-282.
