巨细胞病毒感染小鼠结肠中肠三叶因子的表达及更昔洛韦的干预作用*
2013-08-14叶黎离郑玉艳刘文强杨倩倩
刘 芹,王 军,叶黎离,郑玉艳,刘文强,杨倩倩
(徐州医学院附属医院,江苏徐州 221000)
人巨细胞病毒(human cytomegalovirus,HCMV)属于疱疹病毒亚科,是导致胃肠道感染的常见病原体[1]。在发展中国家,高达80%的儿童在3岁前就已经感染HCMV。HCMV结肠炎患者的结肠内可见的大面积的溃疡,患者因久治不愈会造成中毒性结肠扩张、肠穿孔、肠息肉、肠癌、肠狭窄和肠梗阻等,甚至危及生命[2]。CMV具有严格的种属特异性,但鼠巨细胞病毒(murine cytomegalovirus,MCMV)和HCMV在基因及核酸水平有很多相似性[3],为本研究CMV感染机制提供了依据。肠三叶因子(intestinal trefoil factor,ITF/TFF3)属于三叶因子家族肽[4],是一类较新的肠黏膜保护因子,在肠黏膜的保护和损伤修复中发挥重要作用。它既能与黏液糖蛋白结合成凝胶,增强黏膜防御功能,又可以促上皮细胞移动,加速损伤修复,保持肠黏膜完整,从而限制了组织流动,电解质丢失,减轻了免疫所致的肠道炎症反应[5-7]。本文参照文献[8]建立小鼠CMV感染模型。并在其基础上研究ITF的表达情况,探讨ITF在MCMV感染中的作用。
1 材料与方法
1.1 病毒和细胞培养 小鼠NIH/3T3细胞及MCMV Smith毒株由山东省医学科学院微生物研究所提供。小鼠NIH/3T3细胞按常规方法培养传代[8]。MCMV Smith毒株小鼠体内传毒健康纯系BALB/c小鼠(购自徐州医学院实验动物中心,饲养在徐州医学院动物室清洁层柜内),雌性,6~8周龄,体质量18~22g。甲基泼尼松龙注射液每只2mg,每4天肌内注射1次;第1次药物注射后第2天每只小鼠腹腔接种105.31/mL PFU MCMV Smith病毒悬液;病毒接种后第14天用眼球摘除法处死小鼠取唾液腺;每个唾液腺用无血Dubecco MEM Eagle培养液1mL充分匀浆;离心取上清分装,置-80℃冰箱保存待用。测定病毒致半数细胞感染量TCID50=105.31/mL。
1.2 方法
1.2.1 实验动物模型制备及分组 雌性BALB/c,4周龄,体质量8~12g,采用酶联免疫吸附(ELISA)试剂盒检测MCMV IgM、IgG,MCMV IgM、IgG均阴性者判断为无 MCMV感染,纳入研究。在12/12h昼夜循环条件下自由进食,实验前适应1周。实验动物随机分为空白组、病毒组和更昔洛韦(ganciclovir,GCV)组,每组8只小鼠,小鼠腹腔接种含病毒105.31/mL的病毒液100μL,建立播散型MCMV感染小鼠模型,自病毒接种后24h为0d,GCV组在接种病毒悬液24h后给予GCV(国药准字:H111101-1,湖北科益药业有限公司)50mg/kg腹腔注射每日1次,14d,同时空白组和病毒组在相应时间点分别给予同等剂量的生理盐水。实验小鼠分别于第3、7、14天处死后取出肝脏、结肠放于4℃预冷的无RNA酶的冻存管中,液氮保存。
1.2.2 MCMV-DNA PCR检测 购买天根公司DNA提取试剂盒(目录号为DP304),提取DNA后于紫外分光光度计下测定A260/A280,稳定1.8~2.0为可用,-20℃保存备用。引物由上海生工生物工程有限公司合成。上游引物:5′-TCA GCC ATC AAC TCT GCT ACC AAC-3′,下游引物:5′-ATC TGA AAC AGC CGT ATA TCA TCT TG-3′产物长度为100 bp,退火温度为59℃。PCR产物在2%琼脂糖凝胶上进行电泳,紫外线灯下观察有无MCMV-DNA电泳条带。
1.2.3 总RNA提取 采用异硫氰酸胍-酚-氯仿一步法提取总RNA,于紫外分光光度计下测定A260/A280,稳定于1.8~2.0为可用,-80℃保存备用。引物设计及合成,均由上海生工生物工程有限公司合成。ITF序列如下,正义引物:5′-ACA ACC CTG CTG CTT GGT CCT -3,反义引物:5′-TCT GTC TCT TGC AGA GGT TTG-3′;扩增片段为:212bp,退火温度为59℃。内参序列鼠甘油醛-3-磷酸脱氢酶(GAPDH),正义引物:5′-CCA AAA GGG TCA TCA TCT CC-3′,反义引物:5′-CAA CCT GGT CCT CAG TGT AGC-3′,扩增片段:498 bp,退火温度为58℃。实时定量逆转录-聚合酶链反应(RTPCR)以RT-PCR二步法进行ITF mRNA检测,PCR产物在2%琼脂糖凝胶上进行电泳,采用凝胶成像分析系统(GIS-2008型,上海天能科技有限公司)进行吸光度扫描分析,结果以ITF mRNA扩增条带与GAPDH内参扩增条带的扫描峰面积比值表示mRNA的相对含量。
1.3 统计学处理 采用SPSS16.0软件进行数据分析,计量资料用表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用q检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 生长发育情况 病毒组小鼠出现食欲差、活动少;皮毛稀松、对刺激反应迟钝、生长迟缓、体质量不增等表现。
2.2 PCR检测结果 病毒组肝脏、结肠组织 MCMV-DNA PCR电泳可见阳性条带,空白组无阳性条带,GCV组亦可见阳性条带,但和病毒组比较明显变暗、模糊。见图1、2。

图1 肝脏组织MCMV-DNA PCR结果
2.3 各组小鼠结肠黏膜ITF的表达比较 空白组ITF mRNA表达量在3、7和14d时类似;病毒组在3d时增加,14d时达高峰,3个时间点表达量差异有统计学意义(P<0.05);GCV组在3d时开始增加,14d时达高峰,3个时间点表达量差异有统计学意义(P<0.05)。7、14d时,GCV组ITF mRNA表达量高于病毒组和空白组(P<0.05),3、7、14d时,病毒组高于空白组(P<0.05)。见图3、表1。

图2 结肠组织MCMV-DNA PCR结果
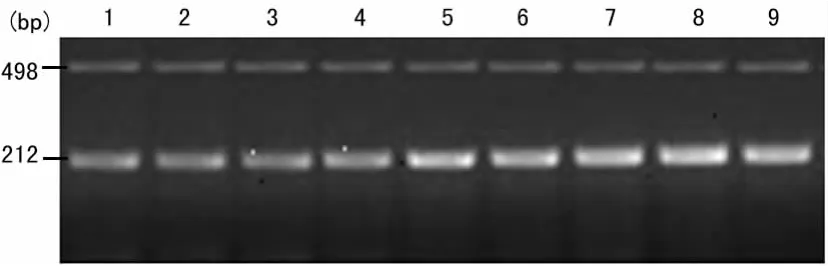
图3 结肠组织ITF RT-PCR结果
表1 实验小鼠ITF表达的比较(,n=8)

表1 实验小鼠ITF表达的比较(,n=8)
a:P<0.05,与病毒组和 GCV组比较;b:P<0.05,与病毒组比较;c:P<0.05,与同组7、14d时比较。
组别3d 7d 14d空白组 0.930±0.051a0.950±0.056a1.050±0.072a病毒组 0.970±0.041c 1.120±0.0751.360±0.085 GCV组 1.250±0.110c 1.450±0.120b 1.700±0.140b
3 讨 论
巨细胞病毒属于疱疹病毒家族中的一员,成人的感染率在40%~100%。大部分感染并没有临床症状出现,通常有终身的潜伏期,但CMV感染能够引起严重的胃肠道疾病。临床上严重的胃肠道CMV疾病通常发生在免疫受损的患者中[9],在免疫正常人群中感染很少报道。CMV感染可使炎症性肠病患者病情更加复杂,导致重症率和死亡率升高[10]。
ITF通过疏水键同黏液糖蛋白(mucin,MUC)结合,形成稳定的凝胶复合物,此凝胶复合物可以抵抗胃肠道胃酸、蛋白酶和机械损伤等,从而增强了胃肠道黏膜屏障的防御能力,并能促进上皮细胞向损伤处的迁移[11]。细胞迁移是黏膜受损后早期修复的关键过程,损伤区域周边细胞迁移到损伤部位,重建上皮的完整性和黏膜屏障。Vandenbroucke等[12]在口服硫酸葡聚糖诱导肠道炎症的实验中发现,实验组予胃饲有生物活性的ITF,只发生轻度的上皮损伤;而对照组则死于广泛性结肠炎,证实了ITF在维持黏膜屏障中的作用。组织学检查发现ITF基因剔除小鼠没有早期修复过程,而给予重组ITF后,ITF基因剔除的小鼠能够恢复正常的黏膜修复功能[13]。大量实验证明,ITF在胃肠道中的保护和修复过程中发挥重要的作用。
肠道HCMV感染主要出现于免疫功能低下的人群如艾滋病患者、器官移植患者、恶性肿瘤患者及炎症性肠炎患者等,但CMV感染后能否导致人体免疫功能的进一步损伤尚未得到证实。本研究发现,4周龄小鼠接种MCMV后出现生长发育减缓,体质量减低,与空白组相比,病毒组结肠组织ITF蛋白表达升高。提示MCMV造模后3d,小鼠结肠黏膜可能处于修复早期,ITF的表达有上调的趋势。与病毒组相比,GCV组结肠组织中ITF表达明显升高,提示GCV在CMV肠道感染中的治疗作用可能是通过上调ITF基因表达,促进受损区域上皮细胞的重建,可能是药物发挥黏膜修复重建作用的机制之一。
综上所述,ITF在CMV感染肠道的发生、发展中起着重要作用,这也为CMV的发病机制研究及其临床治疗提供了一个新方向。引用外源性ITF或者提升ITF活性可能成为治疗CMV感染的新靶点。
[1]Kim HC,Hwang EA,Park SB,et al.Historical comparison of prophylactic ganciclovir for gastrointestinal cytomegalovirus infection in kidney transplant recipients[J].Transplant Proc,2012,44(3):710-712.
[2]Maher MM,Nassar MI.Acute cytomegalovirus infection is a risk factor in refractory and complicated inflammatory bowel disease[J].Dig Dis Sci,2009,54(11):2456-2462.
[3]Torres-Madrizg T,Boucher HW.Immunocompromised hosts:perspectives in the treatment and prophylaxis of cytomegalovirus disease in solid-organ transplant recipients[J].Clin Infect Dis,2008,47(5):702-711.
[4]Kjellev S.The trefoil factor family-small peptides with multiple functionalities[J].Cell Mol Life Sci,2009,66(8):1350-1369.
[5]王焕,吴修文,万千雪,等.肠三叶因子和黏蛋白对烧伤血清所致肠上皮细胞增殖移行能力变化的影响[J].中华烧伤杂志,2011,27(5):347-352.
[6]Neal MD,Richardson WM,Sodhi CP,et al.Intestinal stem cells and their roles during mucosal injury and re-pair[J].J Surg Res,2010,167(1):1-8.
[7]Poulsen SS,Kissow H,Hare K,et al.Luminal and parenteral TFF2and TFF3dimer and monomer in two models of experimental colitis in the rat[J].Regul Pept,2005,126(3):163-171.
[8]徐翼,方峰,董永绥,等.小鼠巨细胞病毒全身播散型感染模型的建立[J].临床儿科杂志,2008,26(6):517-520.
[9]Onyeagocha C,Hossain MS,Kumar A,et al.Latent cytomegalovirus infection exacerbates experimental colitis[J].Am J Pathol,2009,175(5):2034-2042.
[10]Suzuki H,Kato J,Kuriyama M,et al.Specific endoscopic features of ulcerative colitis complicated by cytomegalovirus infection[J].World J Gastroenterol,2010,16(10):1245-1251.
[11]Sasaki M,Ikeda H,Nakanuma Y.Expression profiles of MUC mucins and trefoil factor family(TFF)peptides in the intrahepatic biliary system:physiological distribution and pathological significance[J].Prog Histochem Cytochem,2007,42(2):61-110.
[12]Vandenbroucke K,Hans W,Van Huysse J,et al.Active delivery of trefoil factors by genetically modified Lactococcus lactis prevents and heals acute colitis in mice[J].Gastroenterology,2004,127(2):502-513.
[13]Beck PL,Wong JF,Li Y,et al.Chemotherapy-and radiotherapy-induced intestinal damage is regulated by intestinal trefoil factor[J].Gastroenterology,2004,126(3):796-808.
