不同冷冻时间对异体神经移植后生理特性的影响
2013-08-14陈德龙陈小龙曾希银聂春福
张 勇,陈德龙,陈小龙,曾希银,聂春福
(遂宁市第一人民医院骨科,四川 629000)
异体神经是临床上修复长段主要神经缺损重要的研究材料。但它最大弊端是免疫排斥[1],从而影响神经移植后的生理特性。在这方面国内外学者做了大量的基础研究[2-8]。研究普遍认为:降低异体神经移植免疫排斥的较好方法是超深低温(-196℃)冷冻保存。那么,究竟保存多长时间才能使移植后的生理特性最佳呢?目前最长研究时间为3周,更长的时间有待进一步探索。本研究的目的就是观察超深低温条件下不同冷冻时间对异体神经移植后生理特性的影响。
1 材料与方法
1.1 主要实验试剂和器械 甘油(纯度大于99.0%,泸州生物试剂公司);水合氯醛(纯度大于98.0%,泸州生物试剂公司);电镜(JEM-1400,日本电 子株式会社);光镜 (Olympus Bx50,苏州易微光学公司);显微手术镜(XTS-4A,江苏镇江中天光学仪器公司);电生理实验系统(BL-420F,成都生物设备有限公司)。
1.2 实验动物及分组 80只雌性Wistar大鼠(重庆医科大学动物实验中心提供),质量(280±30)g。取材组20只,其余60只按随机原则分为对照组(A组:新鲜自体神经移植组;B组:新鲜异体神经移植组,每组10只)和实验组(按取材组神经在-196℃条件下保存3、6、9、12周后移植分为C、D、E、F组,每组10只。)
1.3 方法
1.3.1 取材 用水合氯醛将Wistar大鼠麻醉后,暴露双侧的坐骨神经,切取神经干1.0cm,总计40根。将取下的神经分4组每组10根放于50%甘油的EP管中,而后在超深低温条件下按不同冷冻时间进行保存。
1.3.2 神经移植 A组:坐骨神经取下后立即原位移植于自体;B组:坐骨神经取下后立即两两交叉移植;C、D、E、F组分别在坐骨神经冷冻保存相应时间后,在常温下(25℃)用生理盐水复温,按随机原则进行移植。所有组别术后均不用药物处理。
1.3.3 观察指标 术后间隔一定时间观察移植侧肢体的情况;术后3、6、9周做神经电生理检测,术后第9周做光镜、电镜观察。
1.4 统计学处理 结果用SPSS17.0统计软件进行数据处理,计量资料用表示,各组间采用q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 大体观察 A组术后第3天大鼠足部轻微肿胀糜烂,术后1周趋于稳定,术后3周肿胀糜烂渐消,移植段表面散在少许毛细血管分布,和周围组织无黏连。术后6周肿胀糜烂基本消除,移植段神经表面分布大量毛细血管。术后9周肿胀糜烂完全消除,移植段神经表面已形成网状毛细血管。B组术后第3天足部肿胀糜烂便很明显,术后1周足趾便开始散在性脱落,术后3周肿胀糜烂范围加大,程度加深,移植段神经和周围组织黏连重,神经表面毛细血管稀少。术后6周趋于稳定,移植段神经与周围组织黏连很严重,神经表面只可见少量毛细血管。术后9周糜烂基本修复,移植段神经近远端被纤维组织包裹,难以分离,神经表面毛细血管依旧稀少。D、C组很接近,稍逊于A组,明显优于B组。E、F组的效果优于B组,逊于A、C、D组;E组的效果稍好于F组。
2.2 神经电生理 动作电位峰值、神经传导速度统计分析:移植3周、6周后:A组与B、C、D、E、F组之间比较差异有统计学意义(P<0.05)。移植9周后,A组和B、E、F组之间比较差异有统计学意义(P<0.05);A组与C、D组之间比较差异无统计学意义(P>0.05);C、D组之间比较差异无统计学意义(P>0.05),这说明坐骨神经组冷冻保存3周、6周后移植,9周后的电生理特性近似于A组,见表1、2。
2.3 光镜观察 各组别术后9周取移植神经中段做半薄切片HE染色观察,结果见图1。A组:少量轴突肿胀和空泡变性,轴突密度高,施万细胞大小均一增生明显,极其少量的淋巴细胞浸润,新生毛细血管大量生成;B组:空泡变性明显,大部分轴突水肿,施万细胞大小不一散在增生,淋巴细胞大范围、高密度浸润,少量新生毛细血管;C、D组无明显差别,整体效果接近于A组;E组差于A、C、D组,优于B、F组,F组优于B组。
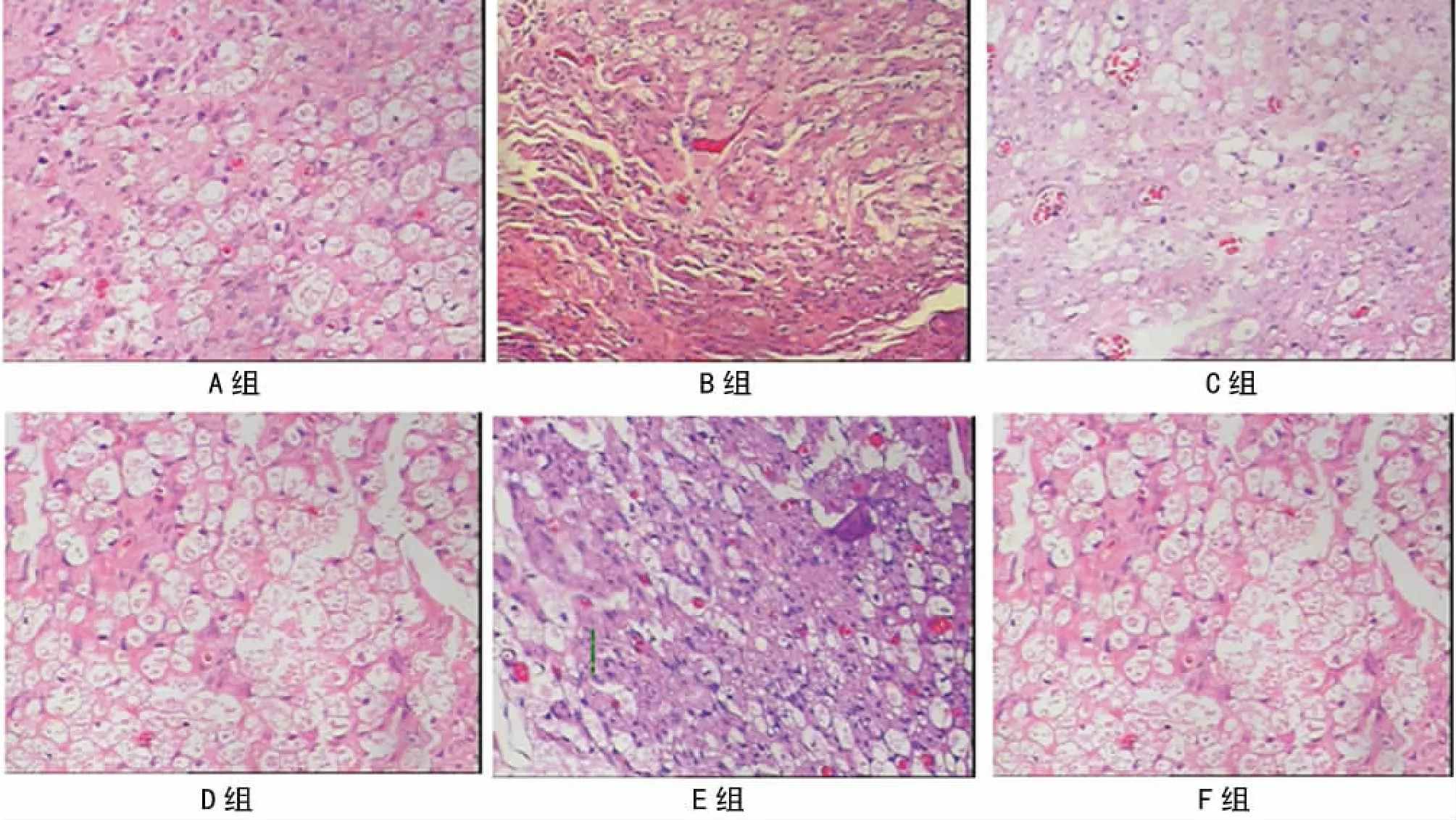
图1 术后9周各组光镜结果(×200)
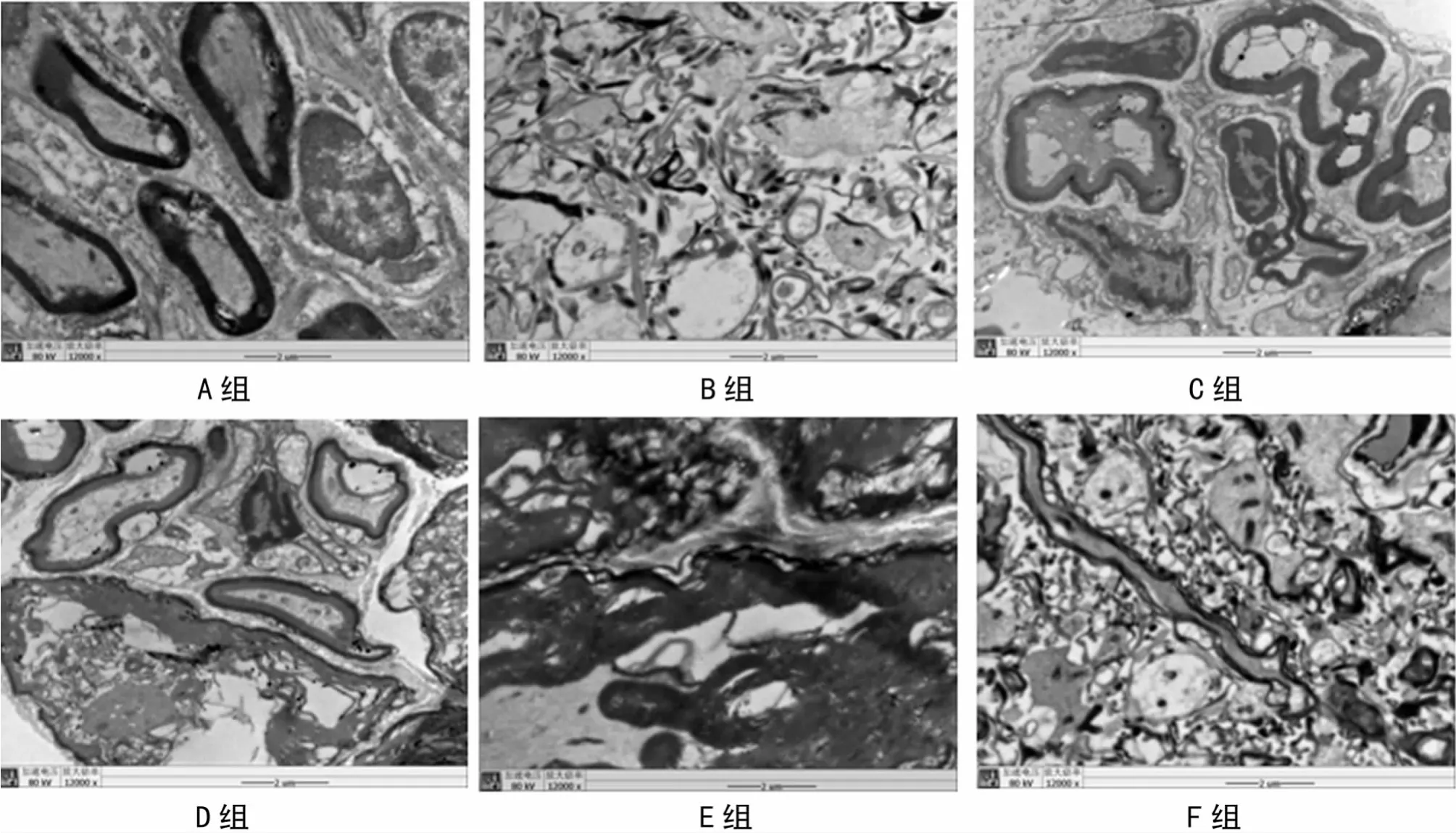
图2 术后9周各组电镜结果(×12000)
表1 术后3、6、9周各组别动作电位峰值(,n=5,mV)
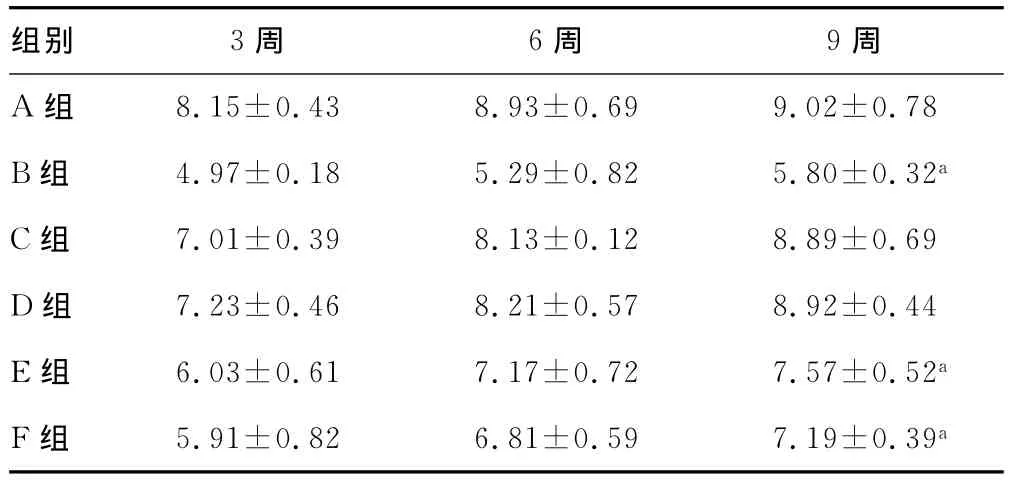
表1 术后3、6、9周各组别动作电位峰值(,n=5,mV)
a:P<0.05,与A组比较。
组别 3周 6周 9周8.15±0.43 8.93±0.69 9.02±0.78 B组 4.97±0.18 5.29±0.82 5.80±0.32a C组 7.01±0.39 8.13±0.12 8.89±0.69 D组 7.23±0.46 8.21±0.57 8.92±0.44 E组 6.03±0.61 7.17±0.72 7.57±0.52a F组 5.91±0.82 6.81±0.59 7.19±0.39 A组a
表2 术后3、6、9周各组别神经传导速度(mV,,n=5)
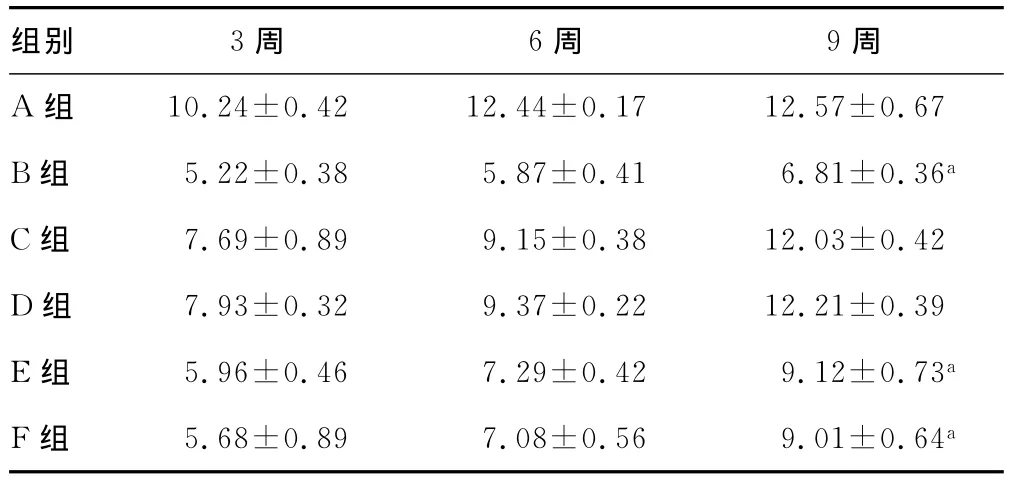
表2 术后3、6、9周各组别神经传导速度(mV,,n=5)
a:P<0.05,与A组比较。
组别 3周 6周 9周10.24±0.42 12.44±0.17 12.57±0.67 B组 5.22±0.38 5.87±0.41 6.81±0.36a C组 7.69±0.89 9.15±0.38 12.03±0.42 D组 7.93±0.32 9.37±0.22 12.21±0.39 E组 5.96±0.46 7.29±0.42 9.12±0.73a F组 5.68±0.89 7.08±0.56 9.01±0.64 A组a
2.4 电镜观察 各组别术后9周取移植神经中段做超薄切片电镜观察,结果见图2。A组:髓鞘外形光滑,发育成熟,有髓或无髓神经纤维大量再生,施万细胞轴浆均匀、丰富,呈旺盛状,效果最好。B组:难见神经纤维、施万细胞、轴突再生,紊乱的结缔组织多见,效果最差。C、D组差别不大但稍逊于A组。E、F组明显差于A、C、D组。
3 讨 论
3.1 自体和异体神经移植后生理特性差别的主要原因 通过本实验可以看出:自体神经移植后生理特性是明显优于异体神经的。造成其差别的主要原因是免疫排斥的影响。免疫排斥是机体对移植物(异体细胞、组织或器官)通过特异性免疫应答使其遭受破坏的过程。一般是指移植术后,受者可识别移植物抗原并产生应答,移植物中免疫细胞也可识别受者抗原组织并产生应答。在同种异体移植中,排斥反应有两种基本类型:宿主抗移植物反应(HVGR)和移植物抗宿主反应(GVHR)。免疫排斥反应过程既有细胞介导的又有的抗体介导。异体神经移植后的免疫排斥,主要组织相容性复合体(MHC)起了主要作用[9-10],它存在于施万细胞,是主要的抗原成分。此外,神经基底膜管的完整性也会影响神经的再生修复后的生理特性,因为它是神经固有基质框架。因此,最大限度地去除施万细胞抗原性并保留基底膜管的完整性是优化异体神经移植后生理特性的必要条件。
3.2 冷冻处理法对异体神经移植后生理特性的影响 异体神经经超深低温冷冻处理后,主要抗原成分被最大限度清除,而且对神经基底膜管的完整性损伤较小,最大程度降低了异体神经移植的免疫排斥性,使异体神经移植后的生理特性得到优化[11-12]。这种兼顾二者的特性使其比化学法[13]、放射辐照法[14]、川芎嗪处理法[15]、绿茶多酚处理法[16]、免疫抑制法[17]显得更胜一筹。通过本实验可以看出:冷冻法异体神经处理后,其移植免疫后的生理特性可以得到不同程度的改善,再生效果优于新鲜异体神经移植。
3.3 不同冷冻时间对异体神经移植后生理特性的影响 冷冻法处理异体神经后,虽然可以改善移植后的生理特性,但若保存时间过短,难以清除施万细胞的抗原成分,排斥反应仍然强烈,生理特性难以达到最佳状态;反之过长,冰晶会对基底膜管造成机械性和渗透性损伤[18],也将影响移植后的生理特性。由此可知,异体神经冷冻保存存在一个最佳时间。有研究表明,冷冻保存时间低于3周,异体神经移植后效果明显逊于新鲜自体神经移植[19]。从本实验可以看出,冷冻保存时间太长,如9、12周后的移植效果也是明显次于新鲜自体神经移植的,而保存3周、6周后的移植效果却和新鲜自体神经移植很接近。由此可知:异体神经移植后的生理特性与冷冻时间存在依存关系。不过,3周到6周之间的冷冻移植效果尚未明确,仍需进一步的探索。
冷冻时间的长短对异体神经移植后的生理特性起了极大的影响作用,找到最佳的保存时间显得尤为重要。最佳的保存时间不仅可以使异体神经移植后的生理特性达到最优状态,更能使移植后的恢复效果达到最佳,是极有临床实用价值和发展前景的。
[1]Moore AM,MacewanM,Santosa KB,et al.Acellular nerve allografts in peripheral nerve regeneration:A comparative study[J].Muscle Nerve,2011,44(2):221-234.
[2]Wang G,Lu S,Kuang Z,et al.Experimental study on promotion of neurotropic reinnervation with chemically extracted acellular nerve allograft[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2010,24(11):1288-1292.
[3]唐圆,刘湘华,刘丹,等.以组织工程建构技术修复周围神经损伤的难点[J].中国组织工程研究,2013,17(7):1295-1304.
[4]Tang X,Xue C,Wang Y,et al.Bridging peripheral nerve defects with a tissue engineered nerve graft composed of an in vitro cultured nerve equivalent and a silk fibroinbased scaffold[J].Biomaterials,2012,33(15):3860-3867.
[5]马英华,宋有鑫,胡大为,等.冷冻保存后不同长度异体神经移植的实验研究[J].中国矫形外科杂志,2011,19(13):1137-1139.
[6]郭义柱,王岩,刘相成,等.同种异体神经移植治疗锐性臂丛神经缺损5例临床研究[J].军医进修学院学报,2011,32(4):317-318.
[7]Rustemeyer J,van de Wal R,Keipert C,et al.Administration of low-dose FK 506accelerates histomorphometric regeneration and functional outcomes after allograft nerve repair in a rat model[J].J Craniomaxillofac Surg,2010,38(2):134-140.
[8]Giusti G,Willems WF,Kremer T,et al.Return of motor function after segmental nerve loss in a rat model:comparison of autogenous nerve graft,collagen conduit,and processed allograft(AxoGen)[J].J Bone Joint Surg Am,2012,4(5):410-417.
[9]杨小华,韩金豹,张沉冰,等.同种异体神经复合体修复兔周围神经缺损[J].中国组织工程研究与临床康复,2011,15(34):6315-6318.
[10]李晓峰,赵劲民,秦义武,等.三种不同方法制备去细胞神经支架的比[J].中国组织工程研究,2012,16(47):8817-8820.
[11]Szynkaruk M,Kemp SW,Wood MD,et al.Experimental and clinical evidence for use of decellularized nerve allografts in peripheral nerve gap reconstruction[J].Tissue Eng Part B Rev,2013,19(1):83-96.
[12]Brooks DN,Weber RV,Chao JD,et al.Processed nerve allografts for peripheral nerve reconstruction:A multicenter study of utilization and outcomes in sensory,mixed,and motor nerve reconstructions[J].Micro Surg,2012,32(1):1-14.
[13]赵喆,王玉,彭江,等.化学去细胞异体神经周围复合BMSCs生物蛋白胶复合物促周围神经缺损修复[J].中国修复重建外科杂志,2011,25(4):488-493.
[14]王然芸,郭永明,郭义.周围神经再生和修复的研究进展[J].天津中医药,2011,28(3):260-261.
[15]钟建,阳明明,蒋电明.不同温度下含川芎嗪UW液保存对异体神经再生影响的实验研究[J].重庆医科大学学报,2012,37(4):341-344.
[16]周胜虎,甄平,高明暄,等.辐照和绿茶多酚处理同种异体神经移植体的实验研究[J].中国矫形外科杂志,2012,(20):1882-1885.
[17]宋仁纲,张震宇.FK506对异体神经移植的促神经再生作用研究进展[J].中国矫形外科杂志,2011,19(22):1883-1886.
[18]Ray WZ,Kale SS,Kasukurthi R,et al.Effect of cold nerve allograft preservation on antigen presentation and rejection[J].J Neurosurg,2011,114(1):256-262.
[19]王秋根,项耀均,崔义,等.不同温度和时间保存异体神经移植后对鼠轴突再生的影响[J].第二军医大学学报,1998,19(1):67-70.
