骨髓间充质干细胞对大鼠佐剂性关节炎防治的实验研究*
2013-08-14许键炜申长清赵芳芳舒莉萍何志旭
许键炜,申长清,赵芳芳,舒莉萍,何志旭△
(1.贵阳医学院药理学教研室 550004;2.济宁医学院附属医院儿科,山东济宁 272029;3.蚌埠医学院微生物学教研室,安徽蚌埠 233030;4.贵阳医学院组织工程与干细胞实验中心 550004)
类风湿性关节炎(rheumatoid arthritis,RA)是一类以关节滑膜炎及对称性、破坏性的关节病变为主要特征的慢性全身性自身免疫性疾病[1]。RA在人群中的发病率约为0.24%~1.00%。其发病机制尚不十分明确。传统治疗方法以药物治疗为主,但仅能使患者的病情得到部分缓解,尚不能有效地逆转RA发生的病理生理改变。目前研究发现,骨髓间充质干细胞(mesenchymal stem cells,MSCs)具有较好的免疫调节作用,能抗炎、抗纤维化及促进血管形成、修复受损组织[2]。分离、培养以及扩增MSCs简便、经济,可获取较多量的 MSCs。采用弗氏完全佐剂建立与人类RA类似的大鼠佐剂性关节炎(adjuvant arthritis,AA)模型[3],方法成熟、简便。本研究采用MSCs治疗佐剂性关节炎大鼠模型,修复病损组织,达到治疗、干预AA的目的。为临床RA的防治提供实验理论基础,探索新的出路。
1 材料与方法
1.1 材料 SD雄性大鼠(贵阳医学院实验动物中心提供),低糖DMEM培养基(美国Gibco公司),0.25%胰蛋白酶及10%胎牛血清(美国Hyclone公司),弗氏完全佐剂(美国Sigma公司),倒置相差显微镜(日本Panasonic公司),CO2培养箱(美国Thermo Forma公司),流式细胞仪(FACS AriaⅡ,美国BD公司)。
1.2 方法
1.2.1 大鼠 MSCs的体外分离、纯化、增殖培养、鉴定及收集 取5周龄SD大鼠,无菌条件下取双侧股骨,联合应用密度梯度离心和贴壁筛选法分离、培养大鼠骨髓中的MSCs。传至第4代,应用流式细胞仪进行细胞膜表面分子CD29、CD34、CD45及CD71的水平检测分析。治疗前胰酶消化,离心,生理盐水洗涤2遍重悬成细胞悬液备用。
1.2.2 实验分组 取健康、雄性、5周龄、体质量(100±20)克/只SD大鼠50只,适应性饲养3d后按照随机数字表法将大鼠随机分为4组:第1组为模型组(n=20),第2组为正常对照组(n=10),第3组为MSCs治疗组(n=10),第4组为 MSCs干预组(n=10)。
1.2.3 AA大鼠模型的制备 模型组取弗氏完全佐剂[3],充分振荡、混匀,75%乙醇消毒大鼠右后足,无菌皮试针于右后足跖皮内一次性注射每只0.1mL。正常对照组大鼠代以注射等量的生理盐水。观察4组大鼠的呼吸、精神状态、活动、进食、饮水、体质量等情况。在造模第1、7、14、21d分别称量大鼠体质量,软尺测量双踝关节周长,排水法测量足爪体积。排水法测足爪体积,即在大鼠足部踝骨关节突出部位划一条线作为标记,用一特制量筒,灌满水后,将大鼠足爪插入,使踝关节骨上的标记处于水平面,另用一个烧杯接从量筒侧口排出的水,测量排出水的量(mL)即为所测大鼠足爪的体积。造模第21天从模型组随机分出10只大鼠,10%水合氯醛腹腔注射麻醉后,四肢关节做X线片摄片(采用牙片X光机,电压65kV,电流7 mA,曝光时间0.10ms)及常规HE染色病理切片,进行动物模型的鉴定[4]。
1.2.4 MSCs的治疗和干预 将上述4组大鼠做如下处理:MSCs治疗组于造模第21天舌下静脉缓慢一次性注射5×106/mL的MSCs细胞悬液1mL。MSCs干预组于造模第1天MSCs治疗,方法同MSCs治疗组。模型组和正常对照组不做任何处理。
1.2.5 MSCs治疗、干预后相关指标的检测 从注射MSCs细胞悬液起,分别于第1、7、14、21、28天测量大鼠体质量、双侧踝关节周长和后足爪体积(方法同前)。并观察大鼠活动、食欲、毛色等情况。各组大鼠在治疗后第28天,麻醉后行四肢关节X线片检查(方法同前)。之后颈椎脱臼处死,取四肢关节做病理检查。
1.2.6 治疗相关不良反应的观察 全程观察各治疗及干预组大鼠有无过敏反应及不良反应发生。
1.3 统计学处理 全部数据采用SPSS13.0软件处理。所得结果计量资料用表示,采用单因素方差分析,在总体水平有差异的情况下,各组和模型组比较采用LSD法,组间比较采用SNK法,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠MSCs的分离、培养、鉴定及收集 倒置相差显微镜观察可见原代培养的细胞在培养24h后贴壁,1周后集落迅速增多,扩大并融合,铺满培养瓶底面,予以传代培养。传至第4代,细胞呈梭形,漩涡状生长(图1)。行流式细胞仪检测结果显示大鼠 MSCs:CD71+、CD29+,而CD34-、CD45-,符合MSCs的生物学特征[5]。
2.2 造模、治疗及干预后大鼠生存状况及体质量、足爪变化情况 在造模期间动物无死亡,造模后动物较第2组活动明显减少,毛发直立,晦暗无光泽,食欲下降,关节肿胀进行性加重。体质量均有不同程度的增长,但第1组大鼠体质量的增长明显小于第2组。右足致炎后3d肿胀达一个高峰,持续4~5d后逐渐减轻,1周后再度肿胀,继发病变出现于致炎后的2周左右,表现为同侧和对侧及前足肿胀,且进行性加重。在第3组一次性注射MSCs后,大鼠毛发渐光泽,食欲好转,四肢关节肿胀程度逐渐缓解,趋于正常对照组。第4组,造模后3d内局部(原发侧)略微红肿,继而于1周左右红肿消退,之后患侧、对侧及前肢在干预后的21d内均未见明显红肿、强直及活动受限。第3、4组体质量与第2组体质量增长相当,相对第1组体质量有明显增加,差异有统计学意义(P<0.05)。而第1组与第2照组体质量增长明显偏离,体质量增长缓慢。第3组足踝关节周长与足爪体积增长曲线趋于第2组,与第1组比较,差异有统计学意义(P<0.05)。第4组踝关节周长与足爪体积增长曲线与第2组基本吻合,与第1组比较,差异有统计学意义(P<0.05),见表1~5。

图1 第4代骨髓间充质干细胞(100×)
2.3 影像学变化 与第2组相比(图2A),第1组可见周围软组织影增厚,骨性关节面模糊不清,有锯齿状改变,关节边缘骨质破坏(图2B)。第3组大鼠后肢双侧足趾关节较模型组周围软组织影增厚减轻,骨性关节面光滑,关节边缘骨质破坏明显修复(图2C)。第4组的周围软组织影未见明显增厚,骨性关节面光滑,关节边缘骨质未见明显破坏,与第2组无明显差异。

图2 大鼠关节影像学表现
表1 各组大鼠的体质量变化情况(g,)
表1 各组大鼠的体质量变化情况(g,)
*:P<0.05,与第1组比较;-:表示无数据。
1 20107.60±9.24118.80±11.32131.20±21.48151.20±19.87175.40±28.47205.80±26.86221.40±18.15247.00±3.942 10102.60±9.10121.00±9.90147.40±7.40175.20±6.46* 208.60±7.80* 250.40±10.29* 278.40±8.44* 305.80±9.96*3 10101.60±9.10122.00±12.73144.80±13.59167.80±13.22193.00±15.89234.20±22.20* 268.60±22.23* 300.20±18.24*4 10100.60±9.18120.20±8.87144.80±13.92* 170.40±13.22* 198.80±22.24* - - -F 0.12 0.78 0.22 1.95 4.91 12.70 15.59 41.88
表2 大鼠右踝关节周长变化(cm,)

表2 大鼠右踝关节周长变化(cm,)
*:P<0.05,与第1组比较;-:表示无数据。
1 201.96±0.052.22±0.082.36±0.092.42±0.082.54±0.092.60±0.072.66±0.112.68±0.082 101.98±0.081.98±0.08* 2.06±0.11* 2.08±0.08* 2.14±0.11* 2.16±0.11* 2.22±0.08* 2.22±0.08*3 101.96±0.052.22±0.082.40±0.122.58±0.132.64±0.052.64±0.052.50±0.07* 2.30±0.07*4 101.96±0.052.00±0.07* 2.00±0.07* 2.08±0.04* 2.10±0.07* - - -F 0.11 12.24 9.04 21.68 24.85 36.00 32.25 31.24
表3 大鼠左踝关节周长变化(cm,)
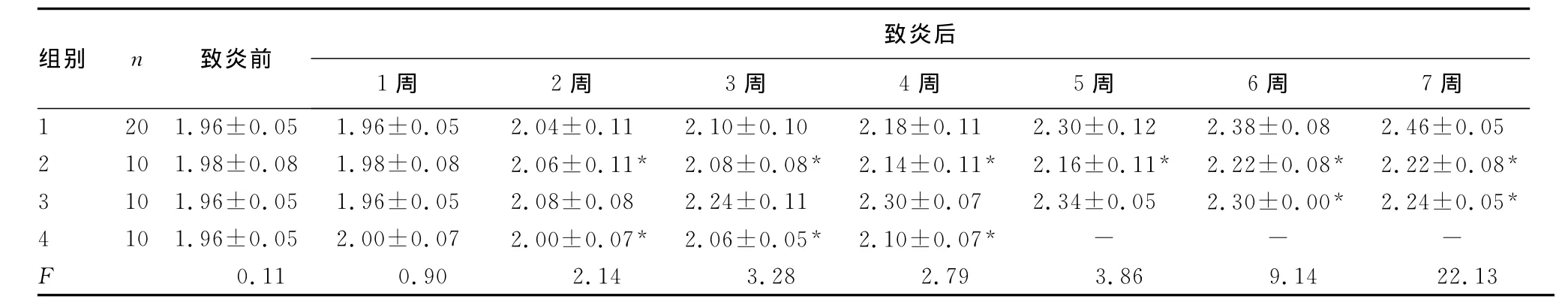
表3 大鼠左踝关节周长变化(cm,)
*:P<0.05,与第1组比较;-:表示无数据。
组别 n 致炎前致炎后1周 2周 3周 4周 5周 6周 7周1 201.96±0.051.96±0.052.04±0.112.10±0.102.18±0.112.30±0.122.38±0.082.46±0.052 101.98±0.081.98±0.082.06±0.11* 2.08±0.08* 2.14±0.11* 2.16±0.11* 2.22±0.08* 2.22±0.08*3 101.96±0.051.96±0.052.08±0.082.24±0.112.30±0.072.34±0.052.30±0.00* 2.24±0.05*4 101.96±0.052.00±0.072.00±0.07* 2.06±0.05* 2.10±0.07* - - -F 0.11 0.90 2.14 3.28 2.79 3.86 9.14 22.13
表4 大鼠右足体积变化(mL,)

表4 大鼠右足体积变化(mL,)
*:P<0.05,与第1组比较;-:表示无数据。
1 200.84±0.051.00±0.141.18±0.081.36±0.051.58±0.131.86±0.092.08±0.132.24±0.112 100.84±0.050.90±0.070.96±0.05* 1.00±0.07* 1.02±0.04* 1.08±0.04* 1.12±0.04* 1.16±0.05*3 100.90±0.071.16±0.111.40±0.071.66±0.111.62±0.131.42±0.08* 1.28±0.04* 1.20±0.07*4 100.88±0.100.90±0.08* 0.93±0.10* 0.98±0.10* 1.05±0.06* - - -F 0.66 12.20 25.42 27.17 25.67 26.83 38.59 100.13
表5 大鼠左足体积变化(mL,)

表5 大鼠左足体积变化(mL,)
*:P<0.05,与第1组比较;-:表示无数据。
组别 n 致炎前致炎后1周 2周 3周 4周 5周 6周 7周1 200.84±0.050.96±0.111.02±0.081.14±0.091.22±0.131.42±0.161.64±0.221.86±0.152 100.84±0.050.90±0.070.96±0.05* 1.00±0.07* 1.02±0.04* 1.08±0.04* 1.12±0.04* 1.16±0.05*3 100.90±0.070.96±0.091.06±0.091.20±0.071.32±0.081.26±0.09* 1.24±0.09* 1.18±0.04*4 100.86±0.090.90±0.070.92±0.08* 0.98±0.08* 1.00±0.07* - - -F 0.66 0.79 2.57 6.64 24.61 41.70 56.10 51.74
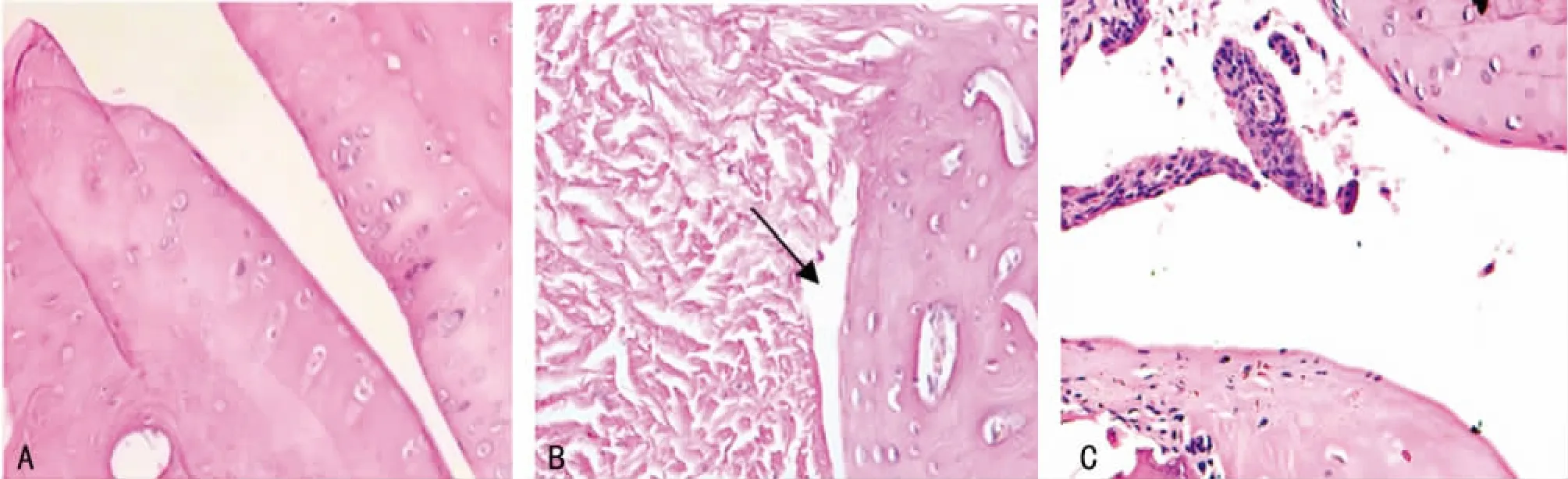
图3 关节病理切片HE染色(40×)
2.4 关节组织病理学检查结果 常规HE染色病理切片示:第2组大鼠关节滑膜组织正常,未见增生及炎性细胞浸润;关节面光滑,骨质无破坏,关节间隙正常(图3A)。第1组大鼠在右后足(即注射足)中观察到关节周围有大量的淋巴细胞浸润;左后足(即对侧足)和前足病变关节中出现滑膜增生,可达6~8层,有淋巴细胞浸润,有些软骨帽消失,严重的甚至炎性细胞已侵蚀到软骨中,关节腔完全消失,纤维化(图3B)。第3组的后肢足趾关节与模型组相比,关节面较光滑,关节边缘骨质破坏减轻,关节间隙出现(图3C)。第4组关节结构清楚,滑膜组织基本正常,未见明显增生及炎性细胞浸润;关节面较光滑,关节边缘骨质未见明显破坏,关节间隙正常。
2.5 治疗后相关不良反应的观察 本实验全程观察到第3、4组大鼠治疗过程中无呼吸急促,皮肤无皮疹,大便干燥、颗粒状,大鼠活动自如,食欲佳。不良反应表现不明显,肝脏、肾脏、脾脏、胸腺及睾丸等各大脏器未见肿瘤发生。
3 讨 论
该研究选用增殖旺盛且纯化的第4代的MSCs对大鼠AA进行治疗和干预,实验初步证实MSCs对AA大鼠动物模型具有治疗和干预作用,MSCs能有效改善AA大鼠的生存状况和相关症状,并干预大鼠AA的发生。
RA是一种致残率很高的疾病,其发生与免疫功能紊乱有关。传统的药物治疗多数仅能缓解症状,而难以治愈。Chiesa等[2]和Cutler等[6]报道:MSCs在体外的混合淋巴细胞反应体系中不诱发同种异体外周血单个核细胞的增殖,使T细胞的增殖几乎被完全抑制,提示MSCs具有较为独特的免疫原性和免疫调节性。研究发现,自体或异体的MSCs加入到有丝分裂原刺激的外周血淋巴细胞培养体系中,均能明显抑制T淋巴细胞的增殖活化[7]。此外,有学者发现即使MSCs分化成其他类型的细胞,也继续保留它的免疫调节作用[8],并能避免移植物抗宿主病的发生[9]。基础研究证实MSCs在体内外可以分化为成骨、软骨、脂肪、腱、肌肉等细胞[10-11],可能参与受损组织的再生修复;MSCs具有趋化作用,可以阻止炎性介质的释放,减轻炎症反应,减轻组织损伤,有利于阻止病情进展;MSCs还能分泌多种细胞因子,具有营养作用,能促进干细胞的增殖和分化[12]。关节病变可以促进 MSCs向病变滑膜聚集,从而修复损伤的关节组织[13]。
MSCs对免疫系统的调节起重要的作用,有望从根本上调整患者病态免疫系统[14-15];且 MSCs作为成体干细胞,较胚胎干细胞而言形成肿瘤的倾向极低,在目前发表的资料中未见报道,并且不存在伦理学上的争议。实验结果初步表明MSCs治疗RA是有效、安全可行的。MSCs或将为自身免疫性疾病乃至其他疾病的治疗提供新的思路。
[1]Dörner T,Burmester GR.The role of B cells in rheumatoid arthritis:mechanisms and therapeutic targets[J].Curr Opin Rheumatol,2003,15(3):246-252.
[2]Chiesa S,Morbelli S,Morando S,et al.Mesenchymal stem cells impair in vivo T-cell priming by dendritic cells[J].Proc Natl Acad Sci USA,2011,108(42):17384-17389.
[3]马玉琛,段斐,孟明,等.改良弗氏完全佐剂制备大鼠类风湿性关节炎模型[J].现代预防医学,2008,35(10):1989,1991.
[4]熊国林,黄海潇,谢玲,等.类风湿性关节炎大鼠模型的制备[J].解放军医学杂志,2007,32(2):121-123.
[5]Miyahara Y,Nagaya N,Kataoka M,et al.Monolayered mesenchymal stem cells repair scarred myocardium after myocardial infarction[J].Nat Med,2006,12(4):459-465.
[6]Cutler AJ,Limbani V,Girdlestone J,et al.Umbilical cordderived mesenchymal stromal cells modulate monocyte function to suppress T cell proliferation[J].J Immunol,2010,185(11):6617-6623.
[7]黄鹏,马廉.人脐带间充质干细胞的应用研究现状[J].中国输血杂志,2009,22(3):169-172.
[8]Le Blanc K,Tammik C,Rosendahl K,et al.HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells[J].Exp Hematol,2003,31(10):890-896.
[9]Le Blanc K,Frassoni F,Ball L,et al.Mesenchymal stem cells for treatment of steroid-resistant,severe,acute graftversus-host disease:aphase II study[J].Lancet,2008,371(9624):1579-1586.
[10]Kalwitz G,Endres M,Neumann K,et al.Gene expression profile of adult human bone marrow-derived mesenchymal stem cells stimulated by the chemokine CXCL7[J].Int J Biochem Cell Biol,2009,41(3):649-658.
[11]Frangogiannis NG.The immune system and cardiac repair[J].Pharmacol Res,2008,58(2):88-111.
[12]Bartholomew A,Sturgeon C,Siatskas M,et al.Mesenchymal stem cells suppress lymphocyte proliferation in vitro and prolong skin graft survival in vivo[J].Exp Hematol,2002,30(1):42-48.
[13]Marinova-Mutafchieva L,Williams RO,Funa K,et al.Inflammation is preceded by tumor necrosis factor-dependent infiltration of mesenchymal cells in experimental arthritis[J].Arthritis Rheum,2002,46(2):507-513.
[14]Le Blanc K,Tammik L,Sundberg B,et al.Mesenchymal stem cells inhibit and stimulate mixed lymphocyte cultures and mitogenic responses independently of the major histocompatibility complex[J].Scand J Immunol,2003,57(1):11-20.
[15]王黎明,李亚红,王小燕,等.造血干细胞移植治疗自身免疫性疾病4例[J].第四军医大学学报,2007,28(10):946.
