昆仑雪菊油树脂精油成分分析及抑菌活性
2013-08-12迪里努尔阿布都热合曼敬思群吴珊
迪里努尔· 阿布都热合曼,敬思群,吴珊
(新疆大学生命科学与技术学院,新疆 乌鲁木齐,830046)
新疆昆仑雪菊,学名为两色金鸡菊(Coreopsis tinctoria),是菊科金鸡菊属1 年生草本植物的干燥头状花序,在新疆主要分布于和田地区海拔高3 000 米左右的昆仑山区,野生资源较丰富,对高血压、高血脂、高血糖、冠心病等具有特殊疗效[1]。目前,有研究[2]已从昆仑雪菊中分离鉴定出20 余类化学成分、300 多种天然成分,主要研究集中在昆仑雪菊化学成分分析[3-4]、提取物活性[5-8],但是有关昆仑雪菊油树脂精油成分与其抑菌作用的研究还未见报道。精油是天然产物中生物活性的一类重要组分,应用广泛[9-11],通常植物精油是用来制备香精、香水等。但近十多年的许多研究发现,精油成分具有强烈的抑制或杀死真菌等微生物的特性[12-13]。因此,本文通过GC-MS 分析了昆仑雪菊油树脂精油化学成分,同时对昆仑雪菊油树脂精油的体外抑菌性进行研究,旨为昆仑雪菊清热解毒、抗菌消炎功效提供试验依据。
1 材料和方法
1.1 主要材料和仪器
昆仑雪菊花(野生),由新疆和田沙漠玫瑰有限责任公司提供;大肠杆菌、金黄色葡萄球菌、枯草杆菌、青霉、黑曲霉,均由生命科学与技术学院微生物实验室提供;
HH-S2数显恒温水浴锅,金坛市医疗仪器厂;PHS-3C 实验室PH 计,上海虹益仪器仪表有限公司;DHG-9123A 型电热恒温鼓风干燥箱,上海-恒科技有限公司;DZF-6050 型真空干燥箱,上海-恒科技有限公司;GMSX-280 手提式压力蒸汽消毒器,北京市永光明医疗仪器厂;GHP-9050 隔水式恒温培养箱,上海-恒科学仪器有限公司;SW-CJ-2FD 洁净工作台,上海博讯实业有限公司医疗设备厂;QP2010 气相色谱-质谱联用仪,上海-恒科技有限公司。
1.2 实验方法
1.2.1 昆仑雪菊油树脂精油的制备
昆仑雪菊花干燥粉末→超临界CO2萃取雪菊油树脂→3 500 r/min 离心15 min→取上清液→昆仑雪菊油树脂精油
超临界CO2萃取条件:萃取时间为100 min、萃取温度为45℃、萃取压力为20 MPa、夹带剂(无水乙醇)用量为150 mL、CO2流量为20 L/h。
1.2.2 昆仑雪菊油树脂精油GC-MS 成分分析
1.2.2.1 甲酯化处理
吸取3 mL 昆仑雪菊油树脂精油于试管中,加入5 mL 石油醚和乙醚(V/V =4∶3)混合溶液,加入0.5 moL/L 氢氧化钾-甲醇溶液4 mL,振荡,静置10 ~15 min,加入蒸馏水,静置分层,取上清液进样分析。
1.2.2.2 GC-MS 实验条件
GC 条件:色谱柱DB-5 毛细管柱(30 mm ×0.25 mm×0.25 μm);程序升温:初始温度40℃,保持3 min,程序升温10℃/min,升温至210℃,保持2 min,程序升温5℃/min,升温至280℃,保持3 min。进样口温度280℃,柱前压43 kPa,载气氮气,进样量0.5 μL,分流比20∶1,载气流速1 mL/min。
MS 条件:EI 离子源,源温200℃,电子能量70 eV,连接器温度230℃,质量扫描范围(m/z):30 ~500。
对昆仑雪菊油树脂精油分离,检测,对总离子流图中的各峰经质谱扫描后得质谱图,将其经计算机WILEY7. LIB 威利标准谱库数据系统分析处理,确定样品的组成。定量结果以GC 的峰面积计算,按峰面积归一化法计算各组分相对百分含量。昆仑雪菊油树脂精油脂肪酸被GC 分离的各成分用下面的线性升温公式计算其KI 值[14]:

式中:n-正烷烃的碳原子数;tx-被测物质x 的保留时间,min;tn,tn+1-碳原子数相差为1 的正烷烃的保留时间(tn<tx<tn+1),min。
1.2.3 昆仑雪菊油树脂精油抑菌试验
1.2.3.1 昆仑雪菊油树脂精油抑菌试验流程
制备菌悬液→倒平板→标记→涂布法接种→吸附一定剂量化学药剂的滤纸片贴平板→倒置培养观察并测量抑菌圈的直径→数据分析总结
1.2.3.2 培养基的制备
细菌培养用牛肉膏蛋白胨培养基:称取牛肉膏3.0 g,蛋白胨5 g,NaCl 2.5 g,琼脂9 g,加蒸馏水定容至500 mL 煮沸,调pH 至7.0 ~7.2。
霉菌培养用马铃薯培养基:称取马铃薯100 g、葡萄糖10 g、琼脂10 g、pH 自然(约6.0)。马铃薯处理方法:马铃薯去皮,切成块加水,煮沸30 min(注意火力的控制,可适当补水),用纱布过滤,滤液加糖,补足300 mL,装入三角瓶灭菌。
1.2.3.3 菌悬液的制备
取受试细菌(霉菌)接种到牛肉膏蛋白胨培养基斜面,37℃培养18 ~24 h,取受试霉菌接种到马铃薯培养基斜面,28℃培养48 h,培养产生孢子用接种环挑菌或孢子至无菌水中。
取37℃下培养24 h 的细菌1 环(霉菌取28℃下培养48 h),接于10 mL 的无菌水中,摇匀。得到1∶10菌液。再取1∶10 菌液1 mL 至9 mL 无菌水中,得1∶100菌液。继续稀释,制成每毫升105~106CFU菌悬液。然后各吸取0.3 mL 分别加入已灭菌冷却的平面培养基中采用稀释涂布平板法涂布均匀后培养(霉菌:28℃/48 h,细菌:37℃/24 h)。
1.2.3.4 提取物的稀释液的制备
将样品提取物用95% 溶剂依次稀释成75%、50%、25%、12.5%、6.25%、3.125%、1.563% 等浓度。
1.2.3.5 滤纸片法测定昆仑雪菊油树脂精油对细菌(霉菌)的抑菌活性
采用滤纸片法测定昆仑雪菊油树脂对细菌(霉菌)的抑菌活性[15]。取灭菌培养皿,倒入10 mL 固体培养基,凝固作为底层,将l mL 菌悬液加入冷却至50℃的培养基9 mL 中,并迅速混匀,趁热倒5 mL 至培养皿,作为菌层。待菌层凝固,均匀放置依次浸润200 μL 的0.03% 山梨酸钾、95% 乙醇、75% 精油、50% 精油、25% 精油、12.5% 精油、6.25% 精油、3.125% 精油、1.563% 精油的灭菌滤纸片,其中0.03%山梨酸钾和95%乙醇作为阳性对照样,无菌生理盐水作阴性对照。每皿做3 次重复,细菌培养皿置37℃培养箱中培养18 ~24 h,霉菌培养皿置28℃培养箱中培养48 h。
1.2.3.6 最低抑菌浓度(MIC)的测定
取100 μL 菌悬液(含菌量105~106CFU/mL)于平板中并涂布均匀,然后将培养基划分成4 份,分别标注质量浓度为75%、50%、25%、12.5%、6.125%、3.125%、1.625%,取已灭菌干燥的滤纸片,贴于平板表面,每皿4 片,最后在纸片处加入相应浓度的昆仑雪菊油树脂精油稀释液。培养条件同1.2.3.5,同时设置溶剂对照,菌落被完全抑制的提取物最低稀释浓度即为该种物质对受试菌的MIC。
2 结果与分析
2.1 昆仑雪菊油树脂精油GC-MS 分析结果

表1 昆仑雪菊油树脂精油GC/MS 分析结果Table 1 GC/MS analysis results of the Coreopsis oleoresin essential oil
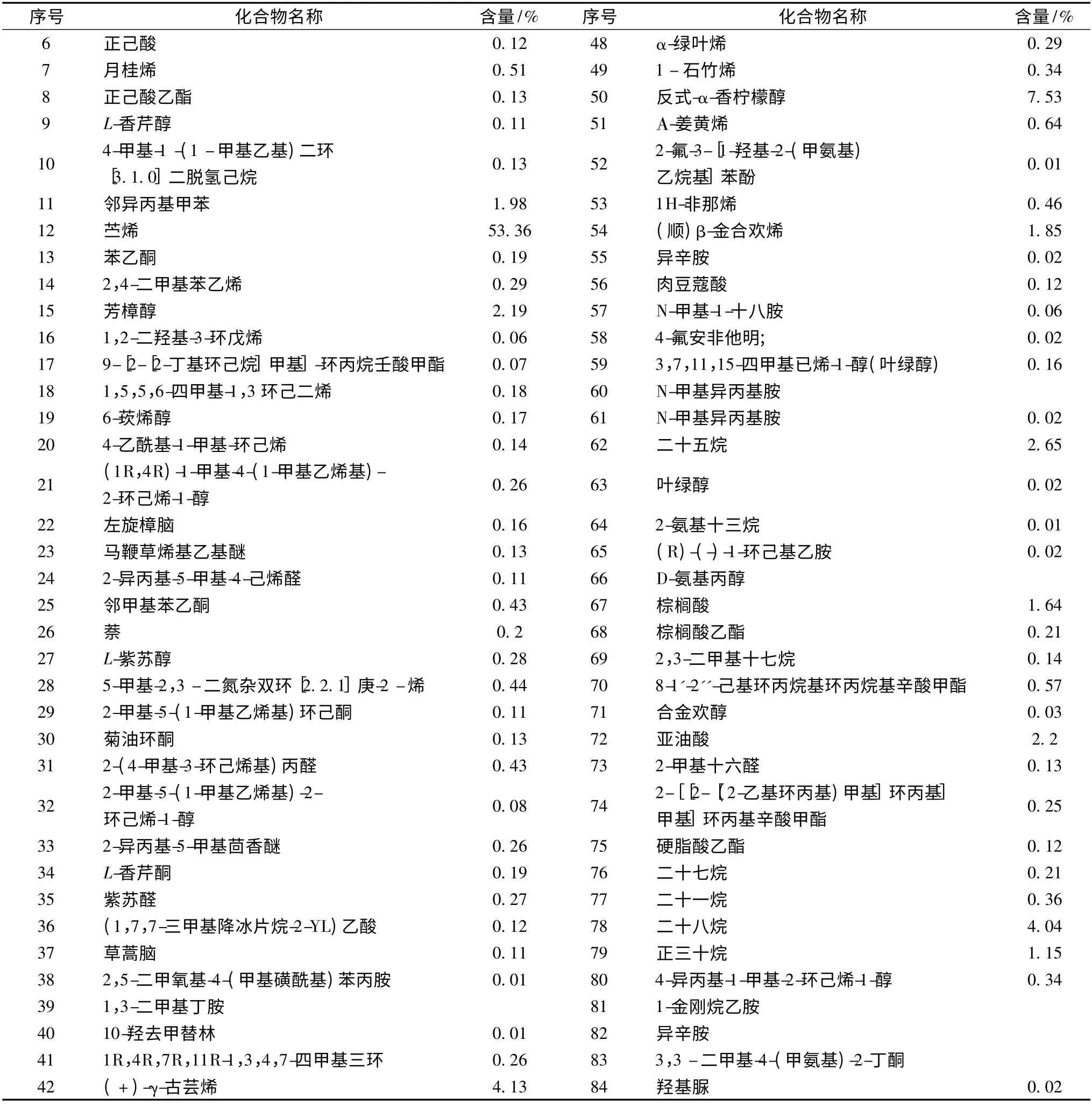
序号 化合物名称 含量/%序号 化合物名称 含量/%6正己酸0.1248α-绿叶烯0.29 7月桂烯0.51491 -石竹烯0.34 8正己酸乙酯0.1350反式-α-香柠檬醇7.53 9L-香芹醇0.1151Α-姜黄烯0.64 104-甲基-1 -(1 -甲基乙基)二环[3.1.0]二脱氢己烷0.13522-氟-3-[1-羟基-2-(甲氨基)乙烷基]苯酚0.01 11邻异丙基甲苯1.98531H-非那烯0.46 12苎烯53.3654(顺)β-金合欢烯1.85 13苯乙酮0.1955异辛胺0.02 142,4-二甲基苯乙烯0.2956肉豆蔻酸0.12 15芳樟醇2.1957N-甲基-1-十八胺0.06 161,2-二羟基-3-环戊烯0.06584-氟安非他明;0.02 179-[2-[2-丁基环己烷]甲基]-环丙烷壬酸甲酯0.07593,7,11,15-四甲基已烯-1-醇(叶绿醇)0.16 181,5,5,6-四甲基-1,3 环己二烯0.1860N-甲基异丙基胺196-莰烯醇0.1761N-甲基异丙基胺0.02 204-乙酰基-1-甲基-环己烯0.1462二十五烷2.65 21(1R,4R)-1-甲基-4-(1-甲基乙烯基)-2-环己烯-1-醇0.2663叶绿醇0.02 22左旋樟脑0.16642-氨基十三烷0.01 23马鞭草烯基乙基醚0.1365(R)-(-)-1-环己基乙胺0.02 242-异丙基-5-甲基-4-己烯醛0.1166D-氨基丙醇25邻甲基苯乙酮0.4367棕榈酸1.64 26萘0.268棕榈酸乙酯0.21 27L-紫苏醇0.28692,3-二甲基十七烷0.14 285-甲基-2,3 -二氮杂双环[2.2.1]庚-2 -烯0.44708-1'-2''-己基环丙烷基环丙烷基辛酸甲酯0.57 292-甲基-5-(1-甲基乙烯基)环己酮0.1171合金欢醇0.03 30菊油环酮0.1372亚油酸2.2 312-(4-甲基-3-环己烯基)丙醛0.43732-甲基十六醛0.13 322-甲基-5-(1-甲基乙烯基)-2-环己烯-1-醇0.08742-[[2-[(2-乙基环丙基)甲基]环丙基]甲基]环丙基辛酸甲酯0.25 332-异丙基-5-甲基茴香醚0.2675硬脂酸乙酯0.12 34L-香芹酮0.1976二十七烷0.21 35紫苏醛0.2777二十一烷0.36 36(1,7,7-三甲基降冰片烷-2-YL)乙酸0.1278二十八烷4.04 37草蒿脑0.1179正三十烷1.15 382,5-二甲氧基-4-(甲基磺酰基)苯丙胺0.01804-异丙基-1-甲基-2-环己烯-1-醇0.34 391,3-二甲基丁胺811-金刚烷乙胺4010-羟去甲替林0.0182异辛胺411R,4R,7R,11R-1,3,4,7-四甲基三环0.26833,3 -二甲基-4-(甲氨基)-2-丁酮42(+)-γ-古芸烯4.1384羟基脲0.02
由表1 可知,以峰面积归一化法分析各个组分的相对含量,从超临界流体萃取的昆仑雪菊油树脂精油中鉴定出84 种化合物,其中,含量最高的是苎烯,较高的是1,2-二羟基-3-环戊烯、邻异丙基甲苯、(-)-乙酰基-L-酒石酸、L-香芹酮、(+)-γ-古芸烯、反式-α-香柠檬醇、β-金合欢烯、叶绿醇、亚油酸、二十八烷、正三十烷、二十五烷。张彦丽等[8]通过GC-MS 对昆仑雪菊挥发油成分进行了研究,鉴定出其主要成分也为苎烯(63.23%),但采用的挥发油提取技术是蒸馏提取法,技术路线与本文没有相同之处。
2.2 抑菌试验结果分析
2.2.1 昆仑雪菊油树脂精油对细菌和霉菌的抑制作用
由表2 可知,昆仑雪菊油树脂精油对3 种细菌和2 种霉菌均有抑制作用。对细菌的抑制作用表明:金鸡菊油树脂精油对细菌的抑制作用均较强,且金鸡菊油树脂精油对大肠杆菌和金黄色葡萄球菌的抑制作用强于对枯草杆菌的抑制作用;对霉菌的抑制作用表明:金鸡菊油树脂精油对青霉的抑制作用明显高于对黑曲霉的抑制作用。随着提取物浓度的增加,其对所研究作用物的抑制作用相应增强。

表2 昆仑雪菊油树脂精油的抑菌作用Table 2 Antibacterial activity of the Coreopsis oleoresin essential oil
2.2.2 昆仑雪菊油树脂精油对细菌和霉菌最低抑制浓度的测定
由表3 可知,昆仑雪菊油树脂精油对大肠杆菌的最小抑菌浓度(MIC)值为25%,对金黄色葡萄球菌和枯草杆菌的MIC 值为50%和75%,对革兰氏阳性菌的抑菌效果明显优于革兰氏阴性菌。昆仑雪菊油树脂精油青霉的MIC 值为50%;而黑曲霉的MIC 值为75%。昆仑雪菊油树脂精油对不同菌的最低抑制浓度不同,但总体上对细菌的抑制最低浓度要低于真菌最低浓度。

表3 昆仑雪菊油树脂精油的MIC 试验结果Table 3 Result of MIC of the Coreopsis oleoresin essential oil
通过昆仑雪菊油树脂精油成分分析结果,可以看出昆仑雪菊油树脂精油中,含量较丰富的酯类:棕榈酸乙酯、烷基辛酸甲酯、硬脂酸乙酯、乙酸橙花酯。因为化学结构的差异,酯类物质可能有抑制微生物的作用。
不同提取方法对油树脂精油的MIC 也有很大影响。不同提取方法影响油树脂精油的活性成分、纯度及浓度,从而影响抑菌效果。该实验采用超临界流体萃取法提取油树脂精油,易受萃取时间、萃取压力等因素影响,其结果可能会造成精油活性成分析不全和有效成分流失。
3 结论
从昆仑雪菊油树脂精油中共鉴定出84 个化合物,其中烯类(64.12%)、醇类(11.47%)、烷烃类(8.76%)、酸类(6.31%)、酯类(1.5%),含量占总量的92.16 %。昆仑雪菊油树脂精油对细菌、霉菌有一定的抑制效果。昆仑雪菊油树脂精油对大肠杆菌的最小抑菌浓度(MIC)值为25%,对金黄色葡萄球菌、枯草杆菌、青霉和黑曲霉的MIC 值分别为50%、75%、50%和75%。
[1] 李冬明. 昆仑雪菊的药学研究进展[J]. 浙江中医杂志,2012,47(10):776 -777.
[2] 张彦丽. 新疆昆仑雪菊化学成分基础研究及其总黄酮提取工艺的筛选[D]. 乌鲁木齐:新疆医科大学药学院,2013.
[3] 任志艳,敬思群,晏小欣. 新疆金鸡菊活性成分定性分析[J]. 食品工业,2011(7):93 -94.
[4] 木合布力·阿布力孜. 新疆昆仑雪菊化学成分的初步定性研究[J]. 新疆医科大学学报,2010,33(6):628 -630.
[5] 赵军,孙玉华,徐芳,等. 昆仑雪菊黄酮类成分研究[J]. 天然产物研究与开发,2013,25(1):50 -52.
[6] 郑大成,木合布力·阿布力孜. 昆仑雪菊水溶性黄酮的制备及初步鉴定[J]. 亚太传统医药.2010.10(6):18-21.
[7] 张燕,李琳琳,木合布力·阿布力孜. 新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响[J]. 中国实验方剂学杂志.2011,3(17):166 -169.
[8] 张彦丽,韩艳春,阿依吐伦·斯马义.GC-MS 对昆仑雪菊挥发油成分的研究[J]. 新疆医科大学学报,2010,33(11):1 299 -1 300.
[9] 王巨媛,翟胜. 植物精油应用进展及开发前景展望[J]. 江苏农业科学,2010(4):1 -3.
[10] Mehdi Rahimi-Nasrabadi,Farhad Ahmadi,Hossein Batooli.Chemical composition of essential oil and in vitro antioxidant activities of the essential oil and methanol extracts of Eucalyptus loxophleba[J].Natural Product Research,2012,26 (7):669 -674.
[11] Singh G,Maurya S.A comparison of chemical antioxidant and antimicrobia1 studies of cinnamon leaf and bark volatile oils,oleoresins and their constituents[J].Food and Chemical Toxicology,2007,45(9):1 650 -1 661.
[12] 胡林峰,许明录,朱红霞. 植物精油抑菌活性研究进展[J]. 天然产物研究与开发,2011(2):384 -391.
[13] Suzan Ozturk,Sezai Ercisli.The chemical composition of essential oil and in vitro antibacterial activities of essential oil and methanol extract of Ziziphora persica Bunge[J].Journal of Ethnopharmacology,2006,106 (3):372 -376.
[14] 霍文兰. 谷糠油成分的超临界CO2流体萃取及GC-MS分析[J]. 食品科学,2009,20(30):324 -326.
[15] 赵鑫,张宝月,黄蓉,等. 甜橙精油的挥发性成分分析及抗氧化和抑菌活性研究[J]. 应用化工,2013,42(3):575 -577.
