单增李斯特氏菌磷脂酶C(lm-plcB)基因的克隆表达及其在油脂脱胶中的应用*
2013-08-12余榛榛常明刘睿杰金青哲刘元法王兴国
余榛榛,常明,刘睿杰,金青哲,刘元法,王兴国
(食品科学与技术国家重点实验室 食品安全与营养协同创新中心 江南大学食品学院,江苏 无锡,214122)
单核细胞增多性李斯特菌(L. monocytogenes,简称Lm)是一种重要的食源性致病菌,兼性厌氧。温度适应性很强,-20℃时仍可部分存活,巴氏消毒也不能完全灭活。菌株对营养要求不高,能在物体表面形成生物膜对抗菌物质有抵抗作用,抗逆性较强,包括耐酸,耐反复冻溶,耐干燥以及耐盐[1]。Lm 在自然界中广泛存在,易在野生动物、家畜、鸟类、昆虫、污水、土壤和植物中生长,相关产品如牛、羊、家禽、乳制品、水果、蔬菜、熟肉制品、海产品中也常能检测到该菌。
研究表明,磷脂酶C(Phospholipase C,PLC)是Lm 的主要毒力因子[1],在细胞代谢、信息传递和抗血小板功能等方面起着重要作用。国内外已将其作为重要生理活性成分及医药原料,广泛应用于药品、化妆品、食品加工等领域[2-4]。PLC 的作用位点为甘油磷脂C3 位酯键,水解生成甘油二酯(DAG)及磷脂酸化合物,如磷酸胆碱、磷酸乙醇胺、磷酸丝氨酸以及磷酸肌醇等(图1)。由于PLC 水解磷脂生成的DAG 是油脂的正常组分,DAG 的变化不仅不会影响精炼油脂的品质,而且可以提高精炼油得率,近年来日益得到油脂行业的关注,将其应用于油脂酶法脱胶。

图1 磷脂酶C 水解磷脂图Fig.1 Phospholipase C hydrolyze phospholipids
PLC 酶法脱胶具有适用性广,反应条件温和,生产中节省酸碱化学品的消耗,几乎不产生皂脚和废水,经济效益增长明显等一般酶法脱胶的共同优点,但相较于其他的酶法脱胶,如磷脂酶A (Phospholipase A ,PLA)酶法脱胶,PLC 酶法脱胶不仅能大大缩短脱胶反应时间,还能有效提高毛油得率,降低毛油损耗,通常每500 mg/L 磷就可以提高约1%的油产量[5],该特点在粮食价格持续上涨的现今社会显得尤为重要。本文通过克隆单增李斯特氏菌plcB 基因,重组表达PLC,并应用该酶对不同的植物毛油进行脱胶研究,具有较大的经济价值和现实意义。
1 材料和方法
1.1 材料
1.1.1 菌株和质粒
单核细胞增多性李斯特菌(L. monocytogenes)CICC No.21540,购自中国工业微生物菌种保藏管理中心(CICC);大肠杆菌(Escherichia coli)JM109、BL21(DE3)、表达载体pET-28a(+)均由本实验室保存;克隆载体pMD18-T simple,购自大连宝生物(TaKaRa)公司。
1.1.2 主要试剂
T4 DNA 连接酶、限制性核酸内切酶NotⅠ、EcoRⅠ,均购自NEB 公司;对硝基磷酸胆碱(p-nitrophehylphosphoryl-choline,简称p-NPPC)、考马斯亮蓝R-250,购自Sigma 公司;蛋白分子质量标准(低)、Ex Taq DNA 聚合酶、DNA Marker DL10000,均购自大连宝生物(TaKaRa)公司;饱和酚、硫酸卡那霉素(Kana)、氨苄青霉素(Amp)、SanPrep 柱式质粒DNA 小量抽提试剂盒、SanPrep 柱式DNA 胶回收试剂盒,San-Prep 柱式PCR 产物纯化试剂盒、丙烯酰胺,N,N’-甲叉双丙烯酰胺(Bis),购自上海生工生物工程公司;大豆毛油,由中粮提供;菜籽毛油,由湖州新市油厂提供;米糠毛油,由镇江丹阳油厂提供;其他试剂为国产分析纯。
1.1.3 培养基
脑心琼脂培养基:心提取物5 g/L,脑提取物12.5 g/L,蛋白胨10 g/L,葡萄糖2 g/L,NaCl 5 g/L,Na2HPO42.5 g/L,琼脂15 g/L,pH 7.4。
LB 液体培养基:蛋白胨10 g/L,NaCl 10 g/L,酵母粉5 g/L,pH 7.4。抗性筛选时加入氨苄青霉素或卡那霉素至终浓度为100 g/mL;LB 固体培养基,添加20 g/L 的琼脂粉。
TB 液体培养基:蛋白胨12 g/L,酵母粉24 g/L,甘油4 mL/L,磷酸盐缓冲液(K2HPO412.54 g、KH2PO42.31g)100 mL/L。
1.2 L. monocytogenes 基因组DNA 的提取及lmplcB 基因的克隆
L. monocytogenes 基因组的提取参照/氯仿-CTAB法[6]。
根据NCBI 上提供的L. monocytogenes 的plc 基因序列(YP 005964174.1)为模板,去掉信号肽后设计上下游引物:上游引物P1:5’-CGGAATTCATGTGTTGTGATGAATACTTACAAA-3'(EcoRI);下游引物P2: 5 ’-ATGCGGCCGCTTATTCATTTGTTTTTTT-3'(NotI)。PCR 反应条件为:94℃,5 min;94℃,30 s,50℃,30 s,72℃,1 min,30 个循环;72℃,10 min,4 ℃保温。
PCR 产物经SanPrep 柱式PCR 产物纯化试剂盒纯化回收后,与pMD18-T simple 连接,连接产物转化大肠杆菌感受态细胞E. coil(JM109),经Amp-LB 培养基过夜培养筛选阳性克隆,PCR 鉴定后测序,命名为pMD18-T-lm-plcB。
1.3 重组表达载体的构建
用限制性内切酶EcoR I 和Not I 对重组载体pMD18T-lm-plcB 和表达载体pET28a(+)进行双酶切。酶切产物经SanPrep 柱式DNA 胶回收试剂盒纯化后利用T4 DNA 连接酶连接,连接产物转化大肠杆菌感受态细胞E. coli(JM109),经Kana-LB 培养基筛选,并对阳性菌落进行PCR 和酶切鉴定。
1.4 重组磷脂酶C 的诱导表达
分别将表达质粒pET28a-lm-plcB 和pET28a(+)转化原核表达菌株E. coli BL21(DE3),将获得的阳性克隆E. coil BL21(DE3)/pET28a-lm-plcB 接种于Kana-LB 液体培养基中,37℃,200 r/min 培养12 h作为种子液。随后将种子液按5%接种量接种于Kana-TB 培养基中,37℃、200 r/min 振荡培养进行发酵。当培养物OD600达到0.6 ~0.8 时,加入终浓度为1 g/L 的乳糖于37℃诱导16 h。离心收集菌体,超声破壁后利用卵黄平板法和SDS-PAGE 鉴定分析重组蛋白[7-8]。
1.5 p-NPPC 法测定磷脂酶C 酶活力
对硝基磷酸胆碱(p-nitrophehylphosphoryl-choline,简称p-NPPC)是卵磷脂的一种结构类似物。PLC 可以分解p-NPPC 生成一种显黄色的对硝基苯酚,对硝基苯酚在410 nm 处有最大吸收,可反映PLC水解p-NPPC 产生对硝基苯酚的量,从而根据对硝基苯酚标准曲线定量计算出相应磷脂酶C 活力[9-10]。
酶活单位定义为pH 7.2,37℃条件下,每分钟水解p-NPPC 生成1 nmol 对硝基苯酚所需的酶量为1个活力单位(U)[11]。酶反应体系:50mmol/L Tris-HCl(pH 7.2),10 mmol/L p-NPPC。100μL 的反应系统中加入10μL 的酶样品溶液,37℃反应30 min[10]。
1.6 E. coil BL21(DE3)/pET28a-lm-plcB 诱导条件的优化
诱导接种量、诱导剂添加时间、诱导温度、诱导剂浓度、诱导时间等因素对产酶的影响随重组蛋白的种类不同而有所不同。本实验通过改变单因子的方法对诱导条件进行优化,以p-NPPC 法获得的酶活大小作为优化参考标准。
1.6.1 诱导接种量的优化
在培养基中分别接入1%、2%、3%、4%、5%的菌种,不同接种量分别做3 个平行。扩培4 h 后添加终浓度为1 g /L 的乳糖开始诱导表达,37℃、200 r/min 诱导24h 后检测发酵液OD600值,并取等体积的发酵液超声破碎后测定酶活力,确定最适接种量。
1.6.2 诱导剂添加时间的优化
分别在重组菌接种后0、2、4、6、8、10、12、14、16、18、20 h 添加终浓度为1 g /L 的乳糖进行诱导,37℃、200 r/min 诱导24 h 后确定最适诱导时间。实验方法同上,每个时间梯度设置3 个平行实验。
1. 6. 3 诱导温度的优化
添加乳糖至终浓度1 g /L 后分别在18、25、30、37℃对重组菌株进行诱导表达,每个温度梯度设置3个平行实验。实验方法同上,根据实验结果确定最适诱导温度。
1. 6. 4 诱导剂浓度的优化
在上述已优化的诱导基础上,添加乳糖至终浓度为1、2.5、5、8、10、15、20 g /L 进行梯度诱导,不同的乳糖浓度设置3 个平行实验。实验方法同上,根据结果确定最适诱导剂浓度。
1. 6. 5 诱导时间的优化
在上述已优化的诱导条件下进行诱导,分别诱导4、6、8、10、12、14、16、18、20、22、24、26、28、30 h 后,检测发酵液OD600值,并取等体积的发酵液,超声破碎细胞后测定酶活力大小,确定最适诱导时间。不同的诱导时间设置3 个平行实验。
1.7 磷脂酶C 脱胶效果
将植物毛油(大豆毛油、菜籽毛油、米糠毛油)于具塞三角烧瓶中水浴加热到80 ℃,加入总毛油质量0.5%,浓度45%(w/w)的柠檬酸溶液,在500 r/min搅拌20 min,进行酸预处理。将经过酸预处理的油样冷却至47℃,加入4% NaOH 溶液调节pH 至5 。再加入油重1%的蒸馏水和油重1%的重组磷脂酶C,均匀混合后,在62℃下300 r/min 搅拌1 h,进行酶反应。反应结束后将油样置于90℃水中加热10 min 灭酶,再测定磷含量[12]。
油相pH 的测定:用50 mL 离心管取油水混合物40 g,在5 000 r/min 离心10 min,弃去上层油相,向沉淀中加入5 mL 的蒸馏水,充分搅拌混合后再次在5 000 r/min 离心10 min,取离心管中水相用pH 计测定pH 值,经校正后采用。油相pH 为5.0 左右时的经验校正公式:pH 实际=pH 测定-0.3[13]。
磷含量的测定:将脱胶后的油样于10 000 r/min下离心10 min,取5 g 上层油样进行磷含量测定。油脂中磷含量测定参照GB/T5537 -2008。
2 结果与分析
2.1 L. monocytogenes 基因组DNA 的提取及lmplcB 基因的制备
以L. monocytogenes 全基因序列为模板,以引物P1 和P2 进行PCR 扩增,产物进行1%琼脂糖凝胶电泳,扩增出的DNA 片段在约810bp 处,与预期大小相符(图2)。测序结果显示目的片段与L. monocytogenes 的plc 基因序列(YP 005964174.1)相似度达到99%,蛋白质序列相似度为100%。

图2 lm-plcB 的PCR 鉴定Fig.2 PCR result of lm-plcB
2.2 重组表达载体pET28a-lm-plcB 的鉴定
对构建的表达质粒pET28a-lm-plcB 进行菌落PCR 验证,在810bp 处有目的条带;进一步对pET28a-lm-plcB 进行EcoRⅠ和NotⅠ双酶切鉴定,分别获得约5 300 bp 和约810 bp 的条带(图3),与预期结果相符。

图3 pET28a-lm-plcB 的酶切鉴定Fig.3 Restriction enzyme digestion analysis pET28a-lm-plcB by EcoRⅠand NotⅠ
2.3 E. coil BL21(DE3)/pET28a-lm-plcB 诱导表达及产物活性鉴定
E. coil BL21(DE3)/pET28a-lm-plcB 经诱导表达后超声破碎,12 000 r/min 分离上清液。利用卵黄硼砂平板分析重组PLC 的活性,结果显示:E. coil BL21(DE3)/pET28a 在卵黄硼砂平板上没有出现水解圈,重组PLC 产生乳白色水解圈,且添加10 mol/L Mg2+后水解圈明显增大,说明该重组蛋白对天然磷脂底物具有PLC 活性,Mg2+对其分解天然底物的活性具有促进作用(图4)。
SDS-PAGE 电泳结果表明 E. coil (BL21)/pET28a-lm-plcB 表达了相对分子质量约为30.4 kDa的重组蛋白,与预期大小相符(图5)。

图4 重组蛋白的活性检测Fig.4 Analysis of recombinant PLC activity
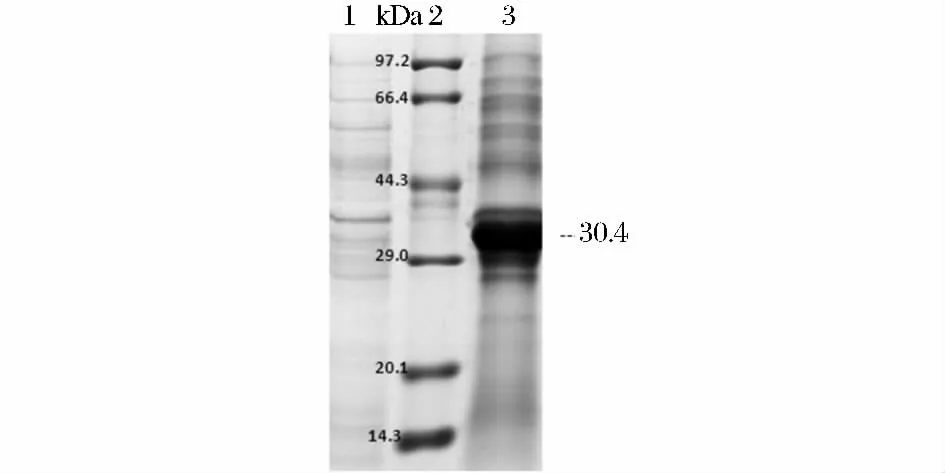
图5 重组PLC 的SDS-PAGEFig.5 SDS-PAGE analysis of recombinant PLC in E.coil BL21(DE3)/pET28a-lm-plcB
2.4 E. coil BL21(DE3)/pET28a-lm-plcB 诱导条件的优化
2.4.1 诱导接种量的优化
由图6 可知,在接种量为4%时,重组菌产酶量达到最大,约159.1 U/mL,故最适接种量为4%。
2.4.2 诱导剂添加时间的优化

图6 不同接种量对产酶的影响Fig.6 Effect of inoculation on cell density and PLC activity
由图7 可知,在接种后2h 添加乳糖,重组菌产酶量达到最大值,约411.9 U/mL 左右。故乳糖添加时间为转接后2 h。

图7 乳糖添加时间对酶活力的影响Fig.7 Effect of lactose addion time on cell density and PLC activity
2.4.3 诱导温度的优化
如图8,诱导温度为25℃时,重组蛋白的酶活力达到最大,可达到431.5 U /mL 左右。故选取发酵产酶的诱导温度为25℃。

图8 添加乳糖时诱导温度对产酶的影响Fig.8 Effect of lactose concentration on cell density and PLC activity
2.4.4 诱导剂浓度的优化
由图9 可见,在乳糖浓度为2.5 g /L 时,重组菌产酶量达到最大,约633.1 U /mL 左右,故乳糖诱导剂的最适诱导浓度为2.5 g/L。
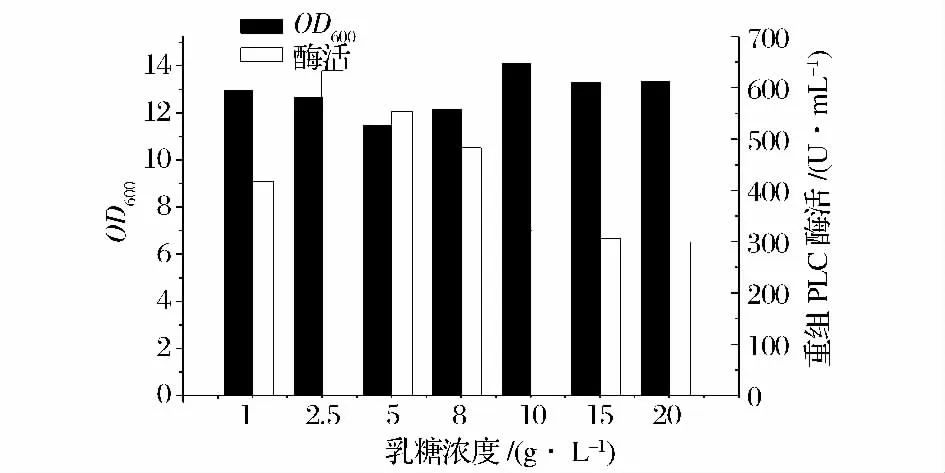
图9 乳糖质量浓度对酶活力的影响Fig.9 Effect of lactose concentration on cell density and PLC activity
2.4.5 诱导时间的优化
由图10 可知,乳糖添加后26 h,重组蛋白的酶活力达到最大值,约为754.6 U /mL,故最适诱导时间为26 h。

图10 添加乳糖时诱导时间对产酶的影响Fig.10 Effect of lactose induction time on phospholipase activity
2.5 重组磷脂酶C 脱胶效果的初步研究
利用该重组PLC 对不同植物毛油进行脱胶,最终将大豆毛油中的含磷量从216.67 mg/kg 下降到3.705 mg/kg,磷含量降低了98.40%;菜籽毛油中的含磷量从183.7 mg/kg 下降到4.503 mg/kg,磷含量比脱胶前降低了97.55%;米糠毛油中的含磷量从306.8 mg/kg 下降到50.191 mg/kg,磷含量比脱胶前降低了83.63%。
3 讨论
本文对单增李斯特氏菌来源的lm-plcB 基因在大肠杆菌中进行了重组表达,并首次应用单增李斯特氏菌来源的重组PLC 对不同的植物毛油进行脱胶,最终使大豆毛油和菜籽毛油的磷含量降低到了5 mg/kg以下,避免了传统油脂精炼环节的脱酸处理,可以实现油脂的物理精炼。利用PLC 脱胶,油脂中的水化磷脂可以被水解生成DAG 和水溶性磷酸酯,DAG 作为油脂的固有组分可以伴随油相被回收,避免了中性油的损失,大大降低了毛油炼耗率,较温和的处理条件也显著提高了油脂的品质。因此,单增李斯特氏菌来源的重组磷脂酶C 在油脂工业中的应用具有较大的经济意义和社会效益。
为了进一步开发符合工业化生产的磷脂酶C 制剂,还需对该重组磷脂酶C 的酶学性质进一步深入研究,探索其底物特异性,针对不同毛油产品,开发混合型酶制剂,增强产品的适应性,提升制剂的稳定性。相信随着PLC 结构功能研究的不断深入和油脂酶法脱胶技术的不断完善,PLC 酶法脱胶将得到进一步推广,油脂精炼也将更加符合健康、环保和低耗的理念。
[1] 邸薇. 单增李斯特菌iap、actA、plcB 基因的原核表达、产物的免疫原性分析以及重组p60 蛋白多抗的制备[D]. 广州:暨南大学,2012:8 -11.
[2] 陈明错. 磷脂酶C 抗血小板功能极其机制的研究[D].武汉:武汉大学,2002.
[3] De Maria L,Vind J,Oxenboll K M,et al. Phospholipases and their industrial applications[J]. Applied Microbiology and Biotechnology,2007,74(2):290 -300.
[4] 余榛榛,常明,刘睿杰,等. 磷脂酶C 在酶法脱胶中的研究进展[J]. 中国油脂,2013,38(7):19 -22.
[5] Barton N R.A new process for degumming:the use of phospholipase C to improve yields during refining of high phosphorus vegetable oils[C]. Seattle:The 99th AOCS Annual Meeting & Expo,2008:120.
[6] 徐义刚,李苏龙,谢晓峰,等. 食源性致病菌基因组DNA 的高效提取方法[J]. 东北林业大学学报,2009,37(2):73 -78.
[7] Chrisope G,Fox C,Marshall R T.Lecithin agar for dectection of microbial phospholipase[J].Appl ied and Environmental Microbiology.1976,31(5):784 -786.
[8] Gubash S.Improved egg-yolk agar plate medium for the detection of Clostridial phospholipase C activity[J].Research in Microbiology,1991,142(1):87 -93.
[9] 彭愈生,周定. 磷脂酶C 活性测定方法及其应用的研究[J]. 哈尔滨工业大学学报,1989,6(3):34 -38.
[10] Kurioka S,Matsuda M.Phospholipase C assay using p-nitrophehylphosphoryl-choline together with sorbitol and its application to studying the metal and detergent requirement of the enzyme[J].Analytical Bichemistry,1976,75(1):281 -289.
[11] Berka R M,Vasil M L.Phospholipase C (heat-labile)hemolysin of Pseudomonas aeruglnosa:purification and preliminary characterization[J].Journal of Bacteriology,1982,152(1):239 -245.
[12] 杨娇,金青哲,王兴国. 磷脂酶C 用于大豆油脱胶的工艺优化[J]. 中国油脂,2012,37(12):14 -17.
[13] Clausen K.Enzymatic oil-degumming by a novel microbial phospholipase[J]European Journal of Lipid Science and Technology,2001,103(6):333 -340.
