甘氨酸、脯氨酸促进高渗环境下Yarrowia lipolytica发酵甘油产赤藓糖醇*
2013-08-12杨利博郑志永詹晓北
杨利博,郑志永,詹晓北
(江南大学 生物工程学院糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
随着全球能源危机的出现和原油价格的不断飙升,生物柴油作为一种替代能源得到了蓬勃发展。甘油是生产生物柴油的主要副产物,每生产10 t 生物柴油,就有1 t 废弃粗甘油产生[1]。因此,废弃甘油的处理问题备受关注。而甘油可被作为优良碳源,利用微生物发酵法生产如单细胞蛋白、脂类、色素、多元醇、有机酸等多种高附加值产品[2]。因此,甘油作为一种储量巨大及价廉易得的可再生资源受到越来越多的研究者的青睐。
赤藓糖醇(erythritol)是多元醇的一种,学名1,2,3,4-丁四醇,因其具有吸湿性小,热稳定性好等优点,作为一种新型甜味剂和添加剂被广泛应用于食品、医药、化妆品和化工领域。赤藓糖醇几乎不被人体吸收,不会造成龋齿及血糖反应,被称作“零热量甜度剂”。商业化生产赤藓糖醇主要以葡萄糖为底物,利用嗜高渗酵母菌发酵产生,但发酵过程中会产生甘油、甘露醇或阿拉伯糖醇等副产物,增加下游分离的成本投入[3]。因此,寻找更为优良的菌种和廉价底物是提升行业竞争力的重要途径。解脂耶氏酵母(Yarrowia lipolytica)是一种非常规酵母,可很好地利用甘油作为碳源发酵生产赤藓糖醇[4],且处于高渗环境时,Y. lipolytica 会大量合成赤藓糖醇以抵御高渗环境对自身的破坏,其机理可能是多元醇作为相容物质,避免水分从胞内快速流失,保持细胞质膜的两侧的水活度。虽然高渗环境有利于赤藓糖醇的积累[5],但会抑制酵母生长,且过高的渗透压会使发酵停滞,导致生产强度低下。因此,提升酵母细胞的耐高渗能力是提升赤藓糖醇生产强度的关键。
氨基酸及其衍生物被广泛认为常见的渗透保护物质,其中甘氨酸、甘氨酸甜菜碱、脯氨酸、谷氨酸等作为渗透压保护剂被普遍应用于高渗发酵体系[6]。脯氨酸可在多种微生物胞内大量积累且对微生物几乎没有任何影响,因此脯氨酸被认为是最常用的渗透压保护剂。甘氨酸是另一种重要的渗透压保护剂,且已被证实其对Saccharomyces cerevisiae 的耐高渗能力具有显著提升作用[7]。虽然S. cerevisiae 的渗透调节机制已被深入研究,但研究集中在阐明渗透调节及渗透响应机制等方面,很少有研究者将这些机理应用于优化多元醇的发酵生产。本研究以甘油为底物,以Y. lipolytica 为发酵菌株,研究在高渗环境下,以甘氨酸、脯氨酸作为渗透压保护剂是否可以提升酵母菌的抵御高渗胁迫能力,从而高效地转化甘油生成赤藓糖醇。
1 材料与方法
1.1 菌株
解脂耶氏酵母(Y. lipolytica)CICC 1675,购自中国工业微生物菌种保藏中心。
1.2 培养基
斜面保藏培养基(g/L):甘油50.0,酵母膏10.0,琼脂20,pH 6.0。
种子培养基(g/L):甘油50.0,酵母膏10.0,MgSO4·7H2O 0.5,KH2PO40.2,pH 6.0。
高渗发酵培养基(g/L):甘油200.0,酵母膏1.0,尿素2.0,MgSO4·7H2O 1.0,KH2PO41.0,pH 3.0。
1.3 培养方法
种子液制备:250 mL 三角瓶中加入50 mL 种子培养基,接种1 环斜面菌体,30℃,250 r/min 旋转摇床培养24 h。
摇瓶发酵实验:250 mL 摇瓶中装入30 mL 发酵培养基,以10%的接种量接入上述种子液,30℃,250 r/min 旋转摇床中发酵120 h,发酵完成后测定各发酵参数。
发酵罐发酵实验:采用7L 机械搅拌发酵罐(BioFlo 115;New Brunswick Scientific Co. ,NJ,USA),装液量3L,接种量10%,搅拌转速800 r/min,通气量1.0 vvm,使用2.0 mol/L NaOH 维持发酵液pH 为3.0 ± 0.1,30℃下发酵,每隔6 ~12 h 取样分析,至底物耗尽,发酵结束。
1.4 分析方法
菌体浓度测定:取500 μL 发酵液,10 000 × g 离心10 min,去离子水洗涤2 次,稀释至10 mL,紫外分光光度计(model UV-2000;UNICO,Dayton,NJ)于600nm 下测定吸光度(OD600)。细胞干重测定是将待测样品于105℃下干燥至恒重,测其干重。OD600与细胞干重见方程(1):

甘油、赤藓糖醇浓度测定采用高效液相色谱(HPLC)法[8]。
胞内氨基酸含量测定:取5.0 mL 发酵液,10 000 ×g离心10 min,弃上清液,使用去离子水洗涤菌体2 次,并将菌体重悬于0.4 mL 去离子水中,沸水浴裂解细胞10 min,冷却至室温,10 000 × g 离心10 min,取上清液0.22 μm 膜过滤,使用氨基酸分析仪(Agilent Technologies Co. ,Palo Alto,USA)测定氨基酸含量。
渗透压值采用OSMOMAT 030 (Gonotec GmbH,Berlin,Germany)冰点渗透压仪测定[9]。
2 结果与讨论
2.1 初始渗透压对Y. lipolytica 生长及产赤藓糖醇影响
为了研究高渗透环境是否有利于赤藓糖醇的积累,在摇瓶水平,采用0 ~40 g/L NaCl 作为渗透压调节剂,分别调节发酵体系的渗透压为3.21 ± 0.15,3.54 ± 0.12,3.89 ± 0.10,4.17 ± 0.17,4.60 ±0.13 osmol/kg,发酵120 h,结果如图1 所示。

图1 渗透压对Y. lipolytica 菌体生长及赤藓糖醇产量影响Fig.1 Effects of osmotic pressures on cell growth and erythritol production by Y. lipolytica
由图1 可见,Y. lipolytica 对渗透压作用敏感,随着发酵体系初始渗透压的提升,菌体量从3.21 ±0.15 osmol/kg 时的16.0 ± 0.4 g/L 降至4.06 ±0.13 osmol/kg 时的8.8 ± 0.3 g/L;但赤藓糖醇产量却随着体系渗透压的提升而增加,并在渗透压为4.17 ± 0.17 osmol/kg 时达到最大值87.2 ± 2.9 g/L,产量比渗透压为3.21 ± 0.15 osmol/kg 时增加了34.7 g/L。可见,合适的初始高渗对赤藓糖醇的大量积累有促进作用。Ishizuka 等[10]和Park 等[11]报道较高的初始葡萄糖浓度有助于促进赤藓糖醇合成;Tomaszewska 等[5]和田柳等[12]发现通过添加适量NaCl提升发酵液渗透压可促进赤藓糖醇的合成,与本研究结果一致。但同时发现过高的渗透压会抑制菌体生长,导致发酵时间延长,赤藓糖醇生产强度降低。因此,选择4.17 ± 0.17 osmol/kg 为最适发酵初始渗透压。
2.2 渗透压对Y. lipolytica 胞内氨基酸组成及含量的影响
为了进一步阐明不同高渗环境对Y. lipolytica 胞内氨基酸组成及含量的影响,设计实验如下:在摇瓶水平,使用NaCl 调节发酵液初始渗透压分别为3.21± 0.15,3.54 ± 0.12,3.89 ± 0.10,4.17 ± 0.17,4.60 ± 0.13 osmol/kg,当菌种生长至指数后期(72h)时取样测定Y. lipolytica 胞内游离氨基酸含量,结果见表1。由结果可知,随着初始渗透压提高,胞内总氨基酸含量逐渐提升,当渗透压为4.60 ±0.13 osmol/kg 时,胞内氨基酸总量比低渗透压时(3.21 ± 0.15 osmol/kg)增加了52.7%。其中,脯氨酸含量提升了80.3%。Andreishcheva[13]等发现Y. lipolytica 在高盐环境下胞内甘油、游离氨基酸含量随盐浓度提升而增加,其中以脯氨酸和脂肪族氨基酸的增加最为明显;Xu[6]等发现Torulopsis glabrata在高渗环境下胞内氨基酸总量提升明显,其中脯氨酸,甘氨酸提升最为显著。

表1 不同渗透压对胞内游离氨基酸种类及含量的影响Table 1 Effects of osmotic pressure on the content of the intracellular free amino acids
2.3 外源添加甘氨酸和脯氨酸强化赤藓糖醇生产
高渗环境下,氨基酸及其衍生物被广泛认作胞内抵御环境压力的相容物质,其中甘氨酸、甘氨酸甜菜碱、脯氨酸等作为渗透压保护剂被普遍应用于高渗发酵体系[14]。由表1 所示,当发酵体系渗透压提高时,Y. lipolytica 胞内甘氨酸和脯氨酸合成量增加。为研究外源补充甘氨酸和脯氨酸是否有助于Y. lipolytica抵御高渗环境的生长抑制作用,促进赤藓糖醇的快速合成而设计实验如下:在摇瓶水平,使用NaCl 调节发酵体系渗透压为最适渗透压4.17 ± 0.17 osmol/kg,以未添加NaCl 的渗透压(3.21 ± 0.15 osmol/kg)做对照,分别添加不同浓度0 ~50 mg/L 甘氨酸、脯氨酸,发酵时间96 h。结果见图2。
从图2A 可见,在低渗条件下,添加不同浓度的甘氨酸和脯氨酸对菌体生长没有明显的促进作用,发酵结束时,菌体量都维持在15.8 ± 0.5 g/L 左右;与对照组相比,随着氨基酸浓度的增加,赤藓糖醇产量有轻微下降,但都在50.0 g/L 以上。由以上结果可见,低渗环境对菌体生长无抑制作用,且低渗条件下添加外源氨基酸对赤藓糖醇产量无促进作用。但受N 源浓度限值,最大菌体量维持在同一水平。

图2 甘氨酸、脯氨酸对低渗(3.21 ± 0.15 osmol/kg)赤藓糖醇发酵影响Fig.2 Effects of glycine and porline on erythritol fermentation at low osmotic pressure (3.21 ± 0.15 osmol/kg)
在高渗条件(图3)下,菌体生长被明显抑制,在未外源添加氨基酸的情况下,最大菌体量只有8.5 ±0.4 g/L 左右,但随着外源氨基酸浓度的提升,菌体量也逐渐增加,且分别在添加30 mg/L 甘氨酸和40 mg/L 脯氨酸时达到15.2 ± 0.3 g/L 和15.3 ± 0.4 g/L,生长促进作用明显,菌体量分别比未添加氨基酸时增加了82.6%和80.0%。赤藓糖醇产量在添加30 mg/L 甘氨酸和40 mg/L 脯氨酸时达到最大,为88.0± 2.1 g/L 和85.9 ± 1.6 g/L,但随着氨基酸浓度继续提升赤藓糖醇产量出现轻微下降。原因可能是外源氨基酸添加导致菌体生长速率加快,较多的碳源被菌体呼吸生成CO2而消耗,导致赤藓糖醇产量轻微下降。此外,从图3A、B 可看出,添加相同浓度的甘氨酸和脯氨酸时,甘氨酸在促进菌体生长和产物积累方面效果更为明显,这与Thomas 等[7]发现甘氨酸比脯氨酸更有助于保持S. cerevisiae 在酒精发酵中的活性结果一致。外源添加氨基酸可协助酵母细胞抵御高渗环境的原因可能有如下两点:(1)细胞暴露于高渗环境时,细胞会合成相容性物质来抵御渗透压破坏,但细胞自身合成的氨基酸浓度较低,不能充分满足细胞抵御高渗破坏,因此,微生物会从外部环境吸收氨基酸并在胞内积累,从而达到抵御高渗环境的目的;(2)氨基酸不仅可作为渗透压保护剂在酵母胞内积累,也可被酵母细胞作为C 源或N 源加以利用,从而促进细胞生长,该现象已经在S. cerevisiae 得到证实[15]。因此,最终确定外源氨基酸添加量为甘氨酸30 mg/L,脯氨酸40 mg/L。
2.4 Y. lipolytica 转运外源氨基酸抵御高渗胁迫
已有报道称在高渗环境下,Y. lipolytica 会合成更多的游离氨基酸来抵御环境胁迫作用[13]。而外源添加甘氨酸和脯氨酸对高渗环境下菌体生长有良好的促进作用(图3A)。因此,为验证Y. lipolytica 是否从胞外转运氨基酸至胞内以增强细胞抵御高渗的能力,本实验测定了不同高渗下(4.17 ± 0.17 osmol/kg,4.60 ± 0.13 osmol/kg),外源添加甘氨酸和脯氨酸时,胞内甘氨酸和脯氨酸含量的变化,以考察氨基酸转运对细胞耐高渗作用的影响,结果见表2。
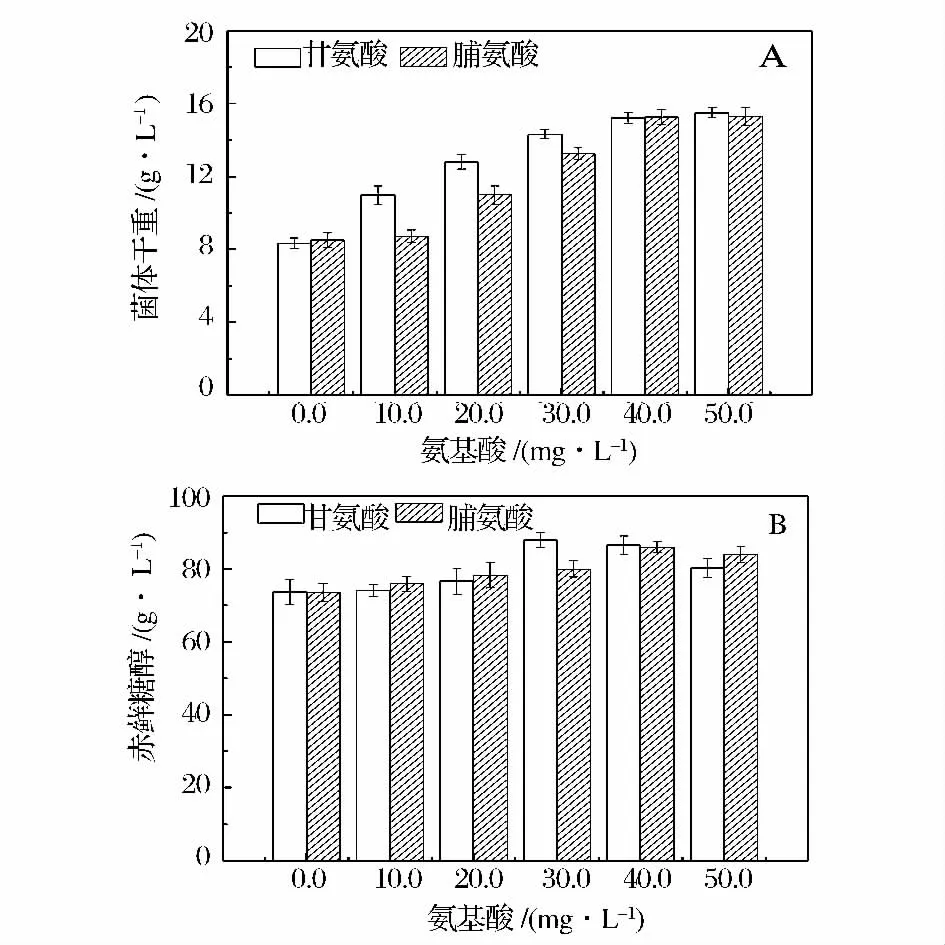
图3 甘氨酸、脯氨酸对高渗(4.17 ± 0.17 osmol/kg)赤藓糖醇发酵影响Fig.3 Effects of glycine and porline on erythritol fermentation at high osmotic pressure (4.17 ± 0.17 osmol/kg)
当添加相同浓度的外源甘氨酸和脯氨酸时,随着发酵初始渗透压的提升,胞内甘氨酸和脯氨酸的含量都有不同程度的增加。此外,在相同渗透压下,随着外源氨基酸添加量的提升,胞内氨基酸含量也快速增加。当在渗透压为4.17 ± 0.17 osmol/kg 时,添加30 mg/L 甘氨酸,胞内甘氨酸含量比未添加是时增加了884.6%,而添加40 mg/L 脯氨酸使胞内氨基酸含量比未添加时增加了407.5%。随着外源氨基酸添加量的提升,胞内甘氨酸积累量的提升比脯氨酸更显著,而在S. cerevisiae 中,甘氨酸也是渗透保护剂甜菜碱的前体物质[7],甘氨酸浓度的提升有助于甜菜碱的大量合成,这可能是导致甘氨酸比脯氨酸更有利于提升Y. lipolytica 耐高渗能力的原因。
2.5 甘氨酸和脯氨酸提升赤藓糖醇生产强度
在7 L 发酵罐水平,调节发酵培养基的初始渗透压为4.17 ± 0.17 osmol/kg,加入30 mg/L 甘氨酸和40 mg/L 脯氨酸,底物耗尽时发酵结束。由结果(图4,表3)可见,与未添加氨基酸时发酵过程相比,添加30 mg/L 甘氨酸和40 mg/L 脯氨酸可显著促进菌体生长速度和缩短发酵时间。发酵结束时,生物量增至20.3 ± 0.7 g/L,比未添加氨基酸时增加了4.63%;而发酵时间由108 h 缩短至90 h。此外,甘油消耗速率提升明显(图4 B),由1.77 ± 0.04 g/(L·h)增加至2.13 ± 0.03 g/(L·h),增加了20.3%;而赤藓糖醇生产强度也显著提升,由0.83 ±0.03 g/(L·h)提升至1.04 ± 0.05 g/(L·h),提升了25.3%。但赤藓糖醇最终产量及得率与未添加氨基酸时相比提升并不明显,仅为4.12%和4.26%,原因可能是渗透压是决定赤藓糖醇最终浓度及底物转化率的重要因素,当发酵液初始渗透压处于同一水平时,添加渗透压保护剂只提升了Y. lipolytica 抵抗高渗抑制生长的能力,并不能显著提升赤藓糖醇的转化率。

表2 渗透压对氨基酸转运的影响Table 2 Effects of osmotic pressure on the transport of glycine and proline

图4 高渗条件下添加渗透压保护剂对赤藓糖醇发酵影响Fig.4 Effect of osmoprotectants on erythritol fermentation by Y. lipolytica at 4.17 ± 0.17 osmol/kg
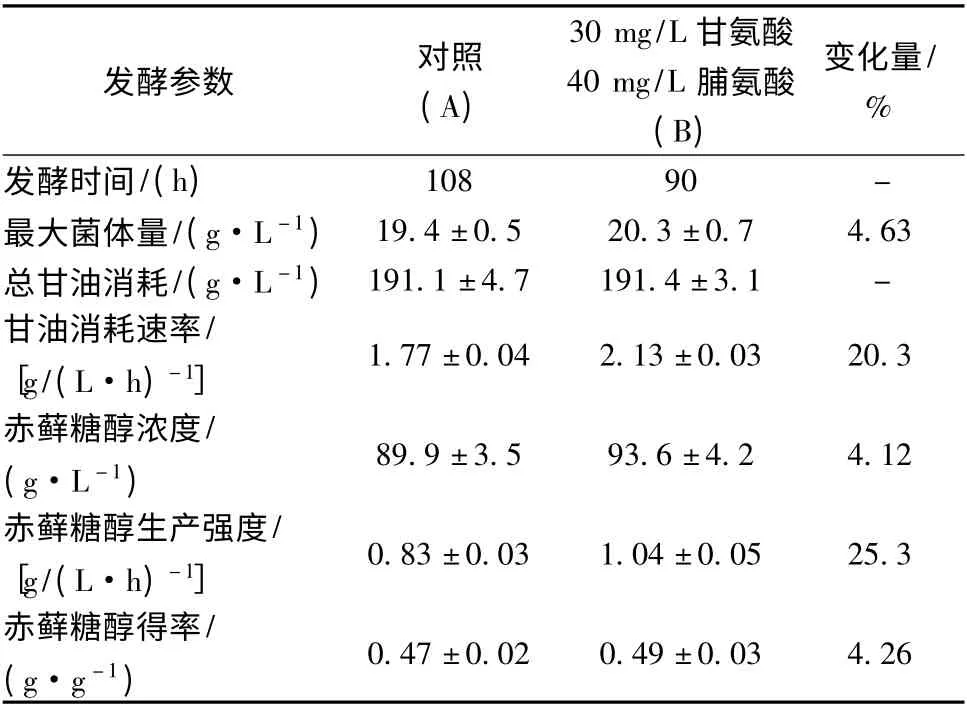
表3 高渗条件下渗透压保护剂添加前后赤藓糖醇发酵参数对比Table 3 Comparison of parameters in erythritol fermentation by Y. lipolytica at 4.17 ± 0.17 osmol/kg with and without osmoprotectants addition
3 结论
(1)以甘油为底物发酵生产赤藓糖醇过程中,初始渗透压是决定赤藓糖醇最终产量及得率的重要因素,高渗对赤藓糖醇合成有促进作用,但会抑制Y. lipolytica 的生长。本研究中,最适初始渗透压为4.17± 0.17 osmol/kg。
(2)不同的初始渗透压可改变胞内游离氨基酸的组成及含量,渗透压的提升会促进胞内游离氨基酸总量的增加。当添加外源氨基酸时,Y. lipolytica 会将其转运至胞内并大量积累,以提升自身耐高渗能力。
(3)甘氨酸和脯氨酸是Y. lipolytica 良好的渗透压保护剂,添加30 mg/L 的甘氨酸和40 mg/L 的脯氨酸可有效提升赤藓糖醇的生产强度,但对于提升甘油到赤藓糖醇转化率效果不明显。
[1] Yazdani S S,Gonzalez R. Anaerobic fermentation of glycerol:a path to economic viability for the biofuels industry[J]. Current Opinion in Biotechnology,2007,18 (3):213 -219.
[2] Mattam A J,Clomburg J M,Gonzalez R,et al. Fermentation of glycerol and production of valuable chemical and biofuel molecules [J]. Biotechnology Letters,2013,35(6):1 -12.
[3] Moon H J,Jeya M,Kim I W,et al. Biotechnological production of erythritol and its applications[J]. Applied Microbiology and Biotechnology,2010,86 (4):1 017-1 025.
[4] Rymowicz W,Rywińska A,Marcinkiewicz M. High-yield production of erythritol from raw glycerol in fed-batch cultures of Yarrowia lipolytica [J]. Biotechnology Letters,2009,31 (3):377 -380.
[5] Tomaszewska L,Rywinska A,Gladkowski W. Production of erythritol and mannitol by Yarrowia lipolytica yeast in media containing glycerol[J]. Journal of Industrial Microbiology & Biotechnology,2012,39 (9):1 333 -1 343.
[6] Xu S,Zhou J,Liu L,et al. Proline enhances Torulopsis glabrata growth during hyperosmotic stress[J]. Biotechnology and Bioprocess Engineering,2010,15 (2):285-292.
[7] Thomas K,Hynes S,Ingledew W. Effects of particulate materials and osmoprotectants on very-high-gravity ethanolic fermentation by Saccharomyces cerevisiae[J]. Applied and Environmental Microbiology,1994,60 (5):1 519-1 524.
[8] Savergave L S,Gadre R V,Vaidya B K,et al. Strain improvement and statistical media optimization for enhanced erythritol production with minimal by-products from Candida magnoliae mutant R23 [J]. Biochemical Engineering Journal,2011,55 (2):92 -100.
[9] Wucherpfennig T,Hestler T,Krull R. Morphology engineering -Osmolality and its effect on Aspergillus niger morphology and productivity [J]. Microbial Cell Factories,2011,10:58.
[10] Ishizuka H,Wako K,Kasumi T,et al. Breeding of a mutant of Aureobasidium sp. with high erythritol production[J]. Journal of Fermentation and Bioengineering,1989,68 (5):310 -314.
[11] Park J,Seo B,Kim J,et al. Production of erythritol in fed-batch cultures of Trichosporon sp.[J]. Journal of Fermentation and Bioengineering,1998,86 (6):577-580.
[12] 田柳,张涛,江波. 无机盐渗透压对假丝酵母SK25.001 发酵生产赤藓糖醇的影响[J]. 食品与发酵工业,2012,38 (10):44 -46.
[13] Andreishcheva E N,Isakova E P,Sidorov N N,et al.Adaptation to salt stress in a salt-tolerant strain of the yeast Yarrowia lipolytica [J]. Biochemistry-Moscow,1999,64 (9):1 061 -1 067.
[14] Han H-Y,Yao Z-G,Gong C-L,et al. The protective effects of osmolytes on yeast alcohol dehydrogenase conformational stability and aggregation [J]. Protein and Peptide Letters,2010,17 (8):1 058 -1 066.
[15] Takagi H,Sakai K,Morida K,et al. Proline accumulation by mutation or disruption of the proline oxidase gene improves resistance to freezing and desiccation stresses in Saccharomyces cerevisiae [J]. FEMS Microbiology Letters,2000,184 (1):103 -108.
