麻鸭脂肪氧合酶的分离纯化及其性质研究*
2013-08-12陈欣姚忠徐为民孙芸王道营
陈欣,姚忠,徐为民,孙芸,王道营
1(南京工业大学食品与轻工学院,江苏 南京,210014)2(江苏省农业科学院农产品加工研究所,江苏 南京,210014)
脂肪氧合酶(Lipoxygenase,LOXs),又称脂肪氧化酶,氧化还原酶属,是一类非血红素含铁蛋白,能够专一地催化具有cis,cis-1,4-戊二烯结构的多元不饱和脂肪酸的双加氧反应,形成具有共轭双键的多元不饱和脂肪酸的氢过氧化物[1-3]。
LOXs 家族成员众多,广泛存在于动物、植物、真菌、细菌、原生生物,甚至古细菌和病毒中[4-5],根据加氧位置的不同可分为多种同工酶[6],目前已知的LOXs 蛋白序列超过50 个,残基数在661(兔红细胞15-脂氧合酶)~923(水稻脂氧合酶-2)之间,其中植物来源的脂氧合酶较动物来源的平均多150 ~200个残基。
1932 年Andre 和Hou 首次发现大豆制品的豆腥味来源于多元不饱和脂肪酸的酶促氧化,而这一过程的关键酶就是LOX[7]。自此,有关LOXs 对于食品贮藏、加工中脂质氧化的影响逐渐引起人们的关注。
1988 年Grossman 等研究证实了鸡肉中存在LOX,且在-20 ℃保存12 个月酶活基本没有损失,并证实了低温冻藏的鸡肉中的脂肪氧化是与LOX 的作用有关的[8]。Gata 等人采用离子交换和疏水层析等方法从伊比利亚猪股二头肌中分离得到了LOX,并通过对其性质的研究发现LOX 可能与伊比利亚火腿的风味形成有关[9]。Bruce 等人从淡水鲑鱼腮中提取得到LOX,通过凝胶过滤的纯化方法确定其分子量为70 kDa[10]。Jin 等研究了五花肉中的LOX,发现温度、NaCl 浓度、pH 对于其活性有很大的影响,在火腿生产过程中可以通过这些参数的改变来调控LOX 的活力及脂肪氧化情况[11]。姜颖等对去势公兔和正常公兔中的腥味成分进行了提取、分析,确定了引起腥味的物质成分,并发现兔肉中的LOX 同工酶I可能与腥味产生有关[12]。
本文以麻鸭(shelduck)腿肉为原料,对其中的LOX(麻鸭LOX)进行分离纯化,并在此基础上研究其催化特性和稳定性,以期为鸭肉贮藏、加工过程中脂肪氧化及风味形成机制研究,以及加工工艺的优化提供参考。
1 材料与方法
1.1 材料
1.1.1 实验原料
随机选取70d 左右日龄健康麻鸭(2.5 kg 左右),按企业的工艺要求宰杀后迅速取出股二头肌,4℃下冷藏备用。
1.2.2 试剂及仪器
磷酸二氢钠、磷酸氢二钠、PMSF(苯甲基磺酰氟化物)、EDTA、β-巯基乙醇、硫酸铵、柠檬酸、柠檬酸三钠、硼酸、四硼酸钠、氢氧化钠、盐酸均为分析纯,吐温20 为化学纯,亚油酸标准品购自美国sigma 公司,大豆脂肪氧合酶购自东京化成工业株式会社(TCI,Japan),58 000 U/mg。
T25 高速匀浆机,德国IKA 公司;UniCenMR 高速冷冻离心机,德国Herolab 公司;Ultrospec7000 紫外可见光分光光度计,美国GE Healthcare;DK-8D 恒温水浴锅,金坛市医疗仪器厂;考马斯亮蓝试剂盒,上海捷瑞生物;ÄKTA FPLC 层析仪、Hoefer SE 260 电泳仪,美国GE Healthcare。
1.2 麻鸭LOX 的分离纯化
1.2.1 麻鸭LOX 的提取
参照Gata 等的方法对麻鸭LOX 进行提取[9]。取鸭股二头肌,剔除可见的结缔组织及脂肪组织后均匀剁碎。加入3 倍体积的磷酸缓冲液(50 mmol/L,pH7.0,含0.5 mmol/L PMSF,1 mmol/L β-巯基乙醇,2 mmol/L EDTA),在冰水浴中匀浆,冰水浴中搅拌90 min,然后于4℃下10 000 g 离心20 min;取上清液,以4 层纱布过滤,得到粗酶液。
1.2.2 麻鸭LOX 的纯化
(1)硫酸铵沉淀:粗酶液以0 ~60% 和60% ~80%硫酸铵分级沉淀,将60% ~80%硫酸铵沉淀以少量磷酸盐缓冲(50 mmol/L,pH 7.0)重悬混匀后,以50 mmol/L pH 7.0 的磷酸盐缓冲液透析过夜。
(2)纯化:以pH 9.0 的Tris-HCl 缓冲(50 mmol/L)平衡DEAE sepharose FF 层析柱(1.6 cm × 15 cm),取2 mL 透析后的麻鸭LOX 样品液进样,待基线平稳后以洗脱缓冲(Tris-HCl,50 mmol/L,pH 9.0,含1 mol/L NaCl)梯度洗脱,收集洗脱峰,测定酶活;将麻鸭LOX 活性峰以凝胶色谱(HiLoad 26/60 Superdex 75)纯化-脱盐,收集洗脱峰,测定酶活;将所得活性峰以SOURCE 15Q 进一步纯化,平衡缓冲为Tris-HCl(50 mmol/L,pH 9.0),以洗脱缓冲(Tris-HCl,50 mmol/L,pH 9.0,含1 mol/L NaCl)梯度洗脱,收集洗脱峰,测定酶活。
1.3 麻鸭LOX 酶活力测定
(1)底物溶液配制:0.5 mmol 亚油酸溶于5 mL含180 μL Tween 20 的脱氧重蒸水中,充分混匀;滴加1 mol/L NaOH 充分混匀使体系成为清澈透明的液体,再用1 mol/L HCl 调pH 至9.0,最后用脱氧重蒸水定容至50 mL。将配制好的亚油酸储备液分装保存在EP 管中,并于-20℃下储存[13]。
(2)酶活测定:麻鸭LOX 酶活测定参照Kermasha 等的方法[14]。取0.2 mL 亚油酸储备液与2.9 mL、50 mmol/L 的柠檬酸缓冲液(pH 5.5)充分混合,待其在234 nm 处的吸光值稳定后,加入0.1 mL 酶提取液,迅速混合,于234 nm 处测定其1.0 min 内吸光度值的增加量。以0.2 mL 亚油酸底物与2.9 mL 柠檬酸缓冲液混合为空白。
酶活定义:在一定的温度和pH 条件下,1.0 min内OD234增加0.001 为1 个酶活力单位(U)。
1.4 蛋白含量测定
以考马斯亮蓝试剂盒定量测定蛋白含量,每组3个平行样。
2 结果与分析
2.1 麻鸭LOX 的分离纯化
按照1.2.2(2)的方法对60% ~80%硫酸铵沉淀粗提物进行纯化,结果如图1 所示。由图1 可知,经DEAE sepharose FF 纯化后可得到2 个穿透峰和1 个洗脱峰(3 号峰),其中3 号峰具有LOX 活力。
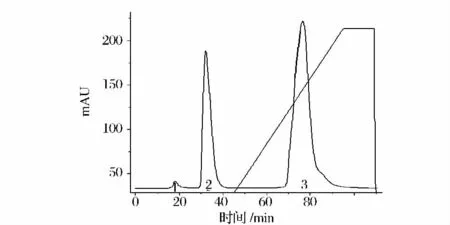
图1 麻鸭LOX 的DEAE Sepharose FF 层析图Fig.1 Chromatogram for purification of shelduck LOX with DEAE sepharose FF
将3 号峰超滤浓缩后,以凝胶色谱进行进一步的纯化(色谱柱为HiLoad 26/60 Superdex 75),色谱图见图2。结果显示,凝胶色谱分离可得到2 个主要的色谱峰,其中1 号峰的LOX 活力最高,表明麻鸭LOX的分子质量较大。

图2 麻鸭LOX 的Superdex 75 凝胶层析图Fig.2 Chromatogram for purification of shelduck LOX with Superdex 75
将凝胶色谱分离所得的活性峰(1 号峰)超滤浓缩后,以SOURCE 15Q 进一步纯化,结果见图3。通过优化洗脱梯度可得到多个洗脱峰,5 号峰的LOX活力最高。采用SDS-PAGE 对不同纯化阶段的样品进行分析,结果如图4 和图5 所示。为了真实反映最终纯化得到的样品纯度,图5 采用了灵敏度更高的银染色方法[15]。

图3 麻鸭LOX 的Source15Q 柱层析图Fig.3 Chromatogram for purification of shelduck LOX with SOURCE 15Q

图4 不同纯化阶段样品的电泳图(考染)Fig.4 SDS-PAGE analysis for samples after different purification steps

图5 SOURCE 15Q 纯化后的样品电泳图(银染)Fig.5 SDS-PAGE analysis for shelduck LOX after SOURCE 15 Q (silver staining)
经硫酸铵沉淀、DEAE sepharose FF、superdex 75和SOURCE 15Q 多步纯化后,最终得到样品液中的麻鸭LOX 已达电泳纯,分子质量约为62 kDa,小于大豆LOX 的相对分子质量(~96 kDa,见图4 条带1)。
如表1 所示,根据本文所建的纯化方法,麻鸭LOX 的纯化倍数可达98.64,但总体的酶活回收率较低,仅为5.3 %,酶活的损失主要发生在凝胶色谱和SOURCE 15Q 等精细纯化阶段。
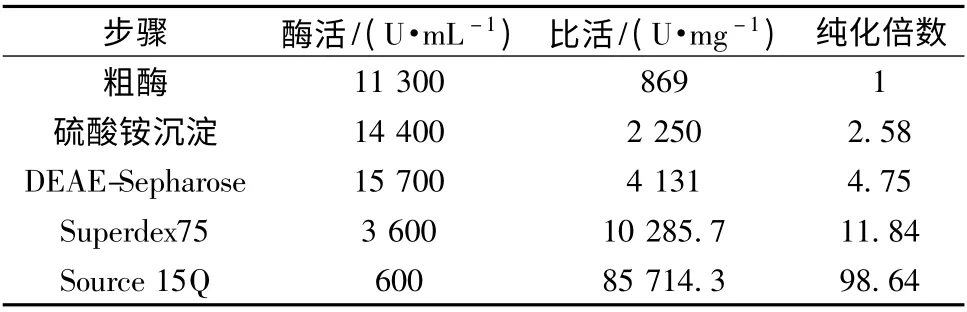
表1 从麻鸭肌肉中纯化麻鸭LOX 的结果Table 1 Results for the purification of LOX from shelduck muscle
2.2 麻鸭LOX 与大豆LOX 酶学性质的比较
2.2.1 温度对LOX 活力及稳定性的影响
在10、20、30、40、50、60、70℃条件下分别测定麻鸭LOX 和大豆LOX 的活力,以酶活最高值为100%,计算不同温度下的相对活力。结果如图6 所示。麻鸭LOX 和大豆LOX 酶活力均随着温度的升高呈先上升后下降的趋势,麻鸭LOX 和大豆LOX 的最适作用温度分别为30℃和40℃。

图6 温度对麻鸭、大豆LOX 活性的影响Fig.6 Effect of temperature on the activity of soybean LOX and shelduck LOX
进一步考察麻鸭LOX 和大豆LOX 在不同温度下的稳定性。将酶液分别置于不同温度(20 ~70℃)下保存30 min,取出测定酶活,以酶活初始值为100 %,计算不同温度下的残留活力,结果如图7 所示。随温度的升高,麻鸭LOX 与大豆LOX 的残留酶活均不断下降。当温度<50℃时,两者的稳定性差异不大,但当温度>50℃后,大豆LOX 残留酶活急剧下降,而麻鸭LOX 残留酶活的变化则较为平缓。在70℃条件下保温30 min,麻鸭LOX 仍可保留初始值的50.3 %左右,而大豆LOX 则已几乎完全失活。

图7 麻鸭LOX 和大豆LOX 的热稳定性Fig.7 Thermal stability of soybean LOX and shelduck LOX
2.2.2 pH 对LOX 活力及稳定性的影响
设定温度为37℃,在pH 4 ~10 分别测定麻鸭LOX 和大豆LOX 的活力,以酶活最高值为100%,计算不同pH 下的相对活力,结果如图8 所示。麻鸭LOX 在酸性下表现出较高的活力,而大豆LOX 则在碱性下活性较高,其最适pH 值分别为6.0 和8.0。
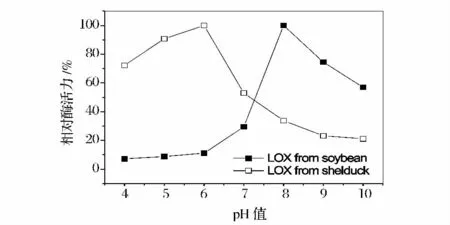
图8 pH 对大豆LOX 和麻鸭LOX 活性的影响Fig.8 Effect of pH value on the activity of soybean LOX and shelduck LOX

图9 麻鸭LOX 和大豆LOX 的pH 稳定性Fig.9 pH stability of soybean LOX and shelduck LOX
进一步考察麻鸭LOX 和大豆LOX 的pH 稳定性。将酶液分别置于pH 4 ~10 缓冲液中,于37℃下保存1 h,取出测定酶活,以酶活初始值为100 %,计算不同pH 下的残留活力,结果如图9 所示。麻鸭LOX 在中性和偏酸性条件下(pH <8.0)稳定性较差,随着pH 的升高,麻鸭LOX 的稳定性明显提高。经pH 11 条件下处理1 h,麻鸭LOX 的残余酶活高达初始酶活的90.6%,而此时大豆LOX 的残余酶活仅为初始值的16.9 %。
2.2.3 NaCl 浓度对LOX 活力的影响
配制含NaCl 分别为0 %、1 %、2 %、3 %、4 %、5 % w/v 的底物溶液,分别测定麻鸭LOX 和大豆LOX 在不同NaCl 浓度下的相对酶活,结果如图10 所示。NaCl 浓度对LOXs 酶活的影响比较复杂,随着NaCl 浓度的升高,麻鸭LOX 和大豆LOX 活力总体上呈下降的趋势,但在某一特定浓度下,麻鸭LOX 和大豆LOX 活力有明显的上升。麻鸭LOX 在NaCl 浓度为2 %时达到最大活力,而大豆LOX 在NaCl 浓度为3 %时活力最高。

图10 NaCl 对麻鸭、大豆LOX 活性的影响Fig.10 Effect of NaCl concentration on the activity of soybean LOX and shelduck LOX
2.2.4 金属离子对LOX 酶活的影响
分别配制含不同浓度(1.0 mmol/L 和10 mmol/L)K+、Ca2+、Mg2+、Mn2+、Cu2+、Zn2+的底物溶液,按照1.3(2)的方法测定麻鸭LOX 在不同体系下的酶活,结果如表2 所示。
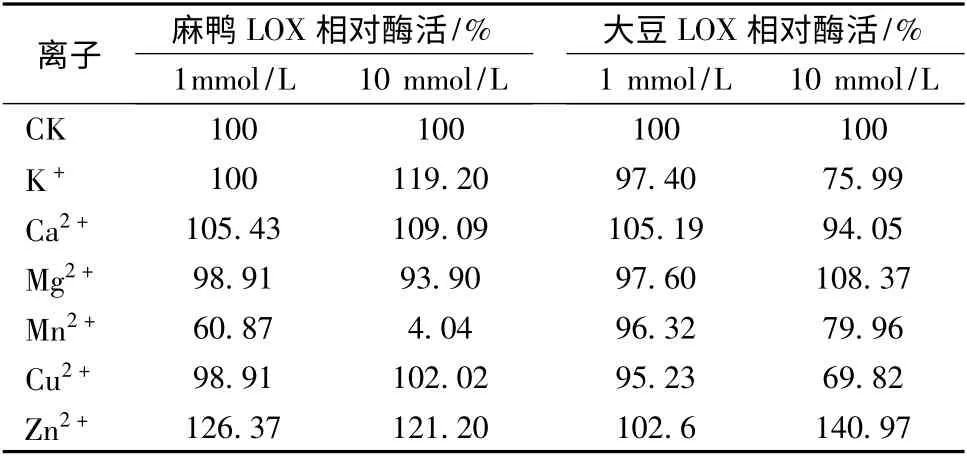
表2 金属离子对麻鸭LOX 和大豆LOX 酶活的影响Table2 Effect of metal ions on the activity of shelduck LOX and soybean LOX
由表2 可知,在高、低两个浓度条件下,Zn2+和Ca2+对麻鸭LOX 均具有较强的激活作用,其中Zn2+对酶活的激活作用尤为明显,而Mn2+对麻鸭LOX 抑制作用较强。同样的,Zn2+对大豆LOX 也具有较强的激活作用,而高浓度的K+、Mn2+和Cu2+对大豆LOX 的酶活具有一定的抑制作用。
3 结论
本文采用硫酸铵沉淀、DEAE sepharose FF 离子交换层析、Superdex 75 凝胶过滤以及SOURCE 15 Q离子交换层析的方法对麻鸭LOX 进行了分离纯化。在此基础上对麻鸭LOX 的酶学性质进行研究,并与大豆LOX 进行了比较,得到结论如下:
(1)采用硫酸铵沉淀、凝胶色谱和离子交换层析的方法得到了电泳纯的麻鸭LOX,相对分子量约为62 kDa,比酶活为85714.3 U/mg,纯化倍数为98.64。
(2)麻鸭LOX 和大豆LOX 的最适反应温度分别为30℃和40℃,最适作用pH 分别为6.0 和8.0,麻鸭LOX 的热稳定性和pH 稳定性均优于大豆LOX。
(3)低浓度的NaCl 对麻鸭LOX 和大豆LOX 的活力有一定的激活作用,在NaCl 分别为2 %和3 %时,麻鸭LOX 和大豆LOX 的活力最高。
(4)Zn2+和Ca2+对麻鸭LOX 均有的明显的激活作用,而Mn2+对麻鸭LOX 具有强烈的抑制作用。
[1] Michael H,Glickman,Judith P.Klinman. Lipoxygenase reaction mechanism:demonstration that hydrogen abstraction from substrate preedes dioxygen blinding during catalytic turnover[J].Biochemistry,1996,35(39):12 882-12 892.
[2] Liat Lomnitski,David Sklan ,Shlomo Grossman. Lipoxygenase activity in rat dermis and epidermis:partial purification and characterization [J]. Biochemica et Biophysica Acta,1995(1255):351 -359.
[3] Tomasz Borowski,Ewa Broclawik. Catalytic reaction mechanism of Lipoxygenase.A density functional theory study[J]. Journal of Physical Chemistry B ,2003,107(19):4 639 -4 646.
[4] Alexandra Andreou,Ivo Feussner. Lipoxygenase-structure and reaction mechanism[J]. Phytochemistry,2009(70):1 504 -1 510.
[5] Yuxiang zheng,Alan R.Brash. On the role of molecular oxygen in Lipoxygenase activation[J]. Journal of Biological Chemistry,2010,285(51):39 876 -39 887.
[6] Patricia A.Reynolds,Barabara P. Klein. Purification and Characterization of a Type-1 Lipoxygenase from Pea Seeds[J]. Journal of Agricultural and Food Chemistry,1982,30(6):1 157 -1 163.
[7] 苏亚芬. 大豆脂氧酶好氧催化的研究——高底物浓度下底物抑制及产物抑制的松弛研究[D]. 无锡:江南大学,2005:9 -9.
[8] S. Grossman,M.Bergman,D.Sklan. Lipoxygenase in chicken muscle [J]. Journal of Agricultural and Food Chemistry,1988,36(6):1 268 -1 270.
[9] J.L. Gata,M.C.Pinto,P.Macias. Lipoxygenase Activity in Pig Muscle:Purification and Partial Characterization[J].Journal of Agricultural and Food Chemistry,1996,44(9):2 573 -2 577.
[10] J.Bruce German,Richard K.Creveling,Identifcation and Characterization of a 15-Lipoxygenase from Fish Gill[J].Journal of Agricultural and Food Chemistry,1990,38(12):2 144 -2 147.
[11] Guo feng Jin,Jiaohao Zhang,Xiang et al. Crude lipoxygenase from pig muscle:Partial characterization and interactions of temperature,NaCl and pH on its activity [J].Meat Science,2011(87):257 -263.
[12] 姜颖,张益民,张振华,等. 去势公兔腥味物质及其脂氧合酶同工酶的研究[J]. 南京农业大学学报,2002,25(1):89 -92.
[13] 张新亮. 如皋火腿脂肪氧合酶及风味研究[D]. 南京:南京农业大学,2008:20 -20.
[14] Kermasha S,Metche M. Characterization of seed lipoxygenase of Phaseolus vulgaris cv,haricot [J].Journal of Food Science ,1986,51(5):1 224 -1 227.
[15] 汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,2000:92 -97.
