HIF-1α基因转录活性位点在人骨髓间充质干细胞分化成心肌细胞中的作用
2013-08-09吴平生王月刚裴静娴赖艳娴
刘 城,吴平生,王月刚,裴静娴,赖艳娴
广州市第一人民医院心血管内科(广东广州510180)
缺血性血管疾病已成为威胁人类健康的重大疾病。虽然目前在保守治疗(常规药物治疗)和血运重建(经皮介入及外科手术)均取得了重大进展,然而,相当一部分患者目前的药物治疗难以见效,也不适于常规血运重建术处理,且相关治疗费用高昂。为解决这一问题,开辟了新的治疗途径——治疗性血管新生。低氧诱导因子-1(hypoxia inducible factor 1,HIF-1)是细胞对低氧/缺氧作出适应性反应的关键性转录因子,被认为是治疗性血管新生领域中最具有前途的治疗基因之一。HIF-1由α亚单位和β亚单位构成,HIF-1α是功能性亚基,其蛋白稳定性和转录活性主要受细胞内氧浓度的调节[1]。HIF-1α结构域中含有氧依赖降解区(Oxygen Dependent Degradation Domain,ODDD),ODDD 区Pro402以及Pro5642个脯氨酸残基是否羟基化决定其蛋白稳定性[2]。常氧情况下,Pro402和/或 Pro564被脯氨酸羟化酶(prolyl hydroxylase domain,PHD)羟化后,经泛素途径降解,故HIF-1α在常氧下的半衰期很短,约1~2 min,5 min即可全部降解[3]。低氧时,该过程受到抑制,HIF-1α不被降解因而变得稳定。另一方面,氧浓度除了对HIF-1α蛋白稳定性调节以外,更为重要的是对 HIF-1α 转录活性调节[4]。HIF-1α的 C末端含有独立的转录激活区(CTransactivation Domains,C-TAD)。常氧情况下,CTAD结构域内803位点上的天门冬酰胺(Asn803)被羟化,其转录活性下降。故即使蛋白稳定的HIF转位到核内后,因HIF-1α 的 C-TAD Asn803羟化,激活下游靶基因的能力下降;低氧时,该过程受到抑制,不能有效的催化结构域内Asn803羟基反应,从而导致HIF-1α的高转录活性,故Asn803为HIF-1α转录活性位点[5]。更关键的是,C-TAD区不仅决定其转录活性,而且决定其是否能与辅助激活因子结合,这是启动下游靶基因转录的关键[6]。因此,我们将HIF-1α 的 564、402、803三个位点进行单个或联合位点突变,以重点观察HIF-1α基因转录活性位点(Asn803)在人骨髓间充质干细胞分化成心肌细胞中的作用。
1 材料与方法
1.1 材料 第5代hMSCs(本课题组培养),本课题组成功构建的野生型HIF-1α重组腺病毒载体(Ad-HIF-1αnative),Pro564单突变型 HIF-1α 重组腺病毒载体(Ad-HIF-1α564),Pro564Pro402双突变型HIF-1α 重组腺病毒载体(Ad-HIF-1α564/402)以及Pro564Asn803双突变型HIF-1α重组腺病毒载体(Ad-HIF-1α564/803)。鼠抗人 Tubulin单克隆抗体(Santa Cruz),鼠抗人 HIF-1α、Nkx2.5 单克隆抗体(Chemicon),兔抗人VEGF多克隆抗体(武汉博士德),心肌肌钙蛋白I试剂盒(DadeBehring,Inc)。细胞核蛋白与细胞浆蛋白抽提试剂盒(碧云天生物科技公司)。hMSCs培养基(10%胎牛血清FCS),1%200mmol/L L-谷氨酰胺溶液(L-Gln的DMEM-LG培养基),心肌细胞培养基(5%FCS,1%200 mmol/L L-Gln的 DMEM-LG培养基),心肌细胞诱导液(10%FCS,1%1 mmol/L5-aza DMEM-LG 溶液,1%200mmol/LL-Gln的DMEM-LG培养基)。
1.2 方法
1.2.1 X-gal组织化学染色法测定重组腺病毒转染效率及最佳感染复数(multiplicity of infection,MOI)hMSCs以每孔1×104个细胞接种于6孔培养板中培养,8h后换成无血清、含L-Gln的DMEM-LG培养基,维持 24 h 后,分别以 MOI为 0,20,50,75,100,200OPU/cell转染 Ad-LacZ,hMSCs培养基继续培养48h,10%多聚甲醛室温固定10 min,PBS液洗涤三次,加入X-gal染色液,37℃ 孵育12~24h后荧光显微镜观察结果,以能够获得有效转染率同时又能尽量避免腺病毒本身对细胞的毒性的MOI值为最佳MOI。
1.2.2 不同突变型 HIF-1α 基因转染 5-aza诱导中的hMSCs hMSCs以1×105个细胞接种到75 cm2培养瓶中,37℃ 5%CO2培养;待细胞贴壁后将hMSCs培养基换成心肌细胞诱导液,继续培养;24 h后将心肌细胞诱导液换成心肌细胞培养基,继续培养;24 h后将各纯化重组腺病毒 Ad-LacZ、Ad-HIF-1αnative、Ad-HIF-1α564、Ad-HIF-1α564/402和 Ad-HIF-1α564/803,以最佳MOI转染前述心肌细胞诱导液诱导后的hMSCs,3h后换成无病毒的心肌细胞培养基,继续培养;每3~4d更换心肌细胞培养基1次,细胞不予传代。
1.2.3 cTnI测定 将 1.2.2 中所述,诱导培养后第 6周,进行cTnI免疫组化染色鉴定,并提取细胞浆蛋白,一步法酶联免疫分析测定cTnI表达量。
1.2.4 HIF-1α 与 VEGF 蛋白表达测定 将 1.2.2中所述,诱导培养后第6周,提取细胞浆蛋白,行Western blot检测。结果用光密度扫描仪扫描、影像软件Gel-pro analysis分析,面积×密度代表表达量。
1.2.5 姜黄素抑制HIF-1α 基因Asn803位点转录活性后VEGF mRNA表达测定 将1.2.2中所述,诱导培养后第6周,更换为含有120 μmol/L姜黄素的心肌细胞诱导液继续培养12 h,用RT-PCR检测细胞中VEGF mRNA表达水平的变化。
1.3 统计学方法 用 SPSS15.0统计软件,采用OneWay-ANOVA方差分析,方差齐性时组间比较采用LSD法,方差不齐时组间比较采用Games-Howell检验。
2 结果
2.1 重组腺病毒转染hMSCs效率 Ad-LacZ转染hMSCs 48h后X-gal染色结果显示:20及50 OPU/cell转染率较低,75 OPU/cell的滴度可获得较高的转染率,约26%的细胞出现蓝染。100及200 OPU/cell引起细胞死亡、脱落,显示出腺病毒毒性。因此选用75OPU/cell为最佳MOI。
2.2 不同HIF-1α基因在人骨髓间充质干细胞分化成心肌细胞中的作用 用 Ad-LacZ,Ad-HIF-1α,Ad-HIF-1α564,Ad-HIF-1α564/402,Ad-HIF-1α564/803转染hMSCs后第6周测得cTnI值,见表1。
2.3 不同HIF-1α 基因转染5-aza诱导中的hMSCs后HIF-1α、VEGF蛋白的表达 用 Ad-LacZ,Ad-HIF-1αnative,Ad-HIF-1α564,Ad-HIF-1α564/402,Ad-HIF-1α564/803转染 hMSCs后于第6周测得的 HIF-1α、VEGF蛋白水平如图1所示。
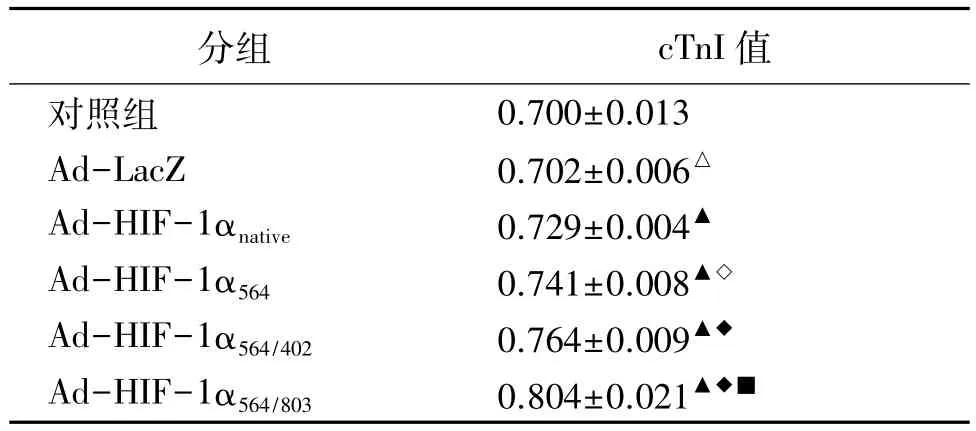
表1 不同HIF-1α基因转染5-aza诱导的hMSCs后 cTnI的表达
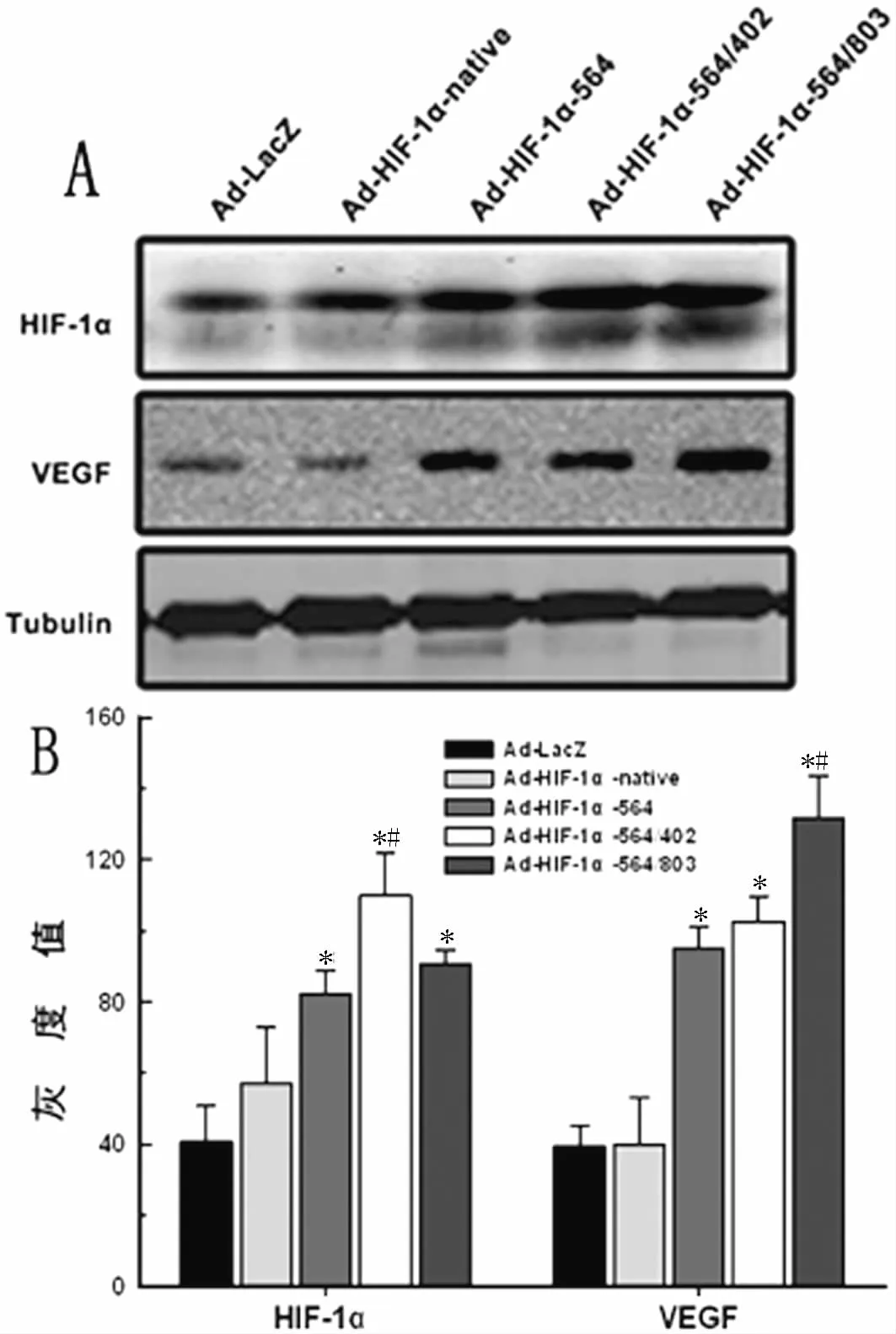
图1 不同HIF-1α基因转染5-aza诱导的hMSCs后 HIF-1α、VEGF 表达水平
2.4 姜黄素抑制HIF-1α基因Asn803位点转录活性后VEGF mRNA表达测定 我们使用了CBP/p300活性抑制剂——姜黄素阻断CBP/p300的功能,以观察VEGF mRNA表达水平的变化,如图2示。
3 讨论

图2 姜黄素对HIF-1α基因转染5-aza诱导的hMSCs后VEGF表达水平的影响
缺血性心脏病目前治疗主要是常规的药物治疗、冠脉介入(PCI)及冠脉旁路移植术(CABG),然而相当一部分患者药物治疗难以见效,也不适于常规血运再通术处理,所以必须寻求其它新的治疗途径—干细胞移植成为治疗心肌梗死的新策略。本实验构建了野生型及各突变型HIF-1α的重组腺病毒载体,通过转染体外诱导培养的hMSCs,研究HIF-1α不同突变位点对诱导环境下hMSCs向心肌细胞分化过程的影响。我们用重组腺病毒介导的不同HIF-1α基因转染5-aza诱导的hMSCs6周后应用Westernblot检测HIF-1α蛋白表达水平,野生型及突变型 HIF-1α蛋白均有较高表达,但以 Pro402Pro564双突变型HIF-1α组HIF-1α蛋白表达水平最高。与此同时,在常氧条件下经5-aza诱导后的hMSCs中 cTnI的表达也相应升高,其中以 Pro564Asn803双突变型HIF-1α组cTnI表达水平最高。这表明高HIF-1α的表达可促进hMSCs向心肌细胞分化。进一步通过对比Pro402Pro564双突变型HIF-1α组与Pro564Asn803双突变型 HIF-1α组 HIF-1α与cTnI表达差异发现,虽然Pro402Pro564双突变型HIF-1α组HIF-1α蛋白表达水平较Pro564Asn803双突变型 HIF-1α 组高,但 Pro564Asn803双突变型 HIF-1α组cTnI的表达水平反而较前者更为明显,进一步说明Asn803位点在HIF-1α促进hMSCs向心肌细胞分化中起关键作用。故我们可以推断,心肌细胞在缺氧条件环境中,hMSCs可以分化成心肌细胞以提高心肌对缺氧应激的耐受能力,而这种分化被Pro564Asn803双突变型HIF-1α基因增强。
进一步比较 HIF-1α 基因 Pro402、Pro564、Asn803三个位点进行单个或联合位点突变后,各突变型HIF-1α的表达在促进hMSCs向心肌细胞分化中的效能:(1)通过对比野生型HIF-1α基因、Pro564单突变型HIF-1α基因以及Pro564Asn803双突变型HIF-1α基因三个实验组cTnI表达差异发现,Pro564单突变型HIF-1α基因组cTnI表达水平仅比野生型HIF-1α 基因组增加了约 1.7%,而 Pro564Asn803双突变型HIF-1α基因cTnI表达水平比Pro564单突变型HIF-1α 基因组增加了约 8.4%,说明在 HIF-1α 基因Pro564单一位点突变的基础上同时将Asn803位点突变,新的Pro564Asn803双突变型HIF-1α基因在促进hMSCs向心肌细胞分化中的效能较Pro564单突变型HIF-1α基因组提升了近5倍。(2)同时对比Pro564单突变型HIF-1α基因与Pro564Pro402双突变型HIF-1α基因两个实验组cTnI表达差异发现,Pro402Pro564双突变型HIF-1α组cTnI表达水平仅比Pro564单突变型HIF-1α基因组增加3.0%。故说明虽然Pro564Pro402双突变型HIF-1α基因以及Pro564Asn803双突变型HIF-1α基因均为组成型表达型HIF-1α突变基因,但后者优于前者,且进一步揭示了Asn803位点在HIF-1α促进hMSCs向心肌细胞分化中的关键作用。
HIF-1α作为一个重要的核转录因子,能在低氧条件下有效地促进hMSCs向心肌细胞分化,依赖于其TAD与相应的辅助激活因子CREB结合蛋白/腺病毒E1A相关蛋白p300(CREB-binding protein/adenovirus E1A-binding protein p300,CBP/p300)相互作用从而激活下游基因的转录[6-7]。有研究表明,通过构建CBP/p300缺陷型大鼠以阻断了HIF-1α与 CBP/p300之间的相互作用,发现有(35~50)%HIF-1α下游靶基因的表达需要 CBP/p300[8]。故我们提出 HIF-1α 存在 CBP/p300 依赖性机制。我们使用了CBP/p300活性抑制剂——姜黄素[9]阻断CBP/p300的功能,以观察HIF-α诱导的促血管新生基因表达水平的变化。我们研究结果显示:在使用姜黄素将CBP/p300活性抑制条件下,VEGF mRNA表达水平较未抑制组平均减少了(50.9±4.6)%。然而,在CBP/p300活性受同等抑制条件下,Pro564Asn803双突变型 HIF-1α基因组VEGF mRNA表达水平虽然较未抑制组减少了约40%,但仍显著高于 Pro564单突变型 HIF-1α基因组,这些结果说明除了CBP/p300外,还有其它辅助激活因子通过Asn803位点启动HIF-1α下游基因的转录,这一机制可能与 HDAC 有关[8-10],对其有如下解释:(1)HDAC直接与HIF-1α-CBP/p300复合体相互作用,并共同转入核内增强HIF-1α诱导的基因转录活性[11];(2)HDAC间接的促进P300与HIF-1α 的结合,并与 CBP/p300 去乙酰化[12],以及HIF-1α 从 FIH-1上解离出来有关[13]。
本研究表明HIF-1α基因转录活性位点Asn803在HIF-1α促进hMSCs向心肌细胞分化中起关键作用,其可能通过 HIF-1α-CBP/p300-HDAC 复合体的形式来共同参与基因转录的,为HIF-1α和hM-SCs在缺血性疾病治疗中的联合应用提供了实验基础。
[1]Fong GH,Takeda K.Role and regulation of prolyl hydroxylase domain proteins[J].Cell death and differentiation,2008,15:635-641.
[2]Ivan M,Kondo K,Yang H,et al.HIFalpha targeted for VHL-mediated destruction by proline hydroxylation:implications for O2 sensing.Science(New York NY),2001,292:464-468.
[3]Salceda S,Caro J.Hypoxia-inducible factor 1alpha(HIF-1alpha)protein is rapidly degraded by the ubiquitinproteasome system under normoxic conditions.Its stabilization by hypoxia depends on redox-induced changes.The Journal of biological chemistry,1997,272:22642-22647.
[4]Pugh CW,Ratcliffe PJ.Regulation of angiogenesis by hypoxia:role of the HIF system[J].Nature medicine,2003,9:677-684.
[5]Masson N,Ratcliffe PJ.HIF prolyl and asparaginyl hydroxylases in the biological response to intracellular O(2)levels[J].Journal of cell science,2003,116:3041-3049.
[6]Lando D,Peet DJ,Whelan DA,et al.Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch.Science(New York,NY),2002,295:858-861.
[7]Arany Z,Huang LE,Eckner R,et al.An essential role for p300/CBP in the cellular response to hypoxia.Proceedings of the National Academy of Sciences of the United States of America,1996,93:12969-12973.
[8]Kasper LH,Boussouar F,Boyd K,et al.Two transactivation mechanisms cooperate for the bulk of HIF-1-responsive gene expression[J].The EMBO journal,2005,24:3846-3858.
[9]Marcu MG,Jung YJ,Lee S,et al.Curcumin is an inhibitor of p300 histone acetylatransferase[J].Med Chem,2006,2:169-174.
[10]Choe SK,Lu P,Nakamura M.Meis cofactors control HDAC and CBP accessibility at Hox-regulated promoters during zebrafish embryogenesis[J].Developmental cell,2009,17:561-567.
[11]Kato H,Tamamizu-Kato S,Shibasaki F.Histone deacetylase 7 associates with hypoxia-inducible factor 1alpha and increases transcriptional activity[J].The Journal of biological chemistry,2004,279:41966-41974.
[12]Fath DM,Kong X,Liang D,et al.Histone deacetylase inhibitors repress the transactivation potential of hypoxiainducible factors independently of direct acetylation of HIF-alpha[J].The Journal of biological chemistry,2006,281:13612-13619.
[13]Seo HW,Kim EJ,Na H,et al.Transcriptional activation of hypoxia-inducible factor-1alpha by HDAC4 and HDAC5 involves differential recruitment of p300 and FIH-1[J].FEBS letters,2009,583:55-60.
