超高效液相色谱法同时测定柑橘中11种类黄酮物质
2013-08-07焦必宁赵其阳苏学素曾朝波
冉 玥,焦必宁,*,赵其阳,田 玲,苏学素,曾朝波
(1.西南大学食品科学学院,重庆 400715;2.农业部柑橘产品质量安全风险评估实验室,西南大学柑橘研究所,重庆 400712;3.西南大学化学化工学院,重庆 400716)
柑橘有丰富的营养价值和独特的感官品质,其果实及果汁是世界消费最多的水果产品之一。柑橘果实中含有大量的类黄酮、类胡萝卜素、维生素、酚酸等多种生理活性物质,还含有几乎只存在于柑橘属中的多甲氧基黄酮如川皮苷、桔黄酮等[1]。研究表明类黄酮物质具有抗炎活性[2-3]、抗癌作用、抗动脉粥样硬化、抗氧化功能[4]和抗菌[5]等多种生理作用,国内外已有不少相关文献报道将其用于功能食品和功能饲料的生产研究中。此外,类黄酮种类和含量的差异可作为鉴别柑橘产品掺假[6]、品种及原产地识别的依据[6-7]。Sentandreu等[8]研究了利用类黄酮组成及其含量并结合多元统计判别分析方法可识别不同种类柑橘汁,结果显示,黄芩素与川皮苷含量比例与多甲氧基黄酮总含量可作为区分不同品种柑橘汁的特征性成分,能够显著地将7种柑橘汁区分开来。
目前已有不少柑橘类黄酮检测的方法报道,其中普通高效液相色谱法[9-13]为主流的分析方法,还存在分析耗时长、测定的类黄酮化合物种类较少、精确度不高等问题。而超高效液相色谱法(ultra performance liquid chromatography,UPLC),基于小颗粒填料、低系统体积及快速检测等技术,具有快速高效、高分离度等特点[14-15],现已广泛应用于食品、药物中各类物质的分析检测中。Spácil等[16]比较了高效液相色谱(high performance liquid chromatography,HPLC)和UPLC同时分离9种类黄酮物质的效果,结果表明,UPLC所用时间短2.5倍,使用溶剂少5.5倍,而分离度却高1.7倍。目前国内较少有超高效液相检测柑橘中类黄酮的方法报道。本研究采用正交试验优化样品前处理方法,确定最佳仪器分析条件,建立超高效液相色谱-二极管阵列检测器法同时测定柑橘中11种类黄酮物质的方法。
1 材料与方法
1.1 材料与试剂
柑橘样品均采自中国农业科学研究院柑桔研究所国家果树种质重庆柑橘圃。
圣草枸橼苷(纯度97.4%)、柚皮素-7-β-芸香糖苷(纯度95.0%)、新橙皮苷(纯度99.9%)、香风草甙(纯度93.1%)、柚皮素(纯度98.2%)、橘黄酮(纯度97.1%)、橙皮素(纯度94.6%)(标准品) 美国Chroma Dex公司;甜橙黄酮标准品(纯度98.5%) 德国Phytolba公司;川皮苷标准品(纯度96.4%) 美国Sigma公司;橙皮苷(纯度93.7%)、柚皮苷(纯度97.3%)(标准品) 瑞士Fluka公司;甲醇(色谱纯) 德国CNW Technologies有限公司。
1.2 仪器与设备
Acquity UPLC色谱仪(配有PDA检测器及Empour工作站) 美国Waters公司;3K15高速冷冻离心机 美国Sigma公司;KQ5200DE超声波清洗器 江苏昆山市超声仪器有限公司;超纯水器 美国Millpore公司;0.22μm有机相针式滤器 上海安谱科学仪器有限公司。
1.3 方法
1.3.1 标准品溶液的制备
准确称取圣草枸橼苷、柚皮素-7-β-芸香糖苷、柚皮苷、橙皮苷、新橙皮苷、香风草甙、柚皮素、橙皮素、甜橙黄酮、川皮苷和橘黄酮各5.00mg,分别用色谱纯甲醇溶解并定容至10.00mL容量瓶中,配成500mg/L标准品的母液备用。
采用逐级稀释法用色谱纯甲醇溶液将标准品溶液配制成一系列质量浓度的混合标准品溶液。
1.3.2 样品的制备
柑橘果皮样品:鲜果皮磨细后备用。准确称取制好样品1.00g于50mL离心管中,加入甲醇溶液10.00mL,50℃条件下超声处理30min,以10000r/min离心10min,收集上清液,残渣均以10mL提取剂重复提取两次,合并上清液定容至50mL,0.22μm微孔滤膜过滤后待测。
柑橘汁样品:采用手动压榨法制取新鲜柑橘果汁,用双层纱布过滤后备用。准确吸取制好果汁样品2.00mL置于50mL离心管中,加入10.00mL甲醇振荡1min,以10000r/min离心10min,分离上清液,残渣以10mL提取剂重复提取一次,合并上清液定容至25mL,过0.22μm微孔滤膜后待测。
1.3.3 色谱条件
色谱柱:A C Q U I T Y U P L C B E H C18分析柱(2.1mm×100mm,1.7μm);流动相:甲醇和0.2%乙酸溶液,采用梯度洗脱;柱温:35℃;流速:0.3mL/min;定量波长为283nm和330nm,波长扫描范围200~400nm,进样量为3.0μL。以保留时间结合光谱扫描图定性,采用外标法定量。
2 结果与分析
2.1 检测波长的选择
对11种类黄酮(8种黄烷酮和3种多甲氧基黄酮)标准物质进行扫描,属黄烷酮类的圣草枸椽苷、柚皮素-7-β-芸香糖苷、柚皮苷、橙皮苷、新橙皮苷、香风草甙、柚皮素和橙皮素均在283nm附近有最大吸收峰,而属于多甲氧基黄酮的橙黄酮在330nm附近有最大吸收峰,川皮苷和橘黄酮在270nm和330nm附近都有最大吸收峰,综合考虑最终选取283nm和330nm分别作为黄烷酮和多甲氧基黄酮的定量检测波长。
2.2 柱温和流动相的选择

表 1 流动相洗脱程序Table 1 Gradient elution program
随着柱温升高,色谱柱的柱效增加,分析时间缩短,但对目标物的分离度有一定影响。综合考虑确定35℃作为色谱柱分析时的温度。
实验比较不同流动相溶液的分离效果,结果显示采用乙腈-乙酸溶液作为流动相时,在橙黄酮、川皮苷和橘黄酮出峰处存在较强基线干扰,而使用甲醇-乙酸溶液作为流动相时可消除基线干扰,因此选择甲醇-乙酸溶液作为色谱分析的流动相体系。对于11种类黄酮物质来说,其结构和性质相似,需采用梯度洗脱的方式进行分离,经优化确定梯度洗脱条件如表1所示。在该条件下,11种类黄酮标样和柑橘样品色谱图见图1,根据相对保留时间并结合待测化合物的特征吸收波谱进行定性。由图1可以看出,样品中类黄酮化合物与其他杂质分离,各个物质的峰形良好,分离度高。因此本方法适合柑橘中类黄酮化合物的测定。
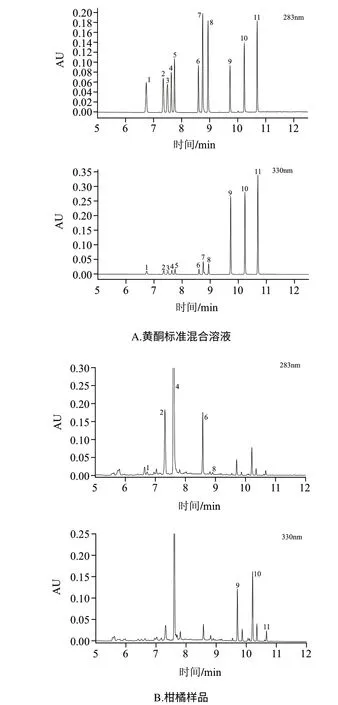
图 1 11种类黄酮标准混合溶液和柑橘样品的超高效液相色谱图(283nm和330nm)Fig.1 UPLC chromatograms of eleven flavonoids and citrus sample at 283 nm and 330 nm
2.3 样品前处理条件的优化
2.3.1 柑橘果皮样品前处理条件优化
以鲜果皮作为试材,参考文献[17]方法,通过单因素和正交试验优化果皮前处理条件。
单因素试验比较甲醇、70%甲醇溶液、DMF、DMSO、甲醇+DMF(1+1)和甲醇+DMSO(1+1)等提取剂的提取效果,结果表明甲醇提取效果最佳。样品提取温度、超声时间和提取次数优化结果见图2,结果表明,样品提取温度50℃、超声时间30min、提取3次时,类黄酮提取量达最高。
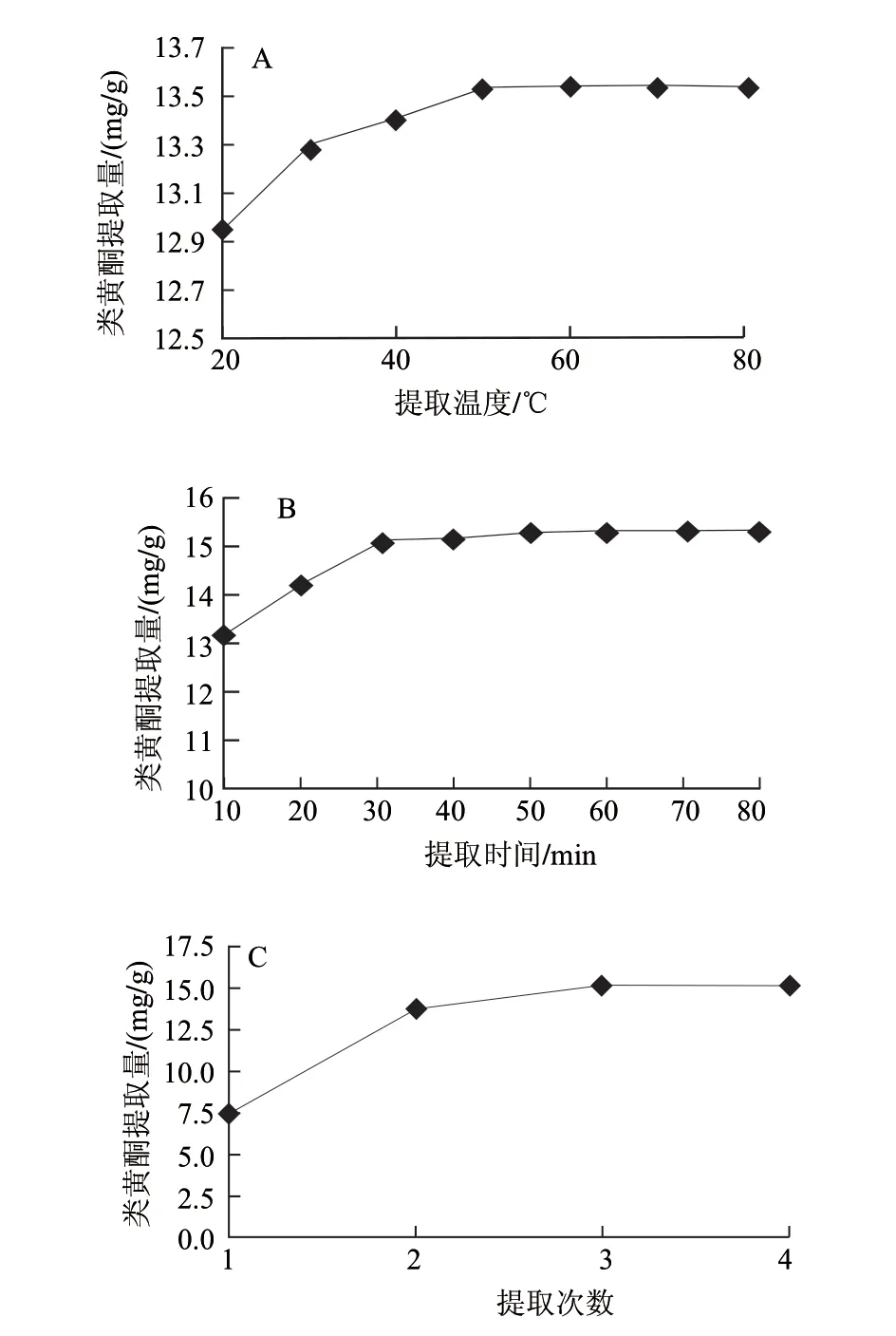
图 2 提取温度(A)、时间(B)和次数(C)对果皮中类黄酮提取量影响Fig.2 Effects of extraction temperature (A), time (B) and times (C) on the total contents of flavonoids in peel
采用正交试验设计确定超声时温度、超声时间和提取次数3个因素的最佳组合。分别选取其中的4个水平:30、40、50、60℃;10、20、30、40min;1、2、3、4次。选择L16(45)正交表,将3个因素分别定为第1、2、3列,根据正交表安排进行试验。正交试验安排及结果见表2。由表2结果的直观分析及表3中对试验结果的方差分析可以看出3个因素中最佳水平分别为50℃、30min和3次。此外,由极差大小可判定出3个因素对提取出类黄酮总量的影响大小为提取次数>提取温度>提取时间,且在置信概率为95%时,提取次数对类黄酮提取量有显著性影响。另一方面结果中的两空列的值可代表因素间的相互作用和实验中误差大小,两列的极差值和偏差平方和的值都较小,表明因素间没有相互作用以及误差很小。
结合单因素和正交试验结果,最终确定果皮中类黄酮的最佳提取条件为样品经甲醇50℃超声30min,重复提取3次。这与传统的浸提[18]或索氏提取法[19]等相比大大缩短了分析时间。
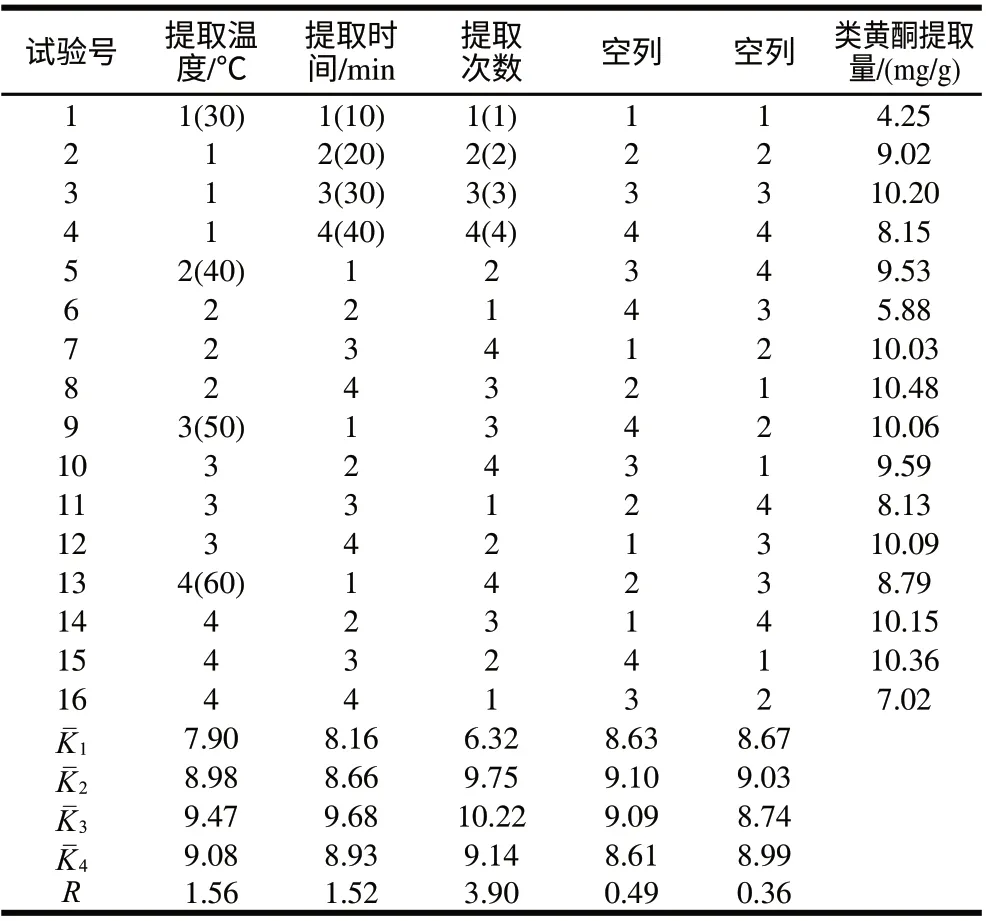
表 2 类黄酮的最佳提取条件正交试验设计及结果Table 2 Experiment design and results of orthogonal test for extraction of flavonoids
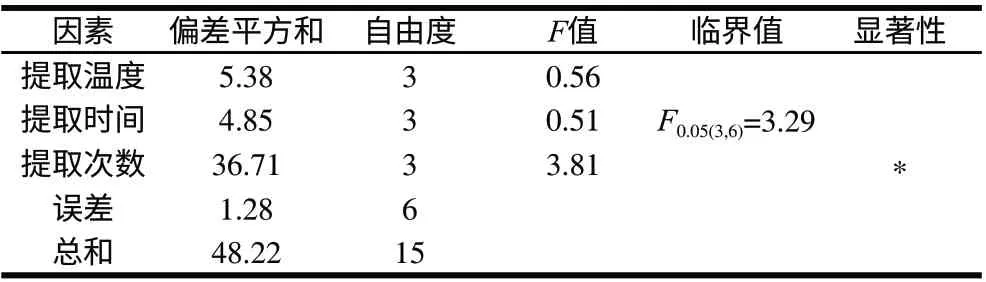
表 3 试验结果方差分析表Table 3 Analysis of variance of the test results
2.3.2 柑橘果汁样品前处理条件的优化
参考果皮处理方法,使用甲醇作为提取剂,经多次实验确定振荡1min后以10000r/min的转速离心10min为前处理方式。实验比较提取次数对总类黄酮提取量的影响,结果见图3。由图3可看出,随着提取次数的增加,类黄酮提取总量增加。但对结果进行分析后显示,提取2、3次和4次的结果间并无显著性差异。考虑实验成本和环保方面,选择提取2次作为果汁的提取方法。
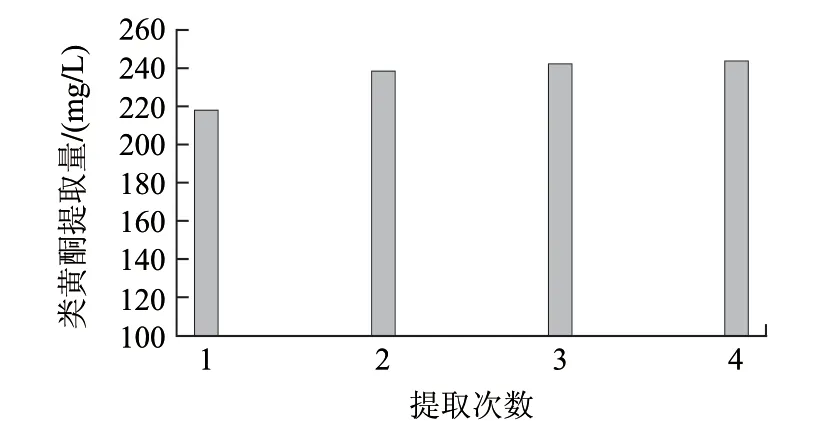
图 3 提取次数对果汁中类黄酮提取总量的影响Fig.3 Effect of extraction times on total contents of flavonoids in juice
2.4 线性关系和检出限
在上述色谱分析条件下,测定一系列质量浓度的标准溶液。以测得的各个类黄酮物质积分峰面积为纵坐标,质量浓度(mg/L)为横坐标绘制标准曲线。各类黄酮的回归方程、相关系数、线性范围和方法检出限如表4所示,11种类黄酮的检出限(RSN=3)为0.005~0.02mg/kg,在各个类黄酮物质相应的线性范围内其质量浓度与积分峰面积呈现出良好的线性关系,相关系数达到0.9993以上。

表 4 11种类黄酮的线性范围、线性方程、相关系数及检出限Table 4 Linear range, linear equation, correlation coefficient and the limits of detection (LODs) of the investigated flavonoids
2.5 精密度和重复性实验
将同一标准溶液连续进样6次,以11种类黄酮物质的积分峰面积为对象,计算其相对标准偏差,以考察色谱仪器的精密度。结果表明,各类黄酮的其相对标准偏差(RSD)介于0.9%~1.3%,充分说明仪器具有较高的精密度。在不同时间内以该方法重复测定同一实际样品5次,上机进样量3μL,通过计算RSD以考察方法的重复性,结果显示各类黄酮的RSD值为2.3%~4.2%,表明该方法具有良好的重复性。
2.6 回收率实验
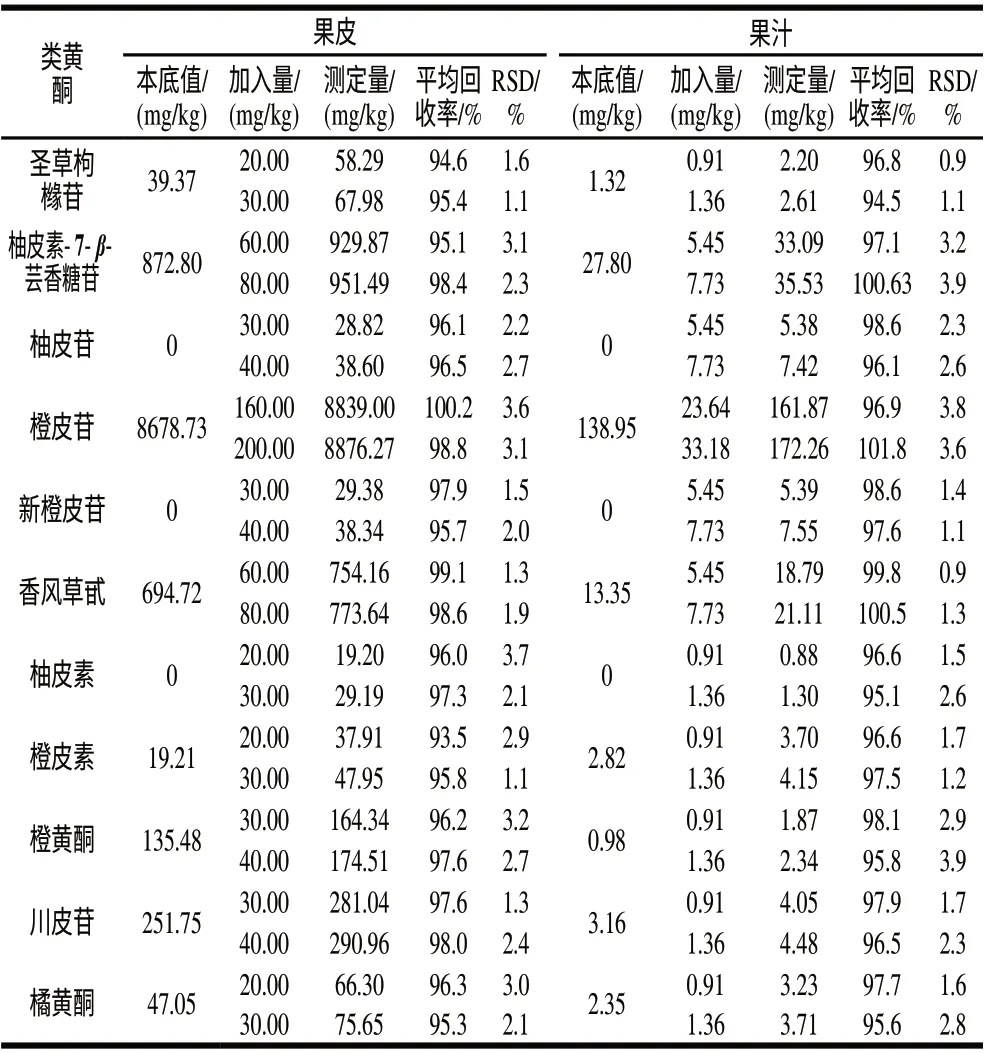
表 5 果皮和果汁回收率实验结果Table 5 The results of recovery test
分别对果皮和果汁样品进行两个水平的加标回收率实验,每个实验均6次重复。根据样品中各类黄酮物质含量确定该种物质标准样加入量,按上述前处理方法及分析方法进行实验,验证该方法的准确性。结果如表5所示,果皮中各类黄酮物质的平均回收率在94.6%~100.2%,相对标准偏差在1.1%~3.7%,果汁中各类黄酮平均回收率在94.5%~101.8%,相对标准偏差在0.9%~3.9%。结果表明上述实验方法准确度较高,能应用于柑橘中类黄酮物质的检测分析。
2.7 实际样品的测定
采用上述方法对柠檬、脐橙、南丰蜜橘和砂糖橘4个样品的果皮和果汁中类黄酮含量进行测定,结果如表6所示。不同品种柑橘含有类黄酮种类和含量差异较大。柠檬中含有较多的圣草枸橼苷,脐橙中含有较多的柚皮素-7-β-芸香糖苷与橙皮苷,而南丰蜜橘和砂糖橘果皮中均含有较多多甲氧基黄酮类。几种柑橘中均未检测出柚皮苷、柚皮素与新橙皮苷且果汁中类黄酮含量远远低于果皮中的含量。
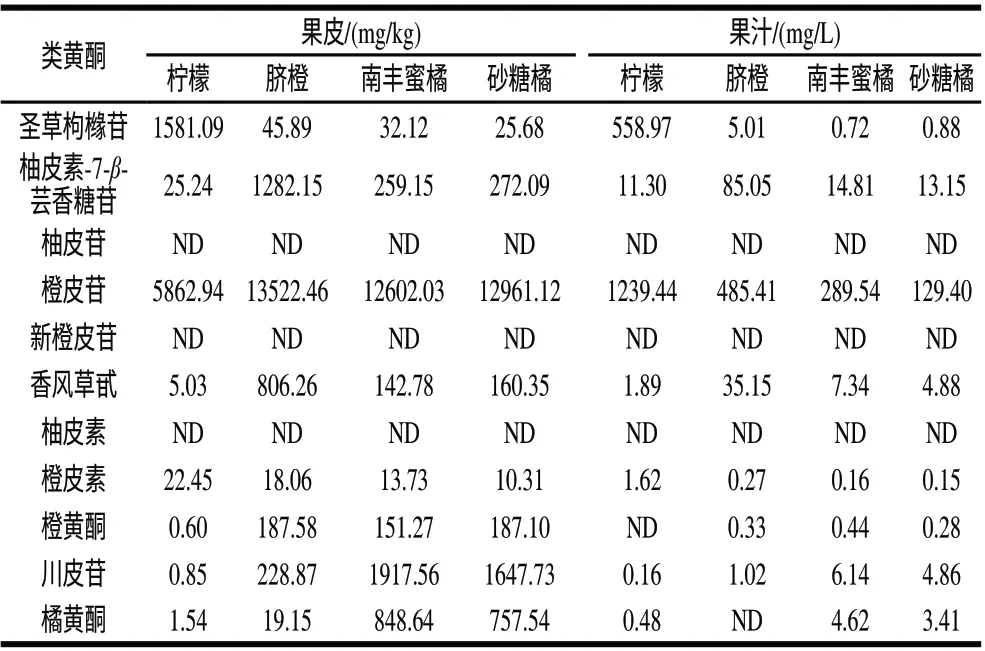
表 6 4种柑橘样品中类黄酮含量测定Table 6 The contents of flavonoids in four citrus
3 结 论
建立了快速有效的同时测定柑橘样品中11种类黄酮物质方法,11min内上述物质得到完全分离。该方法具有良好的精密度和准确度,检出限低,能满足分析要求。11种类黄酮物质在线性范围内,其质量浓度与积分峰面积均呈现出良好的线性关系。分析时间仅为普通液相色谱法的1/4,有机溶剂消耗较少,既降低了成本又减少了环境污染。可作为柑橘样品中类黄酮常规检测分析方法。
[1] LI Shiming, PAN Minhsiung, TAN Di, et al. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones[J]. Journal of Functional Foods, 2009, 1(1): 2-12.
[2] 王磊, 苏学素, 付陈梅, 等. 柑橘中多甲氧基黄酮生物活性及应用研究进展[J]. 食品科学, 2009, 30(7): 285-290.
[3] HUANG Yungsheng, HO Suchen. Polymethoxy flavones are responsible for the anti-inflammatory activity of citrus fruit peel[J]. Food Chemistry, 2010, 119(3): 868-873.
[4] KIM H G, KIM G S, PARK S, et al. Flavonoid profiling in three citrus varieties native to the Republic of Korea using liquid chromatography coupled with tandem mass spectrometry: contribution to overall antioxidant activity[J]. Biomedical Chromatography, 2012, 26(4): 464-70.
[5] KIM, H G, KIM G S, LEE J H, et al. Determination of the change of flavonoid components as the defence materials of Citrus unshiu Marc fruit peel against Penicillium digitatum by liquid chromatography coupled with tandem mass spectrometry[J]. Food Chemistry, 2011, 128(1): 549-545.
[6] PAN G G, KILMARTIN P A, SMITH B G, et al. Detection of orange juice adulteration by tangelo juice using multivariate analysis of polymethoxylated flavones and carotenoids[J]. Journal of the Science of Food and Agriculture, 2002, 82(4): 421-427.
[7] ESCRICHE I, KADAR M, DOMENECH E, et al. Using flavonoids, phenolic compounds and headspace volatile profile for botanical authentication of lemon and orange honeys[J]. Food Research International, 2011, 44(5): 1504-1513.
[8] SENTANDREU E, IZPUIERDO L, SENDRA J M. Differentiation of juices from clementine (Citrus clementina), clementine-hybrids and satsuma (Citrus unshiu) cultivars by statistical multivariate discriminant analysis of their flavanone-7-O-glycosides and fully methoxylated flavones content as determined by liquid chromatography[J]. European Food Research and Technology, 2007, 224(4): 421-429.
[9] 吴桂苹, 苏学素, 焦必宁. 柑橘活性成分检测技术研究进展[J]. 食品与发酵工业, 2006, 32(9): 116-121.
[10] 李焕霞, 吴桂苹, 王华. 甜橙皮渣膳食纤维中类黄酮化合物含量分析[J]. 饮料工业, 2008, 11(9): 33-35.
[11] BERMEJO A, LLOSA M J, CANO A. Analysis of bioactive compounds in seven citrus cultivars[J]. Food Science and Technology International, 2011, 17(1): 55-62.
[12] GREEN C O, WHEATLEY A O, MORRISON E Y, et al. Determination of polymethoxylated flavones in peels of selected Jamaican and Mexican citrus (Citrus spp.) cultivars by highperformance liquid chromatography[J]. Biomedical Chtomatography, 2007, 21(1): 48-54.
[13] BELAJOVA E, SUHAJ M. Determination of phenolic constituents in citrus juices: method of high performance liquid chromatography[J]. Food Chemistry, 2004, 86(3): 339-343.
[14] YU K, LITTLE D, PLUMB R, et al. High-throughput quantification for a drug mixture in rat plasma-a comparison of ultra performance liquid chromatography/tandem mass spectrometry with highperformance liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2006, 20(4): 544-552.
[15] GRUZ J, NOVAK O, STMAD M. Rapid analysis of phenolic acids in beverages by UPLC-MS/MS[J]. Food Chemistry, 2008, 111(3): 789-794.
[16] SPACIL Z, NOVAKOVA L, SOLICH P. Analysis of phenolic compounds by high performance liquid chromatography and ultra performance liquid chromatography[J]. Talanta, 2008, 76(1): 189-199.
[17] 付陈梅, 吴桂苹, 苏学素, 等. 液相色谱法测定柑橘果实中类黄酮方法研究[J]. 食品与发酵工业, 2008, 34(2): 121-125.
[18] RAMFUL D, BAHORUN T, BOURDON E, et al. Bioactive phenolics and antioxidant propensity of flavedo extracts of Mauritian citrus fruits: potential prophylactic ingredients for functional foods application[J]. Toxicology, 2010, 278(1): 75-87.
[19] STALIKAS C D. Extraction, separation, and detection methods for phenolic acids and flavonoids[J]. Journal of Separation Science, 2007, 30(18): 3268-3295.
