脂肪酶在尼龙网上的固定化及其酶学性质研究
2013-08-07王成涛
赵 磊,唐 婧,王成涛*
(北京工商大学 食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京 100048)
脂肪酶(EC3.1.1.3),即三酰基甘油酰基水解酶,它能在油水界面上催化酯水解和醇解、酯合成、酯交换、内酯合成及高聚物合成等有机合成反应,是目前被重点研究的酶催化剂[1]。脂肪酶广泛应用于食品工业、药物合成、农用化学品工业、油脂化学品工业、日用化学工业以及洗涤和生物表面活性剂的合成等各种生物技术领域[2]。已有文献报道采用脂肪酶催化合成乳化剂(糖酯)、表面活性剂、蜡酯及芳香酯等重要的工业产品[3]。
游离酶在工业生产中常表现出低的生物活性和稳定性,这在很大程度上限制了酶在工业中的应用[4]。这些缺点往往可通过酶的固定化克服。与游离酶相比,通常固定化酶有着较高的温度、pH值及操作稳定性[5]。硅藻土、离子交换树脂等颗粒状物质是广泛使用的固定化酶载体[6-7]。颗粒状固定化酶虽然具有许多优越特性并可经过滤回收使用,但仍存在一些问题限制其大规模使用,如:1)通常高成本,2)在两相系统中经搅拌容易破碎[6],3)不能用于固定床反应器[8-9]。目前,作为替代球状载体的海绵状、纤维状、膜状、蜂窝状等片状载体已在工业生产上开发应用[10-11]。尼龙结构类似多肽,经部分酸水解活化后产生游离氨基和羧基,可通过戊二醛与酶共价结合[12],对酶具有保护作用,而且生产成本低廉、无毒、稳定性良好、易获得。已有报道[13-17]成功将脲酶、葡萄糖氧化酶、糖化酶、碱性蛋白酶等固定于尼龙网上,并对其固定化后的酶学性质及稳定性进行了研究。然而,对脂肪酶在尼龙网上固定化的研究较少,仅黎春怡等[18]对固定化猪胰脂肪酶条件进行了优化,但尚未对其固定化后的酶学性质及稳定性进行研究。此外,微生物脂肪酶比动物脂肪酶具有更广的作用pH值和温度范围,并且便于进行工业生产而更具优越性。
本研究以尼龙网作为载体,戊二醛为交联剂,采用共价交联对微生物脂肪酶(Candida sp. 99-125)进行固定化,并研究固定化条件和固定化酶的酶学性质及稳定性。以期为尼龙网固定化脂肪酶的工业化应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
假丝酵母脂肪酶(Candida sp. 99-125) 北京化工大学谭天伟教授惠赠;尼龙网(200目)、橄榄油 国药集团化学试剂北京有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Scientz-IID型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ALC-1100.2分析天平 北京赛多利斯仪器系统有限公司;数显电子恒温水浴锅 金坛市至翔科教仪器厂;PHS-3D pH计 上海三信仪表厂;HZS-H水浴振荡器 哈尔滨东联电子技术开发有限公司。
1.3 方法
1.3.1 载体的处理与脂肪酶的固定化
剪取1cm×1cm的尼龙,将尼龙膜浸入18.6g/100mL CaCl2-18.6%水的甲醇溶液10min,轻轻搅拌,洗净晾干,后在4mol/L的HCl中水解40min,使膜边缘卷曲,水洗至中性,晾干。将处理好的膜在一定体积分数的戊二醛磷酸盐缓冲液(pH7.0)中交联适当时间,用pH7.0的0.1mol/L磷酸盐缓冲液(PBS)洗涤3~4次以除去未反应的戊二醛,晾干,得固定化膜载体。
精确称取酶粉,用0.1mol/L的PBS配成一定质量浓度酶液。将膜载体(1cm×1cm)浸润在酶液中,4℃放置一定时间,PBS液洗脱至洗脱液在280nm波长处无光吸收,得固定化脂肪酶,并将其在4℃条件下保存。
1.3.2 脂肪酶活力测定[19]
分别移取5mL 0.025mol/L磷酸缓冲液(pH7.0)和4mL聚乙烯醇橄榄油乳化液,置于40℃水浴中保温5min,然后加入脂肪酶,继续保温15min,取出立即加入95%乙醇15mL,以停止酶作用,再加酚酞指示剂3滴,用0.05mol/L氢氧化钠滴定至溶液呈粉红色为止。对照组先不加酶液,也继续保温15min后,立即取出,各加入15mL 95%乙醇,然后再加入脂肪酶。
聚乙烯醇橄榄油乳化液的制备:称取40g聚乙烯醇,加蒸馏水约1L,在小火上加热,并不停搅拌,至聚乙烯醇全部溶解,冷却后定容至1L。用双层纱布过滤,滤液备用。取4%聚乙烯醇溶液150mL,加50mL橄榄油,超声处理6min,即成乳白色聚乙烯醇橄榄油乳化液,保存于4℃备用。
酶活力以国际单位表示,即在一定条件下,脂肪酶水解脂肪每分钟产生1μmol脂肪酸的酶量定为一个国际单位。
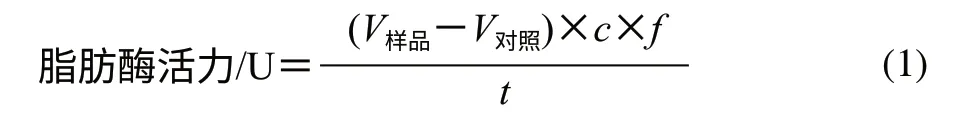
式中:V样品为样品消耗碱液体积/mL;V对照为对照组消耗碱液体积/mL;c为碱液浓度/(μmol/mL);f为稀释倍数;t为作用时间/min。
1.3.3 酶学性质的测定
1.3.3.1 最适温度
将游离酶或固定化酶加入底物溶液(pH7.0)中,于不同温度下(30~60℃,间隔5℃进行变化)进行反应,其他步骤同脂肪酶活力测定。分别以游离酶和固定化酶的最高活力为100%,进行数据处理。
1.3.3.2 热稳定性
取游离酶或固定化酶置于0.1mol/L,pH7.0的PBS缓冲液中,静置于恒温箱(30、35、40、45、50、55、60℃)中,20min后取出,测定酶活力。分别以游离酶和固定化酶的最高活性为100%,进行数据处理。
1.3.3.3 半衰期(t1/2)
固定化酶的使用稳定性常用t1/2表示,即固定化酶活力下降为最初活力一半所经历的连续工作时间。根据Arrhenius公式:

式中:at为t时刻酶的活力/(U/cm2);a0为0时刻酶的活力/(U/cm2);Kd为衰减常数。
当温度一定时,以ln(at/a0)对时间t作图为直线,其斜率为-Kd。一定温度下酶的半衰期为:t1/2=0.693/Kd。本实验采用聚乙烯醇橄榄油乳化液作为底物,取一定量游离酶和固定化酶,放入pH7.0的磷酸盐缓冲溶液中50℃保温,间隔一定时间取出测定其酶活,并依据公式(2)求出半衰期。
1.3.3.4 最适pH值
将游离酶或固定化酶置于pH值为2.0~10.0的不同pH值缓冲液配制的底物溶液中,于40℃进行反应,其他步骤同脂肪酶活力测定。分别以游离酶和固定化酶的最高活性为100%,进行数据处理。
1.3.3.5 pH值稳定性
取游离酶或固定化酶,分别于pH值为2.0~10.0的磷酸盐缓冲溶液中40℃温育2h后,取出酶测定其活性,其他步骤同脂肪酶活力测定。分别以游离酶和固定化酶的最高活性为100%,进行数据处理。
1.3.3.6 操作稳定性
以橄榄油为底物,pH7.0的磷酸盐缓冲溶液为溶剂,取面积为10cm2的固定化脂肪酶作为催化剂,在40℃、摇床转速为150r/min条件下水解反应15min,测定其初始酶活后用磷酸盐缓冲溶液冲洗干净,并拭干水分后重复使用,通过考察酶残留活性随使用次数的变化,研究酶的操作稳定性。
1.3.3.7 脂肪酶反应动力学常数测定
用聚乙烯醇橄榄油乳化液作为底物,取一定量游离酶和固定化酶,选用不同底物浓度在40℃、pH7.0条件下测定酶促反应初速率,用双倒数作图(Lineweaver-Burk)法求出相对应的Km及Vmax。
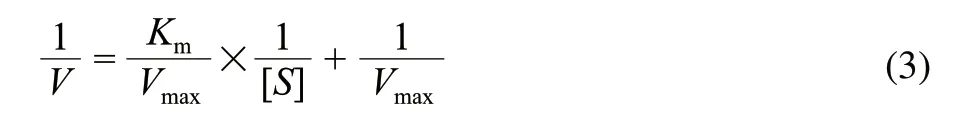
由式(3)可知1/[V]和1/[S]呈线性关系,故以1/[V]对1/[S]作图得一直线,根据其斜率及纵轴截距即可求得反应动力学常数Km及Vmax。
2 结果与分析
2.1 酶的固定化条件
2.1.1 戊二醛体积分数对固定化酶活力的影响
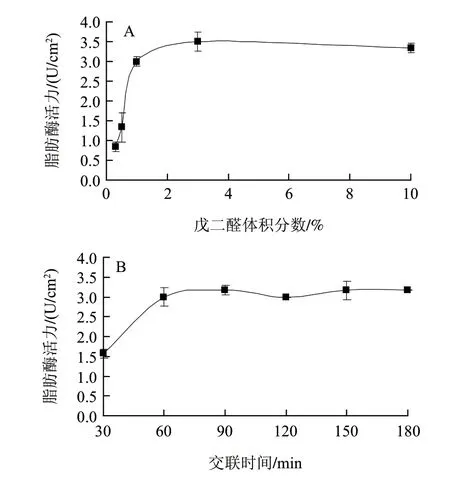
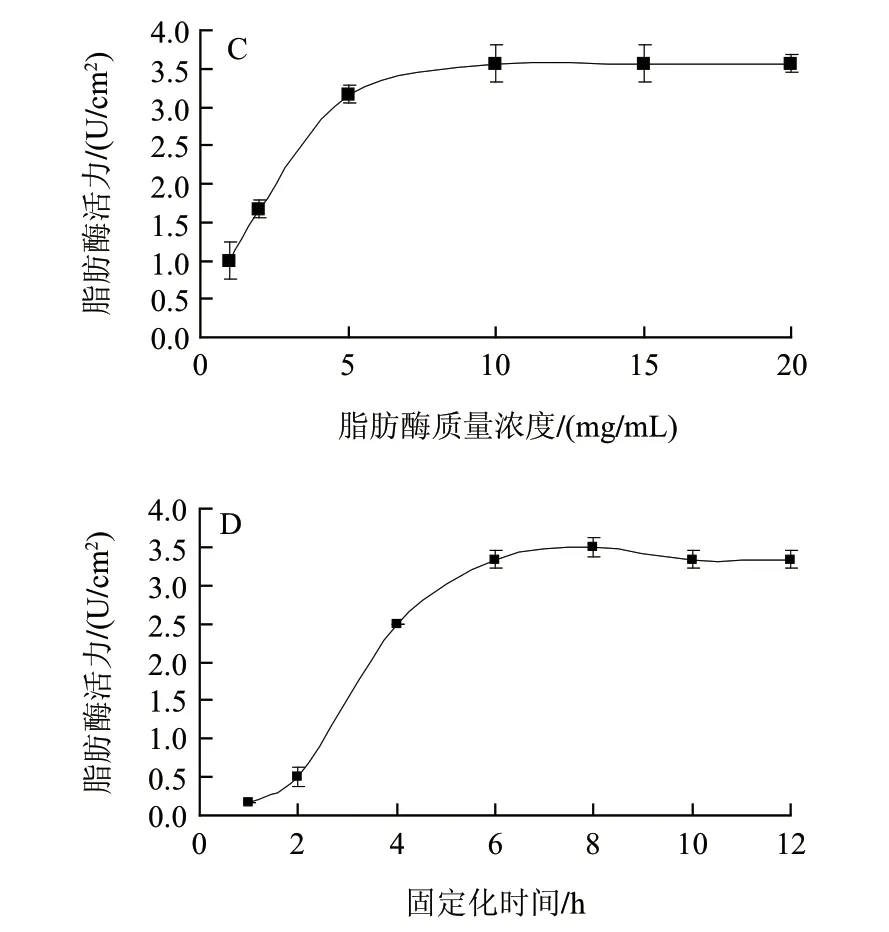
图 1 戊二醛体积分数(A)、交联时间(B)、脂肪酶质量浓度(C)和固定化时间(D)对脂肪酶固定化的影响Fig.1 Effects of glutaraldehyde concentration (A), cross-linking time (B), lipase concentration (C) and immobilization time (D) on activity of immobilized lipase
作为一种交联剂,戊二醛能够与载体和酶上的—NH2基团反应,从而在酶分子内部以及酶与载体之间形成化学键[20]。由图1A可知,随着戊二醛体积分数的增加固定化酶活力很快的上升。当交联剂戊二醛体积分数到达3%时,酶活力到达最大值3.50U/cm2,并且趋于稳定。故后续实验选用3%戊二醛为宜。
2.1.2 交联时间对固定化酶活力的影响
由图1B可知,戊二醛可迅速地与酶分子上的—NH2基团进行反应。在反应初始阶段,反应速度非常快,并在60min时固定化酶活力达到最大值。随后,由于参与反应过程的—NH2基团数量不再发生变化,继续延长交联时间至180min,对提高固定化脂肪酶活力无显著影响。故后续试验中戊二醛交联时间以60min为宜。
2.1.3 脂肪酶质量浓度对固定化酶活力的影响
由图1C可知,在尼龙网上的结合位点饱和前,随着脂肪酶质量浓度(≤10mg/mL)的增加固定化酶活力也随之增加。当脂肪酶质量浓度到达10mg/mL时,尼龙网上的结合位点达到饱和,脂肪酶活力达到最大值3.57U/cm2,并达到平稳状态,继续增加脂肪酶质量浓度并不能提高固定化酶活力。因此,后续试验中选择10mg/mL质量浓度酶液进行固定化。
2.1.4 固定化时间对固定化酶活力的影响
由图1D可知,当固定化时间为1h时,固定化酶活力几乎为零。随着固定化时间的延长,单位酶活力也逐渐增大,当固定化时间到达6h,酶活力达到最大值(3.33U/cm2),并趋于平稳。这表明,固定化时间达到6h时尼龙网上的酶结合活性位点达到饱和。因此,后续实验中固定化时间以6h为宜。
2.2 固定化酶的酶学性质
2.2.1 最适温度
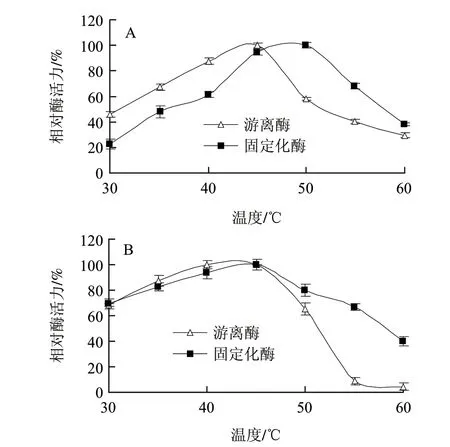
图 2 游离酶和固定化酶的最适温度(A)和温度稳定性(B)Fig.2 Effects of temperature on the activity (A) and stability (B) of free and immobilized lipase
由图2A可知,游离酶的最适温度为45℃,而固定化酶的最适温度为50℃。该脂肪酶固定化后最适温度升高,这可能是由于载体的保护作用,使酶在固定化后对热变性作用不敏感。当温度低于45℃时,游离酶的酶活力高于固定化酶,这可能与酶固定化到载体上后产生分子扩散阻力及构象改变有关。当温度高于50℃时,游离酶和固定化酶的酶活力均显著下降,这可能由于随着温度的升高,聚集的酶分子被打开最终使其失去活性。酶固定化后最适温度升高的现象在固定化酶中普遍存在[21-23]。
2.2.2 温度稳定性
游离酶和固定化酶分别置于不同温度保温20min,然后测定酶活力。由图2B可知,该酶置于30℃存放20min后的酶活力较45℃存放时降低的多,分析原因可能是该酶属于冷不稳定酶,这类酶在较低温度条件下易于失活,这大多是由于它们在较低温度易于解离成亚基。该结果与Ding Liang[24]和Kandasamy[25]等报道的相似。与游离酶相比,固定化酶可以在更高的温度下保持其活性。这表明,固定化酶的热稳定性得到了显著提高。在60℃,固定化酶仍保持其初始酶活力的40%,而游离酶活力仅残余4%。这主要是由于脂肪酶经固定化后,载体结构对酶分子起到保护作用,并且载体与酶、酶与酶之间的位点交联降低了酶结构对温度的敏感性,使酶构象不易伸展失活。同时,固定化减少了酶分子内部基团的热震动,增加了酶结构对温度变化的耐受能力,故有效降低了酶活力因外界温度变化带来的影响。
2.2.3 半衰期t1/2
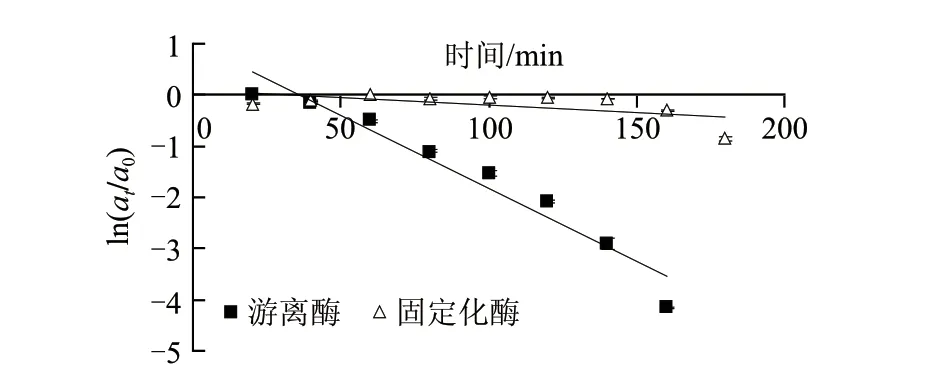
图 3 游离酶和固定化酶的半衰期曲线Fig.3 Half-life curves of free and immobilized lipase
t1/2是用于描述酶热稳定性的另一重要参数。由图3可知,随着时间的延长,固定化酶活力逐渐下降,根据斜率求得固定化酶在50℃时的半衰期为239min。与之相比,游离酶活力随时间的增加迅速下降,根据斜率求得游离酶在50℃时的半衰期为24min。固定化酶的半衰期是游离酶的9.86倍,其稳定性明显高于游离酶。这与酶与载体之间形成共价键,从而阻止酶在较高温度下的构象变化有关[26-27]。
2.2.4 最适pH值
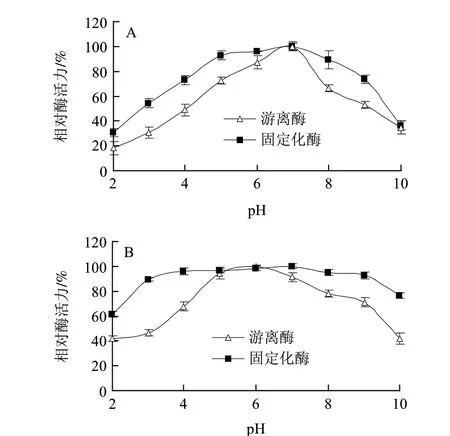
图 4 游离酶和固定化酶的最适pH值(A)和酸碱稳定性(B)Fig.4 Effects of pH on the activity (A) and stability (B) of free and immobilized lipase
图4A显示了游离酶和固定化酶的最适pH值,游离酶和固定化酶的最适pH值均为7.0,脂肪酶经固定化后其最适pH值并未发生变化,但固定化酶在pH 5.0~7.0的范围内均保持非常高的活性,这可能与载体尼龙提供的微环境保护作用有关。由于与载体的静电相互作用,通常使固定化酶的微环境和主体溶液氢离子和氢氧根离子浓度分配不同,从而其pH值谱图产生位移[28-29]。通常,当酶固定在阴离子载体上时,其最适pH值一般向碱性一侧移动,反之则向酸性一侧移动[30]。
2.2.5 pH值稳定性
由图4B可知,固定化酶活力随pH值变化改变缓慢,并较游离酶有着较好的pH值稳定性。在pH5.0~7.0范围内,游离酶可以保持其初始酶活力的90%以上;相比之下,固定化脂肪酶对pH值变化不敏感,可在更宽的pH值范围内(pH3.0~9.0)保持90%以上的初始酶活。当pH值为10.0时,固定化酶酶活力仅降低24%,而游离酶酶活力却降低了58%;当pH值为2.0时,固定化酶活力仅降低39%,而游离酶活力却降低了54%。酶经固定化后可以显著提高其pH值稳定性已被广泛证实[31-32]。
2.2.6 操作稳定性
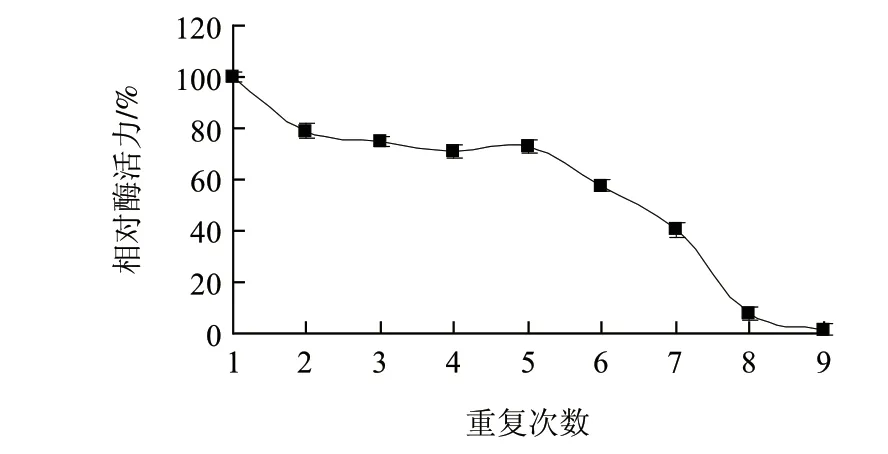
图 5 固定化酶的操作稳定性Fig.5 Operation stability of immobilized lipase
经过反复实验,测试固定化脂肪酶水解橄榄油的操作稳定性,结果见图5。在连续使用5个批次后固定化酶仍保持73%的初始酶活力。重复使用一次后,固定化脂肪酶活力较初始值降低了21%,并在后续4次使用后保持不变。经5次使用后酶活力的降低可能与酶从基质上泄漏或固定化基质表面形成乳状液薄膜有关[33]。该固定化酶表现出了良好的操作稳定性,这对于高效率地利用催化剂,降低操作成本有着重要意义。
2.2.7 酶促反应动力学常数
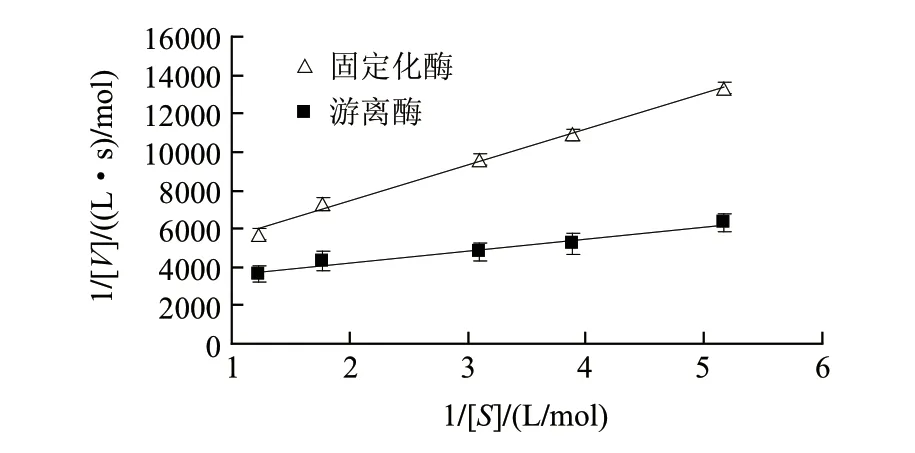
图 6 游离酶和固定化酶的Lineweaver-Burk曲线Fig.6 Lineweaver-Burk plots of free and immobilized lipase
游离酶和固定化酶水解橄榄油的Lineweaver-Burk曲线如图6所示,线性回归系数分别为0.973和0.995。经计算得出,游离酶和固定化酶的米氏常数(Km值)分别为0.21mol/L和0.57mol/L;最大反应速率(Vmax)分别为0.34×10-4mol/(L·s)和0.29×10-3mol/(L·s)。固定化酶的表观Km和Vmax均高于游离酶。表观米氏常数Km所反映出的是酶与底物的亲和能力,Km越小说明酶与底物亲和能力越强。结果显示,游离酶的Km小于固定化酶,说明游离酶对底物的亲和力要优于固定化酶。这主要是因为酶经固定化后,载体的存在增大了酶周围的空间位阻,加大了底物与载体上酶蛋白分子活性中心的结合阻力,故降低了底物与酶的亲和能力,故Km值升高。与Km的结论不同,固定化酶最大反应速率Vmax远大于游离酶。说明要达到同样的催化效果,固定化酶所需时间要短于游离酶。
3 结 论
以尼龙网为载体、戊二醛为交联剂,脂肪酶(Candida sp. 99-125)最适固定化条件为:戊二醛体积分数3%、交联时间60min、脂肪酶质量浓度10mg/mL、固定化时间6h。
与游离酶相比,固定化酶的最适温度从45℃提高至50℃,最适pH值相同,均为7.0,并在pH5.0~7.0范围内均有非常高的活力。脂肪酶经固定化后,其热稳定性、pH值稳定性、最大反应速率均得到了一定程度的提高。固定化酶的Km值为0.57mol/L,高于游离酶的Km值(0.21mol/L),与底物亲和力略有降低。经过5次重复操作使用后,固定化酶的活力仍保持在80%左右,具有良好的操作稳定性。
利用化学性质稳定,成本低廉的尼龙网固定脂肪酶,操作简便、易于保存,而且酶的稳定性良好,利用率高,为工业化应用脂肪酶奠定了基础。
[1] DOSANJH N S, KAUR J. Immobilization stability and esterifi cation studies of a lipase from a Bacillus sp.[J]. Biotechnol Appl Biochem, 2002, 36(1): 7-12.
[2] SHARMA R, CHISTI Y, BANERJEE U C. Production, purifi cation, characterization and applications of lipases[J]. Biotechnol Adv, 2001, 19: 627-662.
[3] KRISHNA S H, KARANTH N G. Lipase and lipase-catalyzed esterifi cation reactions in non-aqueous media[J]. Catal Rev-Sci Eng, 2002, 44: 499-591.
[4] YIĞITOĞLU M, TEMOÇIN Z. Immobilization of Candida rugosa lipase on glutaraldehyde-activated polyester fi ber and its application for hydrolysis of some vegetable oils[J]. J Mol Catal B-Enzym, 2010, 66: 130-135.
[5] ODIAN G G. Principles of polymerization[M]. New York: John Wiley & Sons Inc., 2004: 770.
[6] DENG Li, TAN Tianwei, WANG Fang, et al. Enzymatic production of fatty acid alkyl esters with a lipase preparation from Candida sp. 99-125[J]. Eur J Lipid Sci Tech, 2003, 105: 727-734.
[7] MONIER M, El-SOKKARY A M A, SARHAN A A. Immobilization of Candida rugosa lipase on modified natural wool fibers[J]. Funct Polym, 2010, 70: 122-128.
[8] LEI Jie, FAN Jie, YU Chengzhong, et al. Immobilization of enzymes in mesoporous materials: controlling the entrance to nanospace[J]. Micropor Mesopor Mat, 2004, 73: 121-128.
[9] HUANG Lei, CHENG Zhenmin. Immobilization of lipase on chemically modifi ed bimodal ceramic foams for olive oil hydrolysis[J]. Chem Eng J, 2008, 144: 103-109.
[10] CENTI G, PERATHONER S. Novel catalyst design for multiphase reactions[J]. Catal Today, 2003, 79-80: 3-13.
[11] BARTOLINI M, CAVRINI V, ANDRISANO V J. Monolithic micro-immobilized-enzyme reactor with human recombinant acetylcholinesterase for on-line inhibition studies[J]. J Chromatogr A, 2004, 1031: 27-34.
[12] SUNDARAM P V, HORNBY W E. Preparation and properties of urease chemically attached to nylon tube[J]. FEBS Lett, 1970, 10: 325-327.
[13] AMAYA-DELGADO L, HIDALGO-LARA M E, MONTESHORCASITAS M C. Hydrolysis of sucrose by invertase immobilized on Nylon-6 microbeads[J]. Food Chem, 2006, 99: 299-304.
[14] CHELLAPANDIAN M, SASTRY C A. Immobilization of alkaline protease on nylon[J]. Bioproc Biosyst Eng, 1994, 11: 17-21.
[15] INMAN D J, HORNBY W E. The immobilization of enzymes on nylon structures and their use in automated analysis[J]. Biochem J, 1972, 129: 255-262.
[16] PAHUJANI S, KANWAR S S, CHAUHAN G, et al. Glutaraldehyde activation of polymer Nylon-6 for lipase immobilization: enzyme characteristics and stability[J]. Bioresource Technol, 2008, 99: 2566-2570.
[17] MILLER E. Immobilization of glucoamylase on polyamide nets[J]. Acta Biotechnol, 1998, 18: 135-146.
[18] 黎春怡, 曾萍, 董利, 等. 尼龙固定化猪胰脂肪酶的条件优化[J]. 轻工科技, 2012(8): 26-27.
[19] 李建武. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1994.
[20] WATANABE N, OTA Y, MINODA Y, et al. Isolation and identifi cation of alkaline lipase producing microorganisims, cultural conditions and some properties of crude enzyme[J]. Agric Biol Chem, 1977, 41: 1353-1358.
[21] SPAGNA G, ANDREANI F, SALATELLI E, et al. Immobilization of α-L-arabinofuranosidase on chitin and chitosan[J]. Process Biochem, 1998, 33: 57-62.
[22] ELNASHAR M M M, YASSIN M A, KAHIL T. Novel thermally and mechanically stable hydrogel for enzyme immobilization of penicillin G acylase via covalent technique[J]. J Appl Polym Sci, 2008, 109: 4105-4111.
[23] ELNASHAR M M M, DANIAL E N, AWAD G E A. Novel carrier of grafted alginate for covalent immobilization of inulinase[J]. Ind Eng Chem Res, 2009, 48: 9781-9785.
[24] DING Liang, YAO Zihua, LI Tong, et al. Study on papain immobilization on a macroporous polymer carrier[J]. Turk J Chem, 2003, 27(5): 627-637.
[25] KANDASAMY R, KENNEDY L J, VIDYA C, et al. Immobilization of acidic lipase derived from Pseudomonas gessardii onto mesoporous activated carbon for the hydrolysis of olive oil[J]. J Mol Catal B-Enzym, 2010, 62: 69-66.
[26] WANG Zhengang, KE Beibei, XU Zhikang. Covalent immobilization of redox enzyme on electrospun nonwoven poly(acrylonitrileco-acrylic acid) nanofiber mesh filled with carbon nanotubes: a comprehensive study[J]. Biotechno Bioeng, 2007, 97: 708-270.
[27] HUANG Xiaojun, CHEN Pengcheng, HUANG Fu, et al. Immobilization of Candida rugosa lipase on electrospun cellulose nanofi ber membrane[J]. J Mol Catal B-Enzym, 2011, 70: 95-100.
[28] WANG Qiang, FAN Xuerong, HU Yingjun, et al. Antibacterial functionalization of wool fabric via immobilizing lysozymes[J]. Bioproc Biosyst Eng, 2009, 32(5): 633-639.
[29] KURIMOTO A, TANABE T, TACHIBANA A, et al. Keratin sponge: immobilization of lysozyme[J]. J Biosci Bioeng, 2003, 96: 307-309.
[30] COSTA S A, TZANOV T, PAAR A, et al. Immobilization of catalases from Bacillus SF on alumina for the treatment of textile bleaching effl uents[J]. Enzyme Microb Tech, 2001, 28: 815-819.
[31] KHARRAT N, ALI Y B, MARZOUK S, et al. Immobilization of Rhizopus oryzae lipase on silica aerogels by adsorption: comparison with the free enzyme[J]. Process Biochem, 2011, 46: 1083-1089.
[32] ABDEL-NABY M A, SHERIF A A, Ei-TANASH A B, et al. Immobilization of Aspergillus oryzae tannase and properties of the immobilized enzyme[J]. J Appl Microbiol, 1999, 87: 108-114.
[33] FJERBAEK L, CHRISTENSEN K V, NORDDAHL B. A review of the current state of biodiesel production using enzymatic transesterifi cation[J]. Biotechnol Bioeng, 2009, 102: 1298-1315.
