酵母原生质体制备、融合及高产β-胡萝卜素融合子的筛选
2013-08-07王岁楼王海翔杨志萍吕春晖
王岁楼,王海翔,杨志萍,吕春晖,步 芬
(中国药科大学药学院,江苏 南京 210009)
β-胡萝卜素具有提高人体免疫力、抗氧化、防癌抗癌等重要的生理功能,可广泛应用于食品、药品和化妆品等领域[1]。利用红酵母发酵生产β-胡萝卜素具有发酵周期短、营养要求简单、菌体营养丰富可直接作饲料等许多其他微生物所不具备的优点[2]。但目前所报道的红酵母菌种β-胡萝卜素产率都较低[3],据工业生产尚有差距。因此,对红酵母β-胡萝卜素生物合成技术的进一步研究具有重要意义。
目前国内外有关红酵母生产β-胡萝卜素方面的研究,多集中于对红酵母菌种的自然筛选、发酵与色素提取条件的优化以及对新原料、新技术的探索等方面[4-9]。在菌种选育方面,虽然国内外都有诱变育种的报道[10-12],但由于诱变育种盲目性大、工程浩大、周期长,国内外这方面的研究报道都不多。基因工程技术的发展和引入,加强了获取高产菌株的目的性,据报道[13]日本已有人获得了产β-胡萝卜素的工程菌。总的来看,对菌种选育包括诱变、原生质体融合及基因工程育种方面鲜有研究报道[14-17],有些类似研究工作的目标产物也不是β-胡萝卜素而是虾青素、番茄红素等其他类胡萝卜素,以β-胡萝卜素为目标产物的红酵母菌种选育研究更少。
法夫酵母Ph-1的β-胡萝卜素产量较高(7.21mg/L),但最适生长温度(20℃)和生物量(14.62g/L)都较低,不适合工业化生产之用;本实验分离出的黏红酵母NR-98菌株,虽然β-胡萝卜素产量(6.03mg/L)比法夫酵母Ph-1低,但生物量(19.85g/L)比法夫酵母Ph-1高,并且最适生长温度也较高(28℃)适宜大生产之用。因此,如果用这两株菌作为亲本,进行原生质体融合,有望获得能在28℃良好生长的高产β-胡萝卜素的融合子。本实验通过系统研究两种酵母菌原生质体制备、再生及融合的影响因素,最终筛选出一株比较理想的融合子R-5,具有实际应用前景。
1 材料与方法
1.1 菌种与试剂
黏红酵母(Rhodotorula glutinis)NR-98 本实验分离保藏;法夫酵母(Phaff ia rhodozyma)Ph-1 中国科学院微生物研究所。
三羟甲基氨基甲烷(Bis-Tris) 洛阳天骋化学试剂有限公司;聚乙二醇(PEG)-6000(进口分装) 上海化学试剂站;蜗牛酶、β-巯基乙醇 北京百泰生化技术公司;溶菌酶、纤维素酶 华美生物工程公司。
1.2 培养基和溶液
葡萄糖液体培养基:葡萄糖3%、蛋白胨1%、NH4Cl 0.5%、K2HPO40.02%、MgSO40.02%,pH 6.0;葡萄糖固体培养基:葡萄糖液体培养基中加琼脂2%;摇瓶发酵培养基:葡萄糖4%、蛋白胨2%、酵母膏1%,pH 6.0,250mL三角瓶分装50mL;蔗糖高渗再生培养基:在葡萄糖培养基中加入17%的蔗糖。以上培养基均在115℃灭菌20min。
柠檬酸-磷酸高渗缓冲液:柠檬酸80.7g、磷酸氢二钠45.23g、蔗糖205.38g、蒸馏水1000mL,pH7.0,121℃灭菌20min;助融剂:PEG-6000 35%,CaCl20.01mol/L,蔗糖0.6mol/L;其他溶液:0.05mol/L的EDTA溶液,0.5mol/L的β-巯基乙醇溶液。以上溶液均在121℃灭菌20min。1%蜗牛酶溶液,过滤除菌即可。
1.3 仪器与设备
HYG-Ⅲ型回转式恒温调速摇瓶柜 上海欣蕊自动化设备有限公司;LD5-10离心沉淀机 北京医用离心机厂;QL-901旋涡混合器 上海精科实业有限公司;756MC型紫外-可见分光光度计 上海精密科学仪器有限公司;XSP-16A普通光学显微镜 南京光学仪器厂。
1.4 培养与测定方法
种子培养方法:将法夫酵母Ph-1和黏红酵母NR-98菌株分别接种于葡萄糖固体斜面培养基,分别置20℃及28℃恒温培养,48h后各挑取一环接种于盛有10mL葡萄糖液体培养基的250mL三角瓶中,分别置20、28℃恒温振荡培养16h,转速150r/min。
发酵培养方法:将上述种子培养液按5%的接种量接入装有50mL发酵培养基的250mL三角瓶中,法夫酵母Ph-1置20℃,黏红酵母NR-98置28℃,恒温振荡培养72h,150r/min。
β-胡萝卜素的提取及测定方法参考文献[14]。
1.5 原生质体的制备及再生
1.5.1 原生质体的制备将法夫酵母Ph-1和黏红酵母NR-98分别接种于葡萄糖固体斜面,置20℃和28℃恒温培养48h后各取一环接种于盛有5mL葡萄糖液体培养基的试管中,分别置20、28℃振荡培养16h后,分别接入含有50mL葡萄糖液体培养基的250mL三角瓶中,振荡培养8h,使细胞处于对数生长前期。将上述培养液在3500r/min条件下离心10min,沉淀用无菌生理盐水洗涤离心2次,将菌体悬浮于10mL β-巯基乙醇和EDTA混合液中(1mL 0.5mol/L的β-巯基乙醇和25mL 0.05mol/L的EDTA混合),30℃振荡处理10min,分别取1mL处理菌液,适当稀释后用平板菌落计数法,测定未经酶处理的细胞数A。然后3500r/min离心10min收集菌体,用柠檬酸-磷酸高渗缓冲液洗涤2次,离心后把菌体悬浮于5mL水解酶溶液中,在30℃条件下酶解60min,并随时用显微镜观察细胞形成原生质体情况,酶解后,以3500r/min离心20min,收集菌体,用柠檬酸-磷酸高渗缓冲液洗2次,再把菌体悬浮在9mL柠檬酸-磷酸缓冲液中。
原生质体形成率的测定:取上述原生质体悬浮液各1mL,用无菌生理盐水适当稀释后涂布于葡萄糖培养基平板上(法夫酵母置20℃,黏红酵母NR-98置28℃)培养48h,计菌落数为B,为未脱壁的细胞数,则原生质体形成率计算用公式(1)。
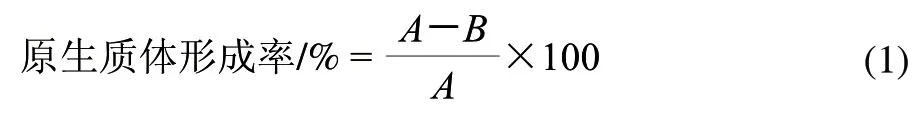
1.5.2 原生质体的再生
取两亲本原生质体悬浮液各1mL,分别用高渗缓冲液适当稀释后涂布于葡萄糖再生培养基平板,法夫酵母于20℃培养,黏红酵母NR-98于28℃培养,48h后,计菌落数为C,为未脱壁细胞数与原生质体再生细胞数之和,则原生质体再生率计算用公式(2)。
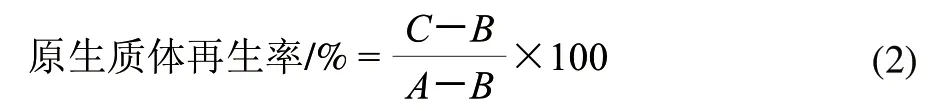
1.6 原生质体的灭活及融合
黏红酵母NR-98原生质体的灭活:为了获得遗传缺陷型标记,对菌株NR-98进行紫外灭活处理。取黏红酵母NR-98的原生质体悬浮液(浓度为5×107个/mL),倒入无菌的培养皿中,于20W紫外灯下保持30cm的垂直距离照射不同的时间,每隔5min摇动1次。照射完毕,取样镜检原生质体是否破裂或裂解。同时在照射前后分别取原生质体悬浮液涂布高渗平板,在28℃培养48h以观察存活情况。存活率以照射前后在高渗平板上生长的菌落数之比计。
原生质体的融合:取法夫酵母Ph-1的原生质体和经过灭活的黏红酵母NR-98的原生质体按1:1的比例混合于离心试管中,28℃条件下振荡15min,3500r/min离心20min,收集菌体加入5mL助融剂PEG-6000,28℃振荡处理20min,离心收集细胞,用柠檬酸-磷酸高渗缓冲液洗涤,最后悬浮于5mL柠檬酸-磷酸缓冲液中。吸取1.0mL上述细胞液进行适当稀释后,涂布于再生培养基平板上,置28℃恒温培养48h。
1.7 融合子的筛选与确定
融合子的筛选:亲本法夫酵母Ph-1最适生长温度为20℃,菌落为较大的橙黄色;黏红酵母NR-98最适生长温度为28℃,菌落为较小的浅红色或淡橙黄色。由于黏红酵母NR-98原生质体已经被灭活,两亲本原生质体都不可能在28℃再生,因此能在28℃良好生长并且菌落大、颜色与法夫酵母颜色相同者(橙黄色)应为融合子。挑取具有该特征的菌落若干个,在葡萄糖固体培养基上以划线法分离纯化后,接种于葡萄糖斜面培养基28℃培养48h后,进行种子扩大及发酵培养,测定生物量和β-胡萝卜素含量。融合子β-胡萝卜素含量的测定,方法同前述,但所有菌株放在28℃条件下恒温培养。
融合子遗传稳定性的检验:把产量高于双亲的菌株,在葡萄糖固体培养基上进行10次传代接种后,再进行发酵培养测定生物量和β-胡萝卜素含量,方法同前述。
细胞大小的测定:用显微测微尺测量细胞的长轴(a)和短轴(b),每株测定50个细胞,取平均值,按式(3)计算细胞体积。

2 结果与分析
2.1 原生质体的制备及再生
2.1.1 菌龄对原生质体形成的影响
细胞壁的成分和结构在细胞不同的时期有所不同,因而细胞对酶的敏感性有差异。通过测定生长曲线及不同培养时期细胞原生质体形成率,发现法夫酵母Ph-1和黏红酵母NR-98原生质体化的较适菌龄为12~16h左右,约处于对数生长早期。
2.1.2 预处理对原生质体形成和再生的影响
对细胞进行酶解破壁之前,可采用0.2% β-巯基乙醇和0.06mol/L的EDTA对细胞进行预处理。一般认为,硫醇化合物可切开细胞壁中的二硫键,使其对酶更敏感;EDTA作为螯合剂,可以避免金属离子对酶活力的影响,从而提高原生质体的形成率,但会降低原生质体的再生率。由表1可知,预处理促进了原生质体的形成,但对再生无显著的不利影响。
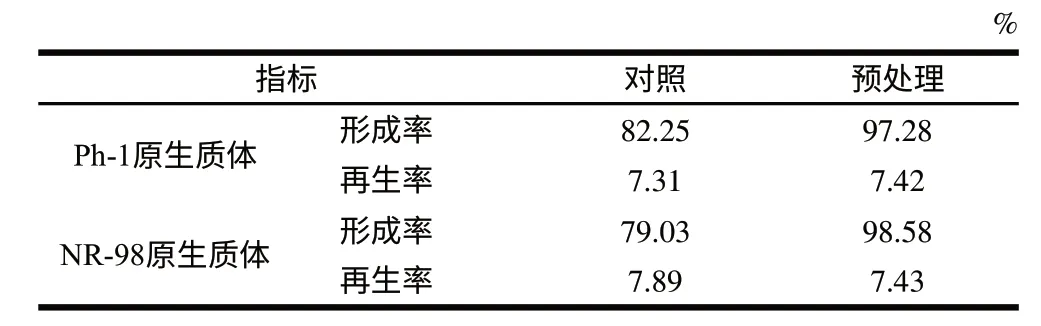
表 1 预处理对原生质体制备的影响Table 1 Effect of pretreatment on the formation and rebirth of protoplasts
2.1.3 酶系统对原生质体形成的影响
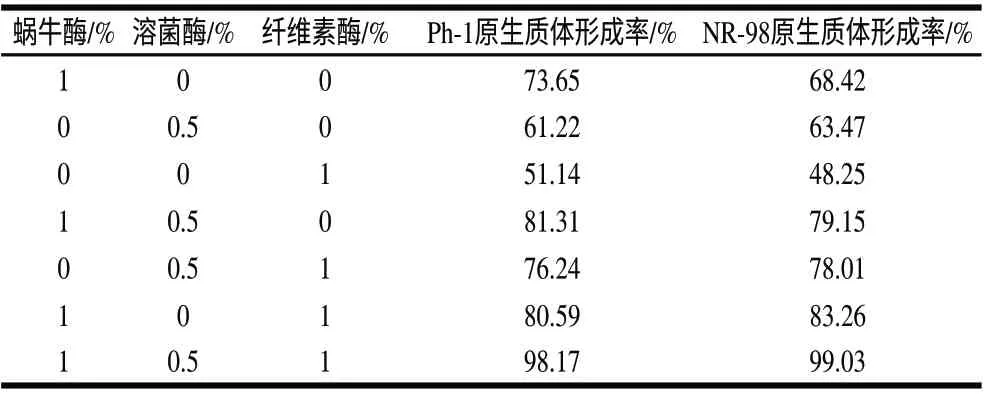
表 2 不同的酶系统对原生质体形成率的影响Table 2 Effect of enzymatic system on protoplast formation
分别用0.6mol/L蔗糖的渗透压稳定剂配制各个酶系统,以考察不同酶及浓度对原生质体形成的影响,由表2可知,在仅使用一种酶作用的情况下,1%蜗牛酶的酶解效果最好,两亲本的原生质体形成率最高;其次是溶菌酶,而纤维素酶效果较差。用3种酶以不同方式组合的酶系统均比单酶酶解效果好,其中效果最好的是3酶组合系统,即蜗牛酶1%、溶菌酶0.5%、纤维素酶1%。
2.1.4 酶解温度和时间对原生质体形成的影响
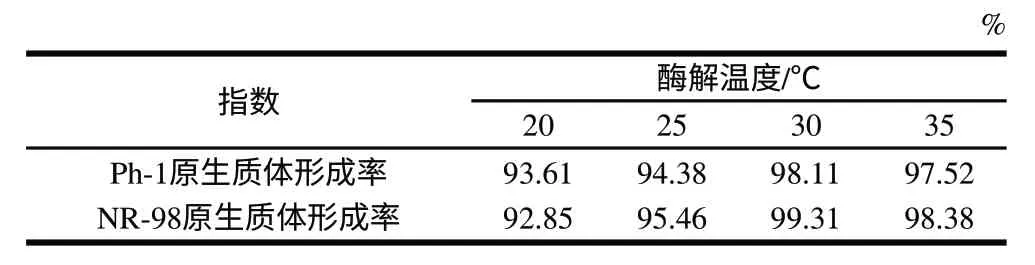
表 3 酶解温度对原生质体形成的影响Table 3 Effect of enzymatic reaction temperature on protoplast formation
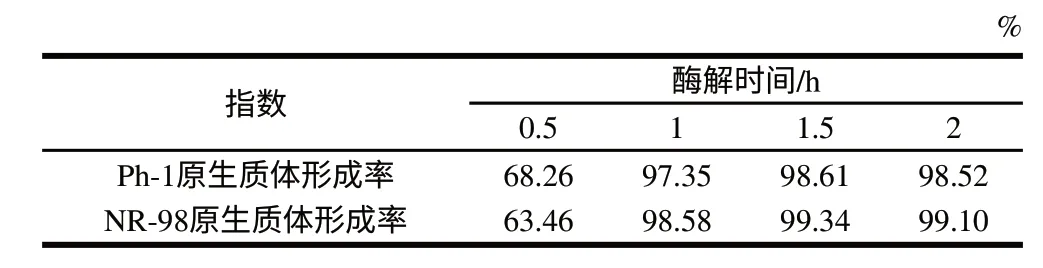
表 4 酶解时间对原生质体形成的影响Table 4 Effect of enzymatic reaction time on protoplast formation
从表3、4可以看出,随着酶解温度和时间的增加,两亲本的原生质体形成率增大,但并不是持续增大,适宜的作用条件为酶解温度30℃、酶解时间1.5h。
2.1.5 渗透压稳定剂对原生质体形成和再生的影响
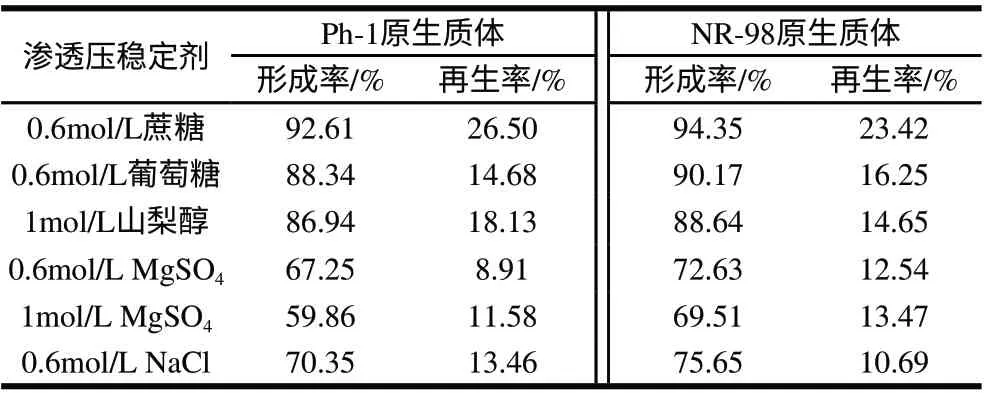
表 5 渗透压稳定剂对原生质体形成的影响Table 5 Effect of osmotic pressure on the formation and rebirth of protoplasts
渗透压稳定剂为细胞裂解释放出的原生质体提供了一个相对稳定的环境,使原生质体不会发生破裂。由表5可知,采用0.6mol/L蔗糖作稳定剂,两亲本的原生质体形成率和再生率最高,而且保持16h左右未见破裂。
2.1.6 原生质体化的结果

表 6 最适制备条件下原生质体形成率及再生率Table 6 Formation and rebirth rates of protoplasts under the optimal preparation conditions
表6是在上述各单因素试验所确定的最优制备条件组合下(菌龄12~16h、预处理、三酶系统、酶解温度30℃、酶解时间1.5h、0.6mol/L蔗糖稳定剂),两亲本原生质体化的结果。由表6可知,黏红酵母NR-98的原生质体形成率高于法夫酵母Ph-1,而后者的原生质体再生率要高于前者,但两亲本的原生质体再生率都有待进一步提高。另外,由图1可知,黏红酵母的脱壁效果较好,绝大多数菌落会由椭圆形变成圆球形(法夫酵母结果与此类似)。
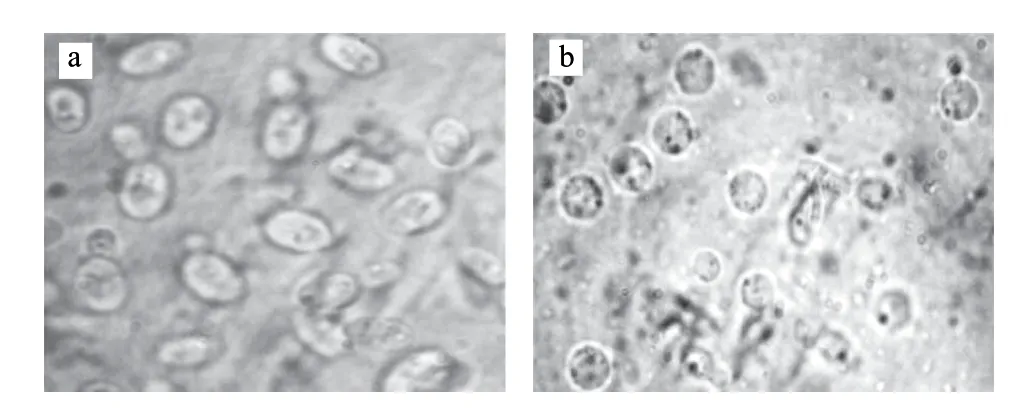
图 1 黏红酵母细胞去壁前(a)和去壁后(b)及其原生质体Fig.1 Rhodotorula glutinis and its protoplasts
2.2 原生质体的灭活及融合结果
2.2.1 原生质体灭活条件的选择
为了获得遗传缺陷型标记,采用单亲本紫外线灭活法。将亲本黏红酵母NR-98的原生质体在预热30min的紫外灯(20W)距离30cm条件下,分别照射25、30、35、40、45min进行灭活,稀释后涂布在高渗平板上于28℃培养48h,同时做对照实验,统计长成的单菌落数并计算存活率(即照射前后在高渗平板上生长的菌落数之比)。表7结果显示,黏红酵母NR-98原生质体在照射40min时的灭活率可达到100%,而且此时镜检观察原生质体是完整的。
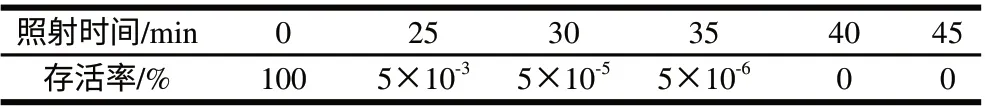
表 7 紫外线对亲本NR-98原生质体致死剂量的确定Table 7 Survival rate of protoplast NR-98 treated with UV
2.2.2 融合剂PEG-6000质量分数的影响
融合剂PEG有稳定原生质体和促进核分裂的作用,也有利于细胞壁的形成和再生,可大幅度诱导原生质体融合。由表8可知,在本实验中PEG-6000的质量分数在35%时,两原生质体的融合效果最好,融合频率可达5.78×10-5(融合频率=B×稀释倍数/A,其中B为再生培养基上的单菌落数,A为每毫升总的原生质体数)。由于PEG-6000对原生质体的毒性和原生质体对有机质稳定剂的敏感性,PEG-6000质量分数不能过大,否则融合频率会迅速下降。

表 8 PEG-6000质量分数对融合频率的影响Table 8 Effect of PEG-6000 concentration on fusant formation
2.2.3 融合时间的影响
为研究融合时间对原生质体融合的影响,分别以5、10、15、20、25、30min共6个融合时间进行实验。由表9可知,在本实验中融合时间以20min为宜,处理时间过长原生质体可能因脱水而失活,时间过短则融合频率低。

表 9 融合时间对融合频率的影响Table 9 Effect of fusion time on fusant formation
2.2.4 Ca2+浓度的影响
一般认为,在PEG诱导融合时,一定浓度的Ca2+、Mg2+,能更有效地促进融合。由表10可知,本实验中Ca2+浓度以0.05mol/L时融合率最高。
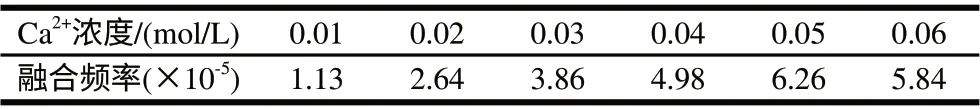
表 10 Ca2+浓度对融合频率的影响Table 10 Effect of Ca2+ concentration on fusant formation
2.3 融合子的筛选与鉴定结果
2.3.1 融合子的筛选
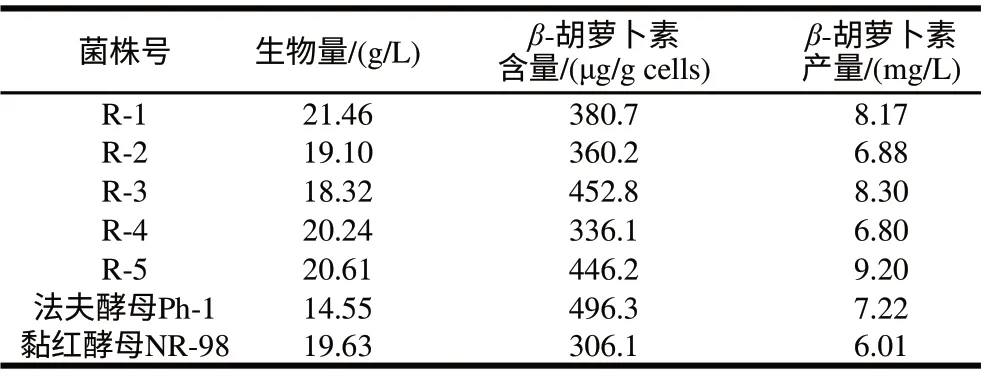
表 11 融合子与亲本的β-胡萝卜素发酵结果对照Table 11 β-Carotene production by fusants and parent strains
从原生质体融合后的再生培养基平板上,分离筛选了5株在28℃生长旺盛,菌落大而厚,颜色与黏红酵母NR-98菌株不同而与法夫酵母Ph-1颜色相同的橙黄色菌株,编号后接种进行发酵培养,对它们的生物量、β-胡萝卜素含量等进行了研究,结果见表11,上述5株融合子的生物量都高于法夫酵母Ph-1,β-胡萝卜素含量都高于黏红酵母NR-98,因而β-胡萝卜素产量均高于黏红酵母NR-98,其中R-1、R-3、R-5的β-胡萝卜素产量还高于法夫酵母Ph-1,分别比法夫酵母Ph-1提高了13.16%、14.96%和27.42%。
2.3.2 融合子的遗传稳定性
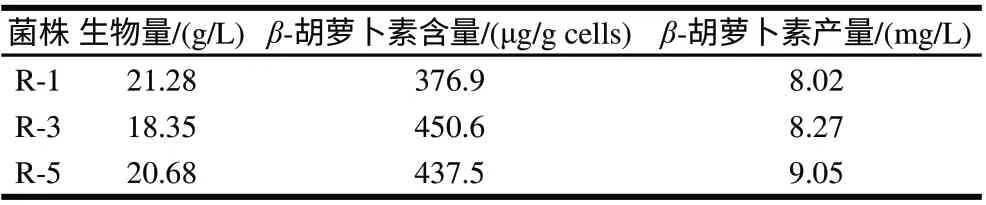
表 12 各融合子在连续10次传代后的β-胡萝卜素发酵结果Table 12 β-Carotene fermentation by the tenth generation fusants
把表12结果与表11对照可以看出,融合子R-1、R-3和R-5菌株的生物量、β-胡萝卜素含量及单位体积发酵液中β-胡萝卜素产量基本上是稳定的,可以说它们都是遗传上稳定的融合子。
2.3.3 融合子细胞的大小
当两亲本细胞融合后,其细胞体积会增大。由表13可知,融合子R-5的长短轴及细胞体积都有不同程度的增大,因此应是真正的融合子。

表 13 两亲本及融合子R-5的细胞大小Table 13 Cell sizes of parents and fusant R-5
3 结论与讨论
通过黏红酵母NR-98与法夫酵母Ph-1菌株的原生质体融合研究,成功地筛选出了β-胡萝卜素产量高于两亲本的具有遗传稳定性的融合子R-5,β-胡萝卜素产量不仅比黏红酵母NR-98提高53.33%,而且比法夫酵母Ph-1(7.22mg/L)提高了27.42%,达9.20mg/L。对该融合子发酵生理学及β-胡萝卜素发酵条件的优化是今后进一步研究的课题,以便充分发挥其产生β-胡萝卜素的能力。
影响原生质体制备及融合的因素很多[10,14],如水解酶及其作用条件(酶用量、酶处理温度、作用时间和pH值等)、菌龄、菌体预处理、培养基组成、渗透压稳定剂及助融剂等。在研究红酵母原生质体形成时,首先使用了一些常规的裂解酶如蜗牛酶等,发现原生质化率较低。这可能是因为红酵母的细胞壁坚韧,而且细胞个体小,所以很难原生质化。同时使用蜗牛酶、溶菌酶和纤维素酶时原生质体形成率明显提高。另外,同时使用β-葡萄糖醛酸苷酶(β-glucuronidase)、裂解酶(lysing enzyme)及酵母溶壁酶(lyticase) 3种酶时[15],红酵母原生质化率也大大提高。实验中发现,原生质体相比原始细胞,形状发生了较大变化,接近于圆形;折光度也有较大提高,液泡更加清晰。今后对原生质体制备条件的进一步优化及原生质体融合中某些新技术如紫外灭活技术、电融合技术等的应用都是要深入研究的内容。
一般认为原生质体融合获得的融合子,其重组率较之常规的要高很多,但选择融合子依然是非常困难的,需要有比较好的筛选标记[11]。本实验中选择的筛选标记都是亲本自身的生理生化特征,即选择能在28℃生长、颜色为较大的黄色菌落转接培养,同时考察其β-胡萝卜素产量高于黏红酵母10%者,初步认为是融合子。虽然在融合前对亲本之一的黏红酵母进行了紫外线灭活,但“灭活法”对原生质体纯度要求很高,必须经过一定的方法分离纯化以除去菌丝残片。另外,由于红酵母自身不能合成硫胺素,故可考虑在缺硫胺素的基本培养基中检出融合子。但是,红酵母在只有碳、氮源的基本培养基中,依然可以长出正常的菌落,因此也不能作为筛选标记。本实验以细胞本身的生理生化特征为筛选标记虽然简便可行,但工作量大,也不具有一定的筛选压力,自然难以达到很理想的结果。因此,必须获得有更好筛选标记的菌株才能得到稳定遗传的优良融合子,例如通过紫外诱变筛选营养缺陷型的红酵母突变株作融合的亲本,这方面的实验仍在进行中。
[1] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社,2005.
[2] 王岁楼. 红酵母发酵生产β-胡萝卜素[J]. 食品研究与开发, 2010,31(12): 250-255.
[3] 王岁楼, 张平之. 利用红酵母发酵生产β-胡萝卜素的研究进展[J]. 微生物学杂志, 2000, 20(2): 40-43.
[4] BHOSALE P B. Studies on yeast Rhodotorula, its carotenoids and their applications[D]. Pune: University of Pune, 2001.
[5] AKSU Z, EREN A T. Production of carotenoids by the isolated yeast of Rhodotorula glutinis[J]. Biochemical Engineering Journal, 2007,35: 107-113.
[6] MALISORN C, SUNTORNSUK W. Optimization of β-carotene production by Rhodotorula glutinis DM28 in fermented radish brine[J]. Bioresource Technology, 2008, 99: 2281-2287.
[7] YEN Hongwei, ZHANG Zhiyong. Enhancement of cell growth rate by light irradiation in the cultivation of Rhodotorula glutinis[J].Bioresource Technology, 2011, 102: 9279-9281.
[8] WANG Suilou, SUN Junshe, HAN Beizhong. Optimization of β-carotene production by Rhodotorula glutinis using high hydrostatic pressure and response surface methodology[J]. Journal of Food Science, 2007, 72(8): 325-329.
[9] BHOSALE P B, GADRE R V. Production of β-carotene by a mutant of Rhodotorula glutinis[J]. Appl Microbiol Biotechnol, 2001, 55:423-427.
[10] 陈春涛, 王岁楼, 卫军. 产类胡萝卜素酵母菌原生质体的制备、再生与诱变[J]. 生物技术, 2002, 12(3): 23-25.
[11] 顾蕾. 一株产β-胡萝卜素红酵母的诱变育种及发酵条件的研究[D].南京: 南京师范大学, 2004.
[12] WANG Suilou, WU Xiaozong, SUN Junshe. Effects of high hydrostatic pressure on the growth and its β-carotene production of Rhodotorula glutinis[J]. Yeast, 2008, 25(4): 251-257.
[13] SHIMADA H, KONDO K, MISAWA N. Increased carotenoid production by the food yeast Candida utilis through metabolic engineering of the isoperonoid pathway[J]. Appl Environ Microbiol,1998, 59: 2676-2680.
[14] 卫军, 陈春涛, 王岁楼. 原生质融合选育高产β-胡萝卜素酵母菌[J].郑州轻工业学院学报, 2002, 17(2): 96-99.
[15] EVANS C T, CONRAD D. An improved method for protoplast formation and its application in the fusion of Rhodotorula rubra with Sacchacerevistae[J]. Archives of Microbiol, 1987, 148: 77-82.
[16] 田小群. 红法夫酵母的诱变和原生质体融合及发酵优化研究[D]. 广州: 华南理工大学, 2003.
[17] NAMTHIP C K, TOSHIHIDE K, SHIRO N. Increased astaxanthin production by Phaffia rhodozyma mutants isolated as resistant to diphenylamine[J]. Journal of Fermentation and Bioengineering, 1997,83(5): 429-434.
