蚂蚁抗菌肽的分离纯化及其活性
2013-08-07崔敬爱陈晓平
苏 翔,崔敬爱,陈晓平
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
抗菌肽是一类活性小肽,广泛存在于生物体内。它具有抗菌能力强、抗菌谱广、种类多、可供选择范围广、靶菌株不易产生抗性突变等特点[1-2]。近年来,国内外对各类抗菌肽的研究取得很大进展,在很多微生物对抗生素产生抗药性的今天,抗菌肽将会成为新一代的临床抗菌药物,在化妆品、生物农药、生物饲料添加剂、天然食品防腐剂和动植物抗病基因工程方面也将有着广阔的应用前景[3-6]。蚂蚁体内含有特殊的“蚂蚁抗生素”[7]。此外,蚂蚁还有生活适应能力强、世代周期短、繁殖力高等生物学特点,故研究蚂蚁抗菌肽的分离纯化工艺对开拓蚂蚁抗菌肽资源具有重要意义[8-9]。本研究通过对蚂蚁抗菌肽的分离纯化及某些抗菌活性的研究,为以后开展此项研究提供材料。
1 材料与方法
1.1 材料与试剂
蚂蚁,购于吉林农业大学立新参茸店。
乙醇(分析纯) 北京化工厂;葡聚糖凝胶柱Sephadex G-25 北京鼎国昌盛生物技术有限责任公司;标准蛋白质(SM1891) 加拿大Fermentas公司;测试菌株 由吉林农业大学食品工程教研室提供。
营养肉汤培养基、LB液体培养基、LB固体培养基:参考《分子克隆实验指南》中培养基配方配制。
1.2 仪器与设备
DZF-6050真空干燥箱 上海博迅实业有限公司;XA-1组织粉碎机 金坛市科析仪器有限公司;DY89-1电动玻璃匀浆机 宁波新芝生物科技股份有限公司;GL-21LM高速冷冻离心机 湖南星科科学仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;FD-1C-50冷冻干燥机 北京博医康试验仪器有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;DYY-11电泳仪 北京市六一仪器厂;电子恒温水浴锅 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 粗提物的制备
将蚂蚁洗净,放在托盘内摊平。将托盘放入真空干燥箱,在40℃条件下烘干至质量恒定。用组织粉碎机进行粉碎,过60目筛得蚂蚁粉。取10g蚂蚁粉按料液比1:30(m/V)加入60%乙醇,用电动匀浆机匀浆后在4℃条件下浸提24h。滤纸过滤,将提取液在4℃、7000r/min条件下离心20min,取上清液,于-80℃冰箱冻藏,得蚂蚁抗菌肽粗提液。将粗提液经旋转蒸发挥去乙醇,真空冷冻干燥制成褐色粉末,即蚂蚁抗菌肽的粗提物。
1.3.2 蚂蚁抗菌肽的纯化
参考陆婕等[10]方法,采用加热-层析法对蚂蚁抗菌肽粗提液进行分离纯化。将粗提液置于100℃水浴中保温20min,然后在4℃、15000r/min条件下离心30min,收集沉淀,得热变性蛋白记为a,将上清液冷冻干燥,得到干物质记为b。对热变性蛋白a及干物质b进行抑菌实验,检测其有无抑菌活性。将有抑菌活性的干物质b溶于5mL去离子水上柱,以浓度为0.05mol/L、pH7.4的磷酸盐缓冲液洗脱,进行Sephadex G-25柱层析分离。用自动部分收集器收集,设定12min收集1管。用紫外分光光度计在波长280nm处测其吸光度,收集洗脱峰,进行抑菌实验,有抑菌作用的峰值管里物质即为蚂蚁抗菌肽的提纯物。
1.3.3 蚂蚁抗菌肽的抑菌活性
1.3.3.1 抑菌活性检测
采用琼脂孔穴扩散法[11],以大肠埃希氏菌(ATCC 25922)、金黄色葡萄球菌(ATCC 29213)为受试菌。将大肠埃希氏菌和金黄色葡萄球菌分别接种至LB液体培养基与营养肉汤培养基,振荡后放于37℃培养箱内培养48h,活化2~3次。将加热融化的LB固体培养基15mL注入到平皿中,待凝固后,吸取菌浓为103CFU/mL的2种受试菌液各100μL加入不同平皿[12],涂布均匀。在培养基已挖好的孔洞里加入40μL提取液,并做阴性、阳性对照。其中阴性对照为蒸馏水,阳性对照为质量浓度100μg/mL的氨苄青霉素溶液。置于37℃培养箱内培养24h,观察抑菌效果,测量抑菌圈直径。实验重复3次,计算平均值。
1.3.3.2 SDS-PAGE检测
配制5mL 15%分离胶和2mL 5%浓缩胶,电泳开始时,在80V电压下电泳30min左右,待指示前沿到达分离胶上沿时,将电压调至130V,至蓝色指示前沿至分离胶3/4位置时停止电泳。将胶置于5%戊二醛溶液中固定30min,再经考马斯亮蓝R-250染色1h,脱色过夜,直至显现出清晰的蛋白质条带[13]。
1.3.3.3 标准曲线法测定抗菌肽分子质量
以标准蛋白质相对分子质量的对数为纵坐标,相对迁移率为横坐标作图,得到标准曲线[14]。根据样品蛋白质在电泳图谱上的相对迁移率,计算出其分子质量。
1.3.3.4 最小抑菌质量浓度测定
采用微量液体检测法[15],对定量的蚂蚁抗菌肽提纯物作2倍递减浓度稀释,分别为0.020312、0.040625、0.08125、0.1625、0.325、0.65、1.3mg/mL,对大肠埃希氏菌(ATCC 25922)、金黄色葡萄球菌(ATCC 29213)、肠炎沙门氏菌(ATCC 13076)、枯草芽孢杆菌(ATCC 11060)做抑菌实验,抑菌圈直径在10mm以上的为最小抑菌质量浓度[16]。实验重复3次,计算平均值。
1.3.3.5 耐热性检测
将蚂蚁抗菌肽配成质量浓度为1.0mg/mL的溶液,在80、100、121℃条件下分别加热30min,对大肠埃希氏菌及金黄色葡萄球菌做抑菌实验,观察抑菌圈直径变化,以未经加热的抗菌肽溶液为对照。实验重复3次,计算平均值。
2 结果与分析
2.1 Sephadex G-25柱层析分离结果
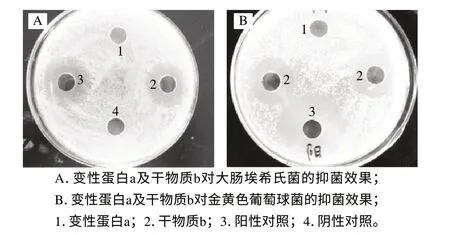
图 1 变性蛋白a及干物质b对大肠埃希氏菌和金黄色葡萄球菌的抑菌效果Fig.1 Bacteriostatic capacity of denatured protein a and dry material b on to Escherichia coli and Staphylococcus aureus
由图1可见,阳性对照氨苄青霉素溶液对大肠埃希氏菌及金黄色葡萄球菌的抑菌圈明显,而阴性对照蒸馏水则无抑菌圈。与氨苄青霉素溶液与蒸馏水对照,热变性蛋白a对大肠埃希氏菌及金黄色葡萄球菌均无抑菌作用,干物质b则对两种细菌抑菌作用明显,可见加热能除去不耐热蛋白,有利于耐热性好的抗菌肽的分离。
干物质b经Sephadex G-25柱层析分离后,用紫外分光光度计在波长280nm处测其吸光度,结果如图2所示。通过抑菌实验,抗菌肽在第30和31号收集管中。
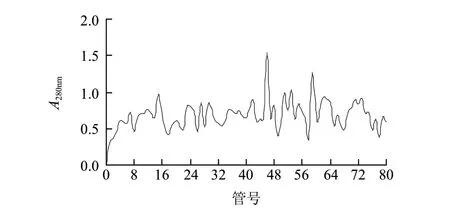
图 2 Sephadex G-25柱层析分离结果Fig.2 Chromatographic separation of antimicrobial peptide on Sephadex G-25 column
2.2 SDS-PAGE电泳测分子质量
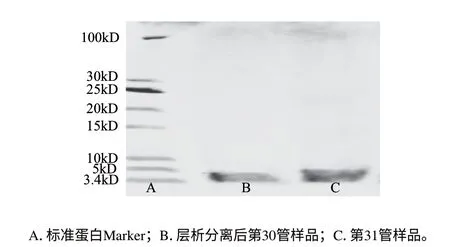
图 3 样品的SDS-PAGE电泳图Fig.3 SDS-PAGE of antimicrobial peptide samples
将经加热-层析法得到的样品进行SDS-PAGE电泳,并根据标准曲线计算其相对分子质量。电泳图如图3所示。由图3可见,经加热-层析法所制得的样品在胶上表现为单一蛋白条带。以标准蛋白的相对迁移率为横坐标,相对分子质量的对数为纵坐标,绘制标准曲线,根据回归方程y=-2.6865x+2.1712(R2=0.9869),计算出蚂蚁抗菌肽提纯物的分子质量为3.746kD。
2.3 蚂蚁抗菌肽提纯物的最小抑菌质量浓度

表 1 蚂蚁抗菌肽的抑菌活性Table 1 Antibacterial activity of antimicrobial peptides from ants
由表1可知,蚂蚁抗菌肽对4种细菌都有一定的抑菌效果,对大肠埃希氏菌、金黄色葡萄球菌、肠炎沙门氏菌、枯草芽孢杆菌的最小抑菌质量浓度分别为0.325、0.65、0.1625、0.325mg/mL。
2.4 蚂蚁抗菌肽的耐热性

图 4 不同温度加热对蚂蚁抗菌肽抑菌效果的影响Fig.4 Bacteriostatic effect of peptides from ants subjected to heating treatment at various temperatures
由图4可知,蚂蚁抗菌肽在80℃和100℃加热后对大肠埃希氏菌的抑菌活性变化不大,在121℃抑菌活性出现下降,对金黄色葡萄球菌的抑菌活性随加热温度增大有所增强。可见蚂蚁抗菌肽具有较好的耐热性。
3 讨 论
抗菌肽对很多致病菌均具有抑菌作用,具有广谱抑菌效果。目前国内外关于抗菌肽对肿瘤细胞的杀伤作用进行了大量研究,且取得了很大进展[17-18]。本实验结果表明,分离纯化出的蚂蚁抗菌肽对大肠埃希氏菌、金黄色葡萄球菌、肠炎沙门氏菌、枯草芽孢杆菌均具有很好的抑菌效果。至于蚂蚁抗菌肽对于其他致病菌和肿瘤细胞有无抑制及杀伤作用有待今后进一步研究。
蚂蚁抗菌肽的提纯工艺目前处于实验研究阶段,较难进行大规模生产。本实验在分离纯化过程中,利用抗菌肽的耐热性,采用加热-层析法得到了蚂蚁抗菌肽提纯物,相比其他传统提纯工艺,大大简化了工艺步骤,在大规模生产中将会降低企业生产成本,且加热能使外源性蛋白酶变性失活,避免抗菌肽发生降解,有利于在生产中保证其质量和稳定性。本实验未对蚂蚁抗菌肽提纯物进行氨基酸组成和结构分析,有待于进一步研究。
蚂蚁的世代周期短、繁殖力高等生物学特点决定了其资源丰富且价格低廉,从蚂蚁中提取抗菌肽仍具有较好的应用前景。
4 结 论
经乙醇浸提和加热层析,得到纯度较高、耐热性好的蚂蚁抗菌肽。其分子质量为3.746kD。蚂蚁抗菌肽对大肠埃希氏菌、金黄色葡萄球菌、肠炎沙门氏菌、枯草芽孢杆菌均有不同程度的抑菌作用,最小抑菌质量浓度分别为0.325、0.65、0.1625、0.325mg/mL。
[1] 高琳琳, 李卫东. 昆虫抗菌肽及其应用研究进展[J]. 中国病原生物学杂志, 2010, 5(9): 710-713.
[2] ZASLOFF M. Antimicrobial peptides of multicellular organisms[J].Nature, 2002, 415: 389-395.
[3] 肖明珠, 金小宝, 朱家勇. 抗菌肽抗氧化作用机制及其应用前景[J].食品科学, 2010, 31(11): 312-315.
[4] SHIN S, KIM J K, LEE J Y, et al. Design of potent 9-mer antimicrobial peptide analogs of protaetiamycine and investigation of mechanism of antimicrobial action[J]. J Pept Sci, 2009, 15(3): 589-594.
[5] 黄现清, 高晓平, 赵改名, 等. 抗菌肽抑菌机制研究进展[J]. 生物学杂志, 2010, 27(2): 62-66.
[6] RAHNAMAEIAN M, LANGEN G, IMANI J, et al. Insect peptide metchnikowin confers on barley a selective capacity for resistance to fungal ascomycetes pathogens[J]. J Exp Bot, 2009, 60(14): 4105-4114.
[7] ZELEZETSKY I, PAG U, ANTCHEVA N, et al. Identification and optimization of an antimicrobial peptide from the ant venom toxin pilosulin[J]. Arch Biochem and Biophys, 2005, 434(2): 358-364.
[8] LEULIER F, LEMAITRE B. Toll-like receptors-taking an evolutionary approach[J]. Nat Rev Genet, 2008, 9(3): 165-178.
[9] 陈晓鸣, 冯颖. 资源昆虫学概论[M]. 北京: 科学出版社, 2009: 7.
[10] 陆婕, 钟雅, 柳林, 等. 家蝇蛆抗菌肽提取工艺研究[J]. 昆虫学报,2007, 50(2): 106-112.
[11] 郭娜, 肖向红, 徐义刚, 等. 东北林蛙皮肤抗菌肽dybowskin-1ST的表达、纯化及抑菌活性分析[J]. 中国农业科学, 2011, 44(15):3246-3251.
[12] 王战勇, 井静, 苏婷婷. 中国林蛙皮抗菌肽的提取及其抗菌活性的研究[J]. 食品科技, 2010, 35(6): 235-238.
[13] 胡兰. 动物生物化学实验教程[M]. 2版. 北京: 中国农业大学出版社, 2007: 8.
[14] 石继红, 赵永同, 张英起, 等. 应用SDS-PAGE显示小分子多肽技术的探讨[J]. 生物工程进展, 2001, 21(1): 38-40.
[15] 王战勇, 李宁, 苏婷婷. 中国林蛙皮抗菌肽的提取纯化及抑菌活性检测[J]. 食品科学, 2010, 31(3): 132-135.
[16] 于文会, 姜晓文. 中国林蛙皮肤抗菌肽的分离纯化及部分特性研究[J]. 黑龙江畜牧兽医, 2002(5): 3-4.
[17] BHUTIA S K, MAITI T K. Targeting tumors with peptides from natural sources[J]. Trends Biotechnology, 2008, 26(4): 210-217.
[18] HOSKIN D W, RAMAMOORTHY A. Studies on anticancer activities of antimicrobial peptides[J]. Biochin Biophys Acta, 2008, 1778(2):357-375.
