乳清分离蛋白美拉德反应产物的体外抗氧化特性
2013-08-07王文琼包怡红
王文琼,包怡红*,陈 颖
(东北林业大学林学院,黑龙江 哈尔滨 150040)
美拉德反应又称为“非酶褐变反应”,主要是指食品中的氨基化合物(氨基酸、肽及蛋白质)与羰基化合物(糖类)之间发生的复杂反应。美拉德反应历程复杂,产物中含有类黑精、还原酮及一系列含氮、硫的杂环化合物[1]。反应经过复杂的历程,最终生成棕色甚至是黑色的大分子物质——类黑精或称拟黑素。Maillard在1912—1917年间对美拉德反应做了卓有成效的研究,之后Hodge等[2]对该反应的化学途径进行了研究和描述。
美拉德反应产物(MRPs)的抗氧化性能是近年来国外食品营养学、食品化学领域研究的热门课题,而MRPs中的挥发性杂环化合物在其抗氧化性能方面起着重要作用[3]。近年来的研究表明,MRPs有很强的消除活性氧的能力。Hayase等[4]提出类黑精具有很强的消除活性氧的能力,可抑制脂类氧化。Morales等[5]研究发现赖氨酸-葡萄糖模式美拉德反应产物清除DPPH自由基的能力与体系的荧光强度有很好的线性关系。Benjakul等[6]研究发现蛋白质-还原糖模式美拉德反应产物的还原力与褐变程度有良好的线性关系。赵艳娜等[7]研究发现乳清蛋白-乳糖复合物具有较高的的还原力及对DPPH自由基的清除能力。而乳清分离蛋白与小分子糖类反应后的终产物对活氧自由基的清除能力国内外未见报道。MRPs是食品加工和贮藏过程中产生的一类物质,可以认为是天然的,所以越来越多的学者主张制备MRPs加入食品体系或者应用热处理工艺促使食品形成MRPs,从而提高产品的抗氧化稳定性。
近年来,我国干酪需要强劲,而发展干酪产业将产生大量乳清,目前我国尚缺乏乳清分离蛋白综合利用相关技术。因此,迫切需要开发乳清分离蛋白综合利用技术,以实现干酪产业的可持续发展。本研究利用乳清分离蛋白与小分子糖类发生的美拉德反应,对乳清分离蛋白进行改性,在改善乳清分离蛋白体外抗氧化活性的同时,为糖基化改性乳清分离蛋白作为天然抗菌剂、天然防腐剂和免疫增强剂提供理论基础。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白(蛋白含量92.4%),来自新西兰;1,1-二苯基-2-三硝基苯肼(DPPH)、Tris-HCl 美国Sigma公司;其他试剂为国产分析纯。
1.2 仪器与设备
TGL-16C高速离心机 上海安亭科学仪器厂;UT-1810PC紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 乳清分离蛋白糖基复合物的制备
将乳清分离蛋白和木糖(X)、葡萄糖(G)、果糖(F)、乳糖(L)、蔗糖(S)、麦芽糖(M),分别按质量之比4:1、3:1、2:1、1:1、1:2、1:3溶解,制成总质量浓度为60mg/mL的水溶液(pH6.86左右),然后放入具塞试管中,并置于烘箱中,控制在50℃条件下进行反应,反应7d,即得乳清分离蛋白糖基复合物。
1.3.2 褐变程度分析
参照Ajandouz等[8]的方法。将待测样品用蒸馏水进行稀释成质量浓度为10mg/mL的溶液,测定其在420nm波长处的吸光度。
1.3.3 还原能力测定
参照Oyaizu等[9]的方法。取60mg/mL 0.5mL样品,加入0.2mol/L 2.5mL(pH6.6)磷酸盐缓冲液和2.5mL 1g/100mL铁氰化钾溶液,混合均匀。50℃水浴中保持20min后冷却,再加入2.5mL 10g/100mL三氯乙酸溶液,5500r/min离心10min。取2.5mL上层清液,加入2.5mL蒸馏水和0.5mL的0.1g/100mL氯化铁溶液,混合均匀,静置10min后,在700nm波长处测定其吸光度。
1.3.4 清除DPPH自由基能力的测定
参照Brand-Williams等[10]的方法。将样品稀释至30mg/mL,取1.0mL样品及4.0mL 0.12mmol/L的DPPH乙醇溶液(体积分数为95%),混匀,室温下避光反应30min,在5500r/min条件下离心5min。用体积分数为95%乙醇溶液作参比,于517nm波长测定吸光度。根据式(1)计算每种样品液对DPPH自由基的清除率。
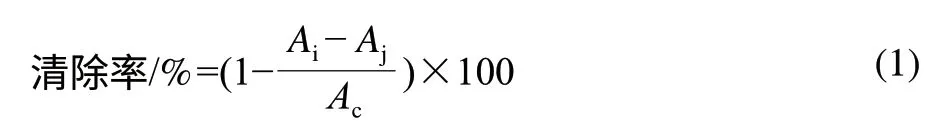
式中:Ai为加样品液后DPPH溶液的吸光度;Aj为样品液的吸光度;Ac为未加样品液时DPPH溶液的吸光度。
1.3.5 清除·OH能力的测定
参照申衍豪等[11]的方法,向试管中加入样品溶液30mg/mL 1.00mL、硫酸亚铁溶液10mmol/L 1.00mL、水杨酸-乙醇10mmol/L 1.00mL、最后加入H2O2(0.03%)1.00mL启动反应,振荡混合,水浴37℃,保温30min,5500r/min离心7min,在波长510nm处测吸光度。

式中:Ac为样品不加清除剂的吸光度;As为样品加清除剂的吸光度;A0为空白管吸光度,以水代替样品。
1.3.6 抗脂质过氧化能力测定
根据Gu Fenglin等[12]的方法,制备脂质体PBS分散体系(LLS):30mg卵磷脂溶于10mmol/L 30mL LPBS(pH7.4)溶液中,超声波处理得到均质的脂质体分散液。于样品管中依次加入1mL LLS、1mL 400μm/L硫酸亚铁溶液和1mL样品,混匀。避光于37℃水浴60min,然后加入2mL的三氯乙酸(TCA)-硫代巴比妥酸(TBA)-盐酸(HCl)混合液(TCA-TBA-HCl混合液,15g TCA、0.375g TBA、2.1mL HCl依次溶于100mL水中),100℃水浴15min,冷却,5500r/min离心10min,取上清液532nm波长处测得吸光度。
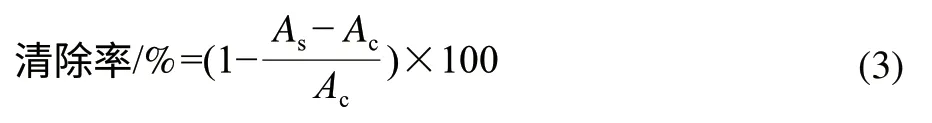
式中:As为加样品管吸光度;Ac为空白管吸光度,以水代替样液。
1.3.7 清除O2-·能力的测定
参照傅亮等[13]的方法,取9mL 50mmol/L Tris-HCl缓冲溶液(pH 8.2),0.6mL超纯水,混匀后于25℃水浴中保温20min,再加入25℃预热的0.2mL 7.5mmol/L邻苯三酚以10mmol/L HCl配制,空白管用10mmol/L HCl代替邻苯三酚的盐酸溶液,摇匀后倒入比色杯,在波长325nm 处测定吸光度,计时3min后再次测定吸光度,计算吸光度增加值。在加入邻苯三酚前,先加入一定体积的样品溶液,相应减少加入水的体积,其他操作如上。根据测定管吸光度的变化计算对O2-·的抑制率。
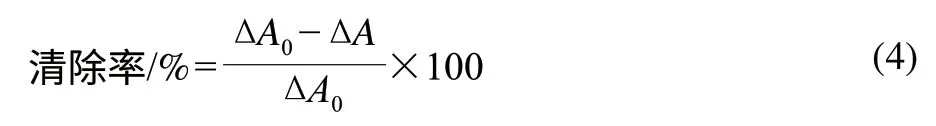
式中:ΔA0为邻苯三酚自氧化3min内增加值;ΔA为加入样品溶液后邻苯三酚自氧化3min内增加值。
1.4 统计分析
2 结果与分析
2.1 乳清分离蛋白糖基化反应褐变程度变化
不同比例的乳清分离蛋白-木糖(WPI-X)、乳清分离蛋白-葡萄糖(WPI-G)、乳清分离蛋白-果糖(WPI-F)、乳清分离蛋白-乳糖(WPI-L)、乳清分离蛋白-蔗糖(WPI-S)、乳清分离蛋白-麦芽糖(WPI-M)6种糖基化复合物与未处理的乳清分离蛋白反应后的褐变程度分析,褐变程度结果如表1所示。
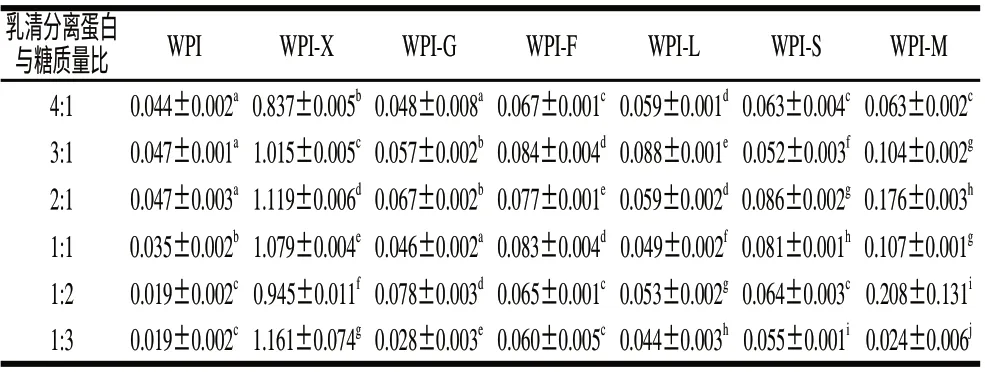
表 1 乳清分离蛋白糖基化复合物在420nm波长处的吸光度Table 1 Change in absorbance of different glycosylated whey protein isolate at 420 nm
由表1可知,湿热糖基化反应后,不同乳清分离蛋白与糖质量比的WPI-X复合物的A420nm明显高于其他5种乳清分离蛋白糖基化复合物,差异显著(P<0.05);且乳清分离蛋白与木糖在2:1的条件下反应后A420nm高于其他比例的WPI-X复合物,差异显著(P<0.05);乳清分离蛋白与葡萄糖、果糖在2:1条件下反应后的吸光度与其他比例的吸光度差异显著(P<0.05);糖基化反应后,WPI-X复合物的颜色变化最大,颜色最深,为棕褐色;WPI-L、WPI-G为淡黄色;其他3种复合物的颜色较浅,为乳白色,而WPI-M复合物在A420nm大于WPI-G和WPI-L的吸光度,是因为乳清分离蛋白与麦芽糖加热后,液体变浑浊导致WPI-M吸光度变大,而其颜色没有明显变化。因此可得出,木糖的羰基反应活性较高,比其他5种糖与乳清分离蛋白的湿热糖基化反应迅速。
2.2 乳清分离蛋白糖基化产物还原能力
乳清分离蛋白与6种不同糖基配体在不同质量比例条件下进行湿热糖基化反应后的还原能力,以及质量分数为0.01% VC的还原能力,实验结果如图1所示。
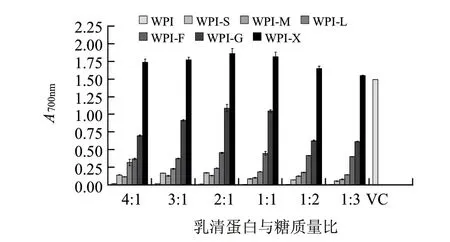
图 1 乳清分离蛋白及其糖基化产物的还原能力Fig.1 Reducing power of whey protein isolate and its glycosylated products
由图1可知,乳清分离蛋白与6种糖基配体按不同质量比混合,湿热糖基化反应后的还原能力差异显著(P<0.05),糖基化反应后,不同比例的WPI-X复合物与其他5种乳清分离蛋白糖基化复合物相比还原能力最高,且不同质量比的WPI-X复合物的还原能力均高于0.01% VC的还原能力。在乳清分离蛋白与木糖和葡萄糖按质量之比2:1条件下反应后,还原能力均高于其他比例的混合物。因此可得出,乳清分离蛋白与木糖的美拉德反应产物是良好的电子供体,其供应的电子不仅能使Fe3+还原成 Fe2+,同时能与自由基反应,使自由基成为较为稳定的物质,从而中断自由基连锁反应。
2.3 乳清分离蛋白糖基化产物对DPPH自由基清除能力
乳清分离蛋白与6种不同糖基配体在不同质量比例条件下进行湿热糖基化反应后对DPPH自由基清除能力,以及质量分数为0.01% VC的DPPH自由基清除能力,结果如图2所示。
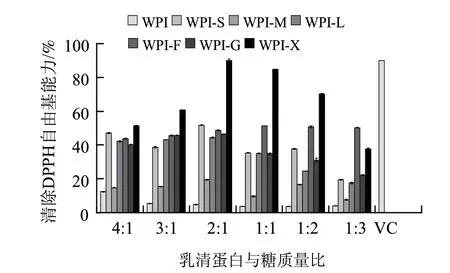
图 2 乳清分离蛋白及其糖基化产物的DPPH自由基清除能力Fig.2 DPPH free radical scavenging activity of whey protein isolate and its glycosylated products
由图2可知,乳清分离蛋白与6种糖基配体按不同质量比混合,湿热糖基化反应后对DPPH自由基的清除能力差异显著(P<0.05),糖基化反应后,不同质量比的WPI-X复合物与其他5种乳清蛋白糖基化复合物相比对DPPH自由基的清除能力最高。在乳清分离蛋白与木糖按质量比2:1条件下反应后,对DPPH自由基的清除能力均高于其他比例的混合物,DPPH试剂的紫色明显减弱,吸光度降低。随着乳清分离蛋白比例的降低,即随糖基配体比例的增加,乳清蛋白糖基化复合物对DPPH自由基的清除能力增加,当乳清分离蛋白与糖基配体的质量比达到2:1时,对DPPH自由基的清除率达到最大,随着糖基配体含量的增加,清除率下降。因此可以得出,糖基化反应后抗氧化物质的产生不仅与糖基配体的种类有关还与参与反应的乳清分离蛋白与糖的质量比有关。适宜比例的乳清分离蛋白与糖基配体混合物会促进美拉德反应产物的积累,最终提高终产物对DPPH自由基的清除能力。
2.4 乳清分离蛋白糖基化产物对·OH清除能力
乳清分离蛋白与6种不同糖基配体在不同比例条件下进行湿热糖基化反应后对·OH清除能力能力,以及质量分数为0.01% VC对·OH清除能力实验结果如图3所示。
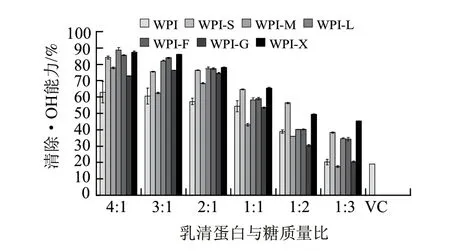
图 3 乳清分离蛋白及其糖基化产物清除·OH能力Fig.3 Hydroxyl radical scavenging activity of whey protein isolate and its glycosylated products
由图3可知,乳清分离蛋白和6种不同比例的乳清分离蛋白糖基化复合物与质量分数为0.01%的VC相比对·OH的清除能力差异显著(P<0.05),且明显高于0.01% VC。湿热糖基化反应后,不同比例的糖基化复合物对·OH清除能力差异显著(P<0.05);随乳清分离蛋白比例的减少,反应后糖基化复合物对·OH的清除能力逐渐递减,而没有增加的趋势,说明大分子蛋白对·OH的清除能力高于糖基化终产物的清除能力,可能是因为蛋白质分子质量大,其对Fe2+螯合能力强,导致随乳清蛋白在样品中所占物质的量增加时对·OH的清除能力也降低。6种糖基化复合物反应后对·OH的清除能力均高于乳清分离蛋白。原因可能是,乳清分离蛋白质分子糖基化以后,分子质量增加,螯合Fe2+能力增强,使之不能产生·OH,阻止反应的进行,从而导致其清除能力变大[13-14]。
2.5 乳清分离蛋白糖基化产物抗脂质过氧化能力
WPI与6种不同糖基配体在不同比例条件下进行湿热糖基化反应后抗脂质过氧化能力,以及质量分数为0.01%的BHA抗脂质过氧化能力实验结果如图4所示。
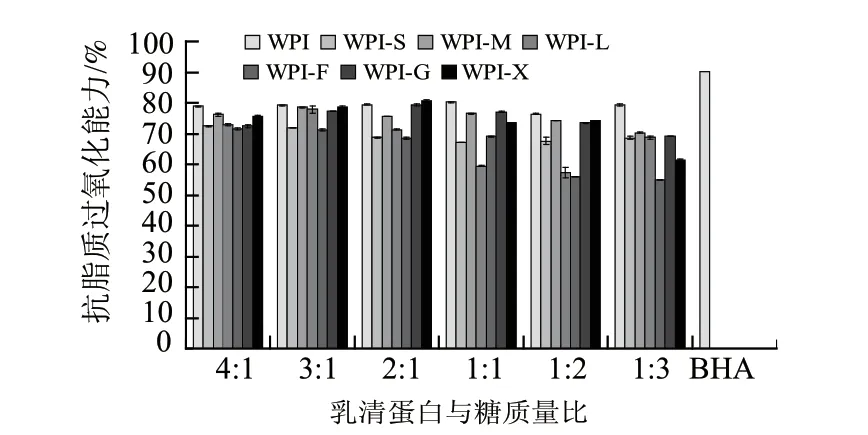
图 4 乳清分离蛋白及其糖基化产物的抗脂质过氧化能力Fig.4 Inhibitory effect of whey protein isolate and its glycosylated products on lipid peroxidation
由图4可知,糖基化反应后,WPI和6种不同比例的糖基化复合物与质量分数为0.01% BHA之间抗脂质过氧化能力差异显著(P<0.05),且低于0.01% BHA的抗脂质过氧化能力。当乳清分离蛋白与木糖按物质的量之比2:1条件下反应后,其抗脂质过氧化能力略高于其他5种糖基化复合物。随着乳清分离蛋白在混合物中所占比例的降低,乳清分离蛋白糖基化复合物抗脂质过氧化能力逐渐降低;除在4:1条件下外,WPI-X和WPI-G复合物与其他复合物之间抗脂质过氧化能力差异显著(P<0.05),具有较高的抗脂质过氧化能力。因此可以得出,乳清分离蛋白糖基化复合物的抗脂质过氧化能力不仅与糖基配体的种类有关,还与参与反应的蛋白与糖基配体的混合比例有关。另外,美拉德反应产物十分复杂,关于其抗脂质过氧化的机制目前还很难去解释。在实际应用中,张曦等[15]以乳清蛋白和木糖为原料制备可食用薄膜,对核桃仁进行包裹,结果显示:乳清蛋白-木糖美拉德反应产物膜包裹可以延缓核桃仁酸价的上升,而乳清蛋白膜对核桃仁的酸价上升无明显的抑制作用。
2.6 乳清分离蛋白糖基化产物对O2-·清除能力
乳清分离蛋白与6种不同糖基配体在不同质量比条件下进行湿热糖基化反应后对O2-·清除能力,以及质量分数为0.01%的VC对O2-·清除能力实验结果如图5所示。利用邻苯三酚在碱性条件下能够迅速自氧化,生成吸收波长在318nm附近的系列中间产物,同时释放出O2-·,此自由基能促进邻苯三酚自氧化,因此通过测定某物质对邻苯三酚的抑制作用,即可表征对其O2-·的清除作用[16]。
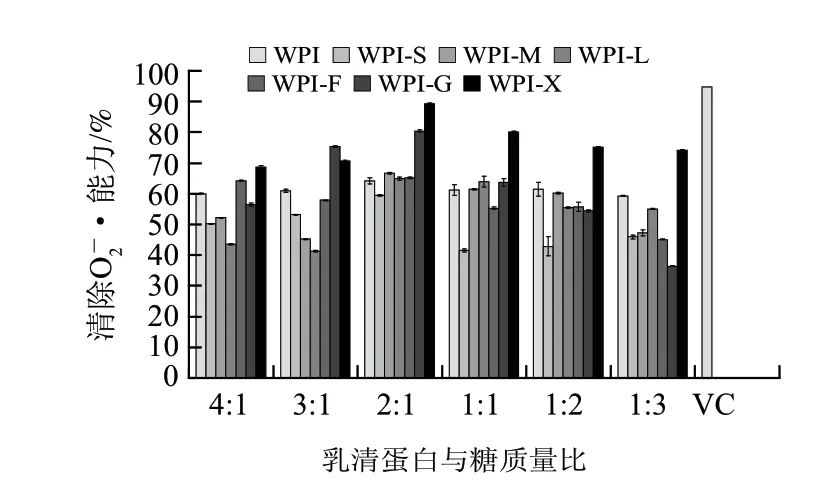
图 5 乳清分离蛋白及其糖基化产物的清除O2-·能力Fig.5 Superoxide anion radical scavenging capacity of whey protein isolate and its glycosylated products
由图5可知,不同比例的6种糖基化复合物和WPI与质量分数为0.01% VC之间对O2-·清除能力差异显著(P<0.05),均低于质量分数为0.01% VC对O2-·的清除能力。随乳清蛋白在混合物中所占比例的减少,反应后的乳清蛋白糖基化复合物对O2-·的清除能力增加,当乳清蛋白与糖基配体的混合比例达到2:1时,达到最大,随着糖基配体含量的增加,糖基化反应后产物对O2-·的清除能力降低。湿热糖基化反应后,不同比例的乳清蛋白和木糖混合物反应后产物与其他5种糖基化复合物之间清除O2-·的能力差异显著(P<0.05),且清除率最高,即对邻苯三酚的自氧化具有较好的抑制作用。因此可以得出,乳清分离蛋白与糖参与的美拉德反应进行的程度以及,对O2-·的清除能力不仅与糖基配体的种类有关还与参与反应的乳清蛋白与糖基配体的物质的量比例有关。
3 结 论
本实验通过木糖、葡萄糖、果糖、乳糖、蔗糖、麦芽糖与乳清分离蛋白按不同质量比混合进行美拉德反应,来研究乳清分离蛋白糖基化复合物在不同比例条件下的反应终产物的褐变情况,还原能力以及抗氧化能力。结果发现,美拉德反应产物(MRPs)中的高相对分子质量(Mw>3500)部分如类黑素具有清除自由基的抗氧化作用并与420nm的光吸收值相关[17-18];且褐变程度越深,其还原能力、清除DPPH自由基能力、清除O2-·能力以及抗脂质过氧化能力越强。另外适当比例的乳清分离蛋白与糖基配体混合经美拉德反应会促进美拉德反应终产物类黑精、还原酮及一些含N、S的杂环化合物等具有较强的抗氧化活性物质的积累,增强乳清分离蛋白体外抗氧化能力。而且从以上结果可以看出,美拉德反应不仅与乳清蛋白与糖基配体参与反应的质量比有关,还与参与反应的糖的种类有关,其中乳清分离蛋白与蔗糖美拉德反应程度最低,其体外抗氧化能力也最低,WPI与木糖美拉德反应程度最大,其体外抗氧化能力也最强。因此可以看出,还原型五碳糖(木糖)参与美拉德反应的活性明显高于还原性六碳糖。具有抗氧化能力的糖基化改性乳清分离蛋白的研究为开发食用油脂微胶囊功能性壁材以及可使用保鲜膜的研究开辟了新的途径,改性乳清分离蛋白的这一功能特性是普通抗氧化剂VC所不能达到的。
[1] 王惠英, 孙涛, 周冬香, 等. L-赖氨酸与D-核糖的模式美拉德反应及其产物抗氧化性能研究[J]. 食品科学, 2008, 29(5): 112-113.
[2] HODGE J E. Chemistry of browning reactions in model systems[J]. J Agric Food Chem, 1953, 1: 928-943.
[3] 庄名扬, 杨涛. 美拉德反应产物的生理活性及增量的技术措施[J]. 酿酒, 2009, 36(3): 80-81.
[4] HAYASE F, TAKAHASHI Y, TOMINAGA S, et al. Identifi cation of blue pigment formed in a D-xylose-glycine reaction system[J]. Biosci Biotechnol Biochem, 1999, 63: 1512-1514.
[5] MORALES F J, JIMENEZ-PEREZ S. Free radical scavenging capacity of Maillard reaction products as related to colour and fl uorescence[J]. Food Chemistry, 2001, 72: 119-125.
[6] BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J]. Food Chemistry, 2005, 93: 189-196.
[7] 赵艳娜, 辛岩, 姜瞻梅. 乳清蛋白糖基化反应特性及抗氧化性的研究[J]. 中国乳品工业, 2010, 38(8): 18-21.
[8] AJANDOUZ E H, TCHIAKPE L S, ORE F D, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Journal of Food Science, 2001, 66: 926-931.
[9] OYAIZU M. Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J]. Nippon Shokuhin Kogyo Gakkaishi, 1986, 35: 771-775.
[10] BRAND-WALLIAMS W, CUVELIER M E, BARSET C. Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel-Wissens-Chaft and Technologies, 1995, 28: 5-30.
[11] 申衍豪, 刘芳. 酶法制备大米活性肽及抗氧化性的研究[J]. 现代农业科技, 2010(23): 319-321.
[12] GU Fenglin, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafi ltrated Maillard reaction products from a casein: glucose model system[J]. Food Chemistry, 2009, 117: 48-54.
[13] 傅亮, 何倩, 陈勇, 等. 绿豆多肽的制备工艺及抗氧化作用[J]. 食品与机械, 2010, 26(6): 79-81.
[14] 万国华, 徐国海, 陈芬. 白蛋白多肽体外抗氧化的研究[J]. 孝感学院学报, 2007, 27(6): 8-10.
[15] 张曦, 李琦, 景浩. 乳清蛋白-木糖美拉德反应产物的成膜性及其膜包裹对核桃仁脂质过氧化的抑制作用[J]. 食品科学, 2011, 32(5): 58-61.
[16] 吴晓鹏, 王一飞, 刘秋英, 等. 苦丁茶多糖抗氧化活性研究[J]. 食品与发酵工业, 2008, 34(2): 34-36.
[17] XU Qingping, TAO Wenyi, AO Zonghua. Antioxidant activity of vinegar melanoidins[J]. Food Chemistry, 2007, 102: 841-849.
[18] 郭丽萍, 王凤舞, 刘翠翠. 木糖与甘氨酸美拉德反应产物抗氧化性能的研究[J]. 食品工业科技, 2012, 33(7): 79-81.
