嗜酸乳杆菌NCFM胞外多糖对小鼠免疫相关基因的调控
2013-08-07杨相宜满朝新王今雨董鑫悦闫天文姜毓君
杨相宜,满朝新,刘 颖,王今雨,郎 友,董鑫悦,闫天文,姜毓君,,*
(1.东北农业大学食品学院 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.东北农业大学 国家乳业工程技术研究中心,黑龙江 哈尔滨 150086)
嗜酸乳杆菌(Lactobacillus acidophilus)是人体小肠内的主要益生菌,具有调整肠道菌群平衡,抑制肠道不良微生物的增殖,增强免疫和延缓机体衰老等作用。嗜酸乳杆菌胞外多糖(EPS)是嗜酸乳杆菌在生长代谢过程中分泌到细胞壁外、易与菌体分离的水溶性多糖,属于次级代谢产物。大量研究表明,胞外多糖安全无毒,具有免疫调节、抗肿瘤、降胆固醇和抗氧化等益生作用[1-2],因此备受人们的关注。现有研究表明,胞外多糖可以作为一种天然的食品添加剂,有效抑制有害微生物生长,并且对人体有益[3]。有研究发现,嗜酸乳杆菌的免疫调节作用与其分泌的胞外多糖有很大的关系[4]。目前,对于胞外多糖的研究很多,但极少有人从宿主免疫相关基因角度入手分析胞外多糖对机体的免疫调节作用。由于CCL2和IL18在提高宿主免疫功能的过程中发挥着重要的作用,本实验对嗜酸乳杆菌NCFM胞外多糖作用于小鼠肠组织后引起的CCL2和IL18基因的表达变化进行研究,为更深入了解嗜酸乳杆菌的生理功能提供参考。
1 材料与方法
1.1 材料与试剂
昆明系小鼠,体质量平均为(20±2)g,购自黑龙江省医科大学实验动物中心。
嗜酸乳杆菌(Lactobacillus acidophilus)NCFM由丹麦丹尼斯克公司(Danisco)惠赠。
总RNA提取试剂Trizol Reagent 美国Invitrogen公司;Ex ScriptTMRT-PCR Kit、SYBR Premix Ex TapTMII 大连TaKaRa公司。
1.2 仪器与设备
ABI7500实时荧光PCR仪 美国ABI公司;G1-21M冷冻离心机 上海市离心机械研究所;LGJ-1型冷冻干燥机 上海医用分析仪器厂;DYY-10C型电泳仪 北京市六一仪器厂;UVP凝胶成像系统 美国UVP公司。
1.3 胞外多糖的提取
将实验室保存的嗜酸乳杆菌NCFM活化后,按3%接种量接入MRS培养基中,37℃培养24h后,8000r/min、4℃离心15min,取上清液。将上清液减压浓缩至1/3体积,酶解后用Sevag法(氯仿、正丁醇体积比5:1)除蛋白。再经过过氧化氢脱色、乙醇沉淀多糖、透析、冻干,得粗胞外多糖(EPS)粉末。将粗EPS溶于去离子水,经DEAE-Sephadex离子交换柱纯化,最后浓缩、透析、冻干得到一种白色纤维状疏松固体,该物质极易溶于水,水溶液显酸性。用苯酚-硫酸法检测所得物质纯度[5]。
1.4 构建小鼠模型
本实验采用昆明系小鼠(20±2)g,雌雄各半,自由采食,分为对照组(每天灌胃生理盐水)、实验组(灌胃剂量为100mg/(kg·d)胞外多糖)。连续灌胃14d,分别在0、1、4、7、10、14d处死小鼠,每个时间点每组10只,取胸腺和脾脏称质量,计算脏器系数[2]。取小鼠空肠和回肠,用Trizol法提取肠组织RNA,以琼脂糖凝胶电泳检测并测定其波长260nm和280nm处的光密度值,计算OD260nm/OD280nm比值,分析纯度。
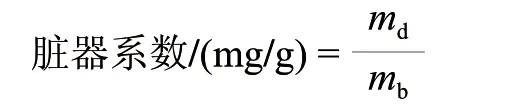
式中:md为脏器的绝对质量(肝脏质量+脾脏质量)/mg;mb为小鼠体质量/g。
1.5 Real-time RT- PCR验证小鼠免疫相关基因
1.5.1 引物设计
在GenBank中查找出各基因的序列,使用Primer 5.0软件对各差异表达基因进行跨内含子设计引物,见表1,实验利用GAPDH作为内参基因,消除本底模板差异。
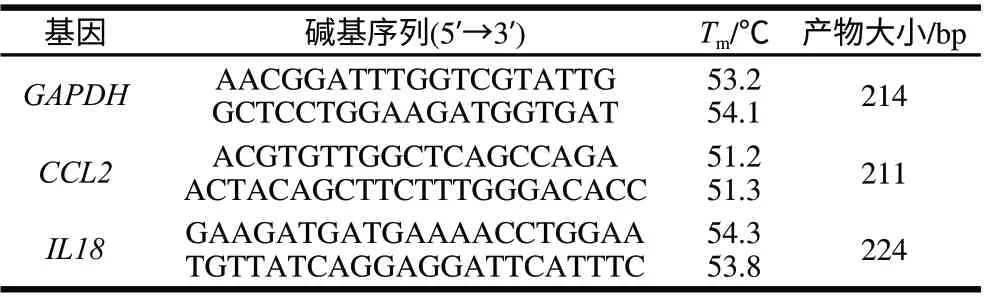
表 1 待测基因Real-time RT PCR引物的碱基序列、Tm值及扩增产物的大小Table 1 Base sequences and Tm of specific oligonucleotide primers for RT-PCR as well as the sizes of PCR products
1.5.2 反转录反应条件
反转录条件:37℃、15min;85℃、5s。Real-time PCR反应条件:95℃预变性10s;95℃变性5s,60℃退火34s,循环40次,20μL体系。
1.5.3 统计分析
将每个待测样品均设3个重复,利用2 -ΔΔCt法对目的基因的相对表达量进行评价。所得数据利用SPSS 18.0软件进行分析,采用单项方差分析法计算3次重复得到的相对定量的标准差,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 苯酚-硫酸法测胞外多糖含量
葡萄糖标准曲线y=0.9657x-0.018(R2=0.9955),线性关系良好,可以用于计算胞外多糖纯度。通过计算,胞外多糖纯度为87.93%。将所得胞外多糖溶于Tris中,进行蛋白电泳测定,泳道无条带(图未附加),表明无蛋白残留,可用于后续实验。
2.2 脏器系数
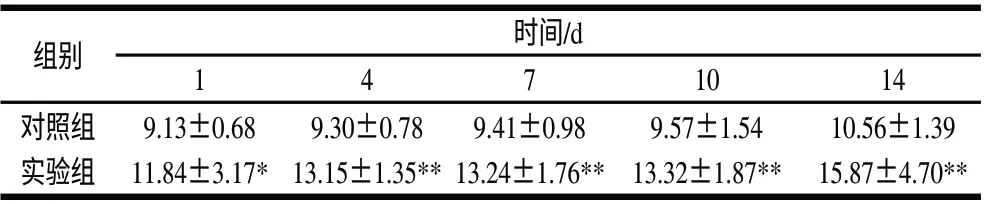
表 2 嗜酸乳杆菌NCFM胞外多糖对小鼠免疫脏器器官的影响Table 2 Effect of exopolysaccharide produced by Lactobacillus acidophilus NCFM on immune organs of mice
胸腺和脾脏是最重要的免疫器官,为了研究胞外多糖是否可以促进免疫器官发挥免疫调节作用,本实验取小鼠胸腺和脾脏称质量,分析胞外多糖对其质量变化的影响。由表2可知,随着时间的延长,对照组的脏器系数略升高,实验组的脏器系数明显升高。且与对照组相比,实验组可以显著增加脏器的质量(P<0.05和P<0.01)。说明嗜酸乳杆菌NCFM胞外多糖可以促进免疫器官质量增加,进而起到促进免疫功能的作用。
2.3 小鼠免疫相关基因CCL2和IL18的验证
2.3.1 RNA提取和纯度检测
测定所提取的总RNA的OD260nm、OD280nm值[6],算得OD260nm/OD280nm均在1.8~2.2范围内(实验组为2.01,对照组为2.07),表明所提取的总RNA纯度较高,没有蛋白质和DNA残留。经1%琼脂糖凝胶电泳后,18S RNA和28S RNA电泳条带清晰,5S RNA较暗,无明显降解(图1)。说明总RNA质量完好,结果合格,可以进行Real-time RT- PCR实验。
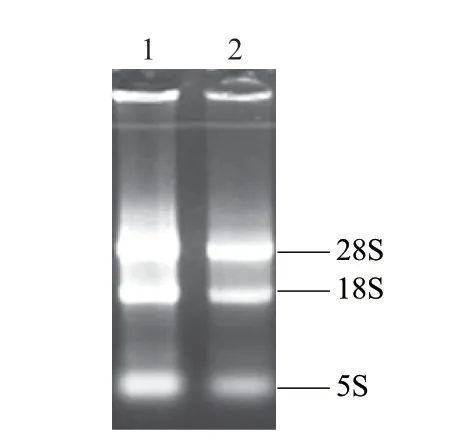
图 1 总RNA琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of total RNA
2.3.2 Real-time PCR验证
图 2 Real-time RT PCR验证的CCL2基因溶解曲线(a)和扩增曲线(b)Fig.2 Solubility(a) and amplification curves(b) of RT-PCR for CCL2 gene
本实验室此前已经通过嗜酸乳杆菌NCFM灌胃小鼠发现其能诱导免疫基因的表达。为进一步分析嗜酸乳杆菌NCFM所分泌胞外多糖对小鼠肠组织免疫相关基因表达的动态变化趋势,利用嗜酸乳杆菌NCFM胞外多糖灌胃小鼠,分别在1、4、7、10、14d处死小鼠,提取肠组织,然后采用Real Time RT-PCR方法对免疫相关基因IL18和CCL2的表达进行检测,并以管家基因GAPDH作为内参基因[7]。
图 3 Real-time RT PCR验证的IL18基因溶解曲线(a)和扩增曲线(b)Fig.3 Solubility(a) and amplification curves(b) of RT-PCR for IL18 gene
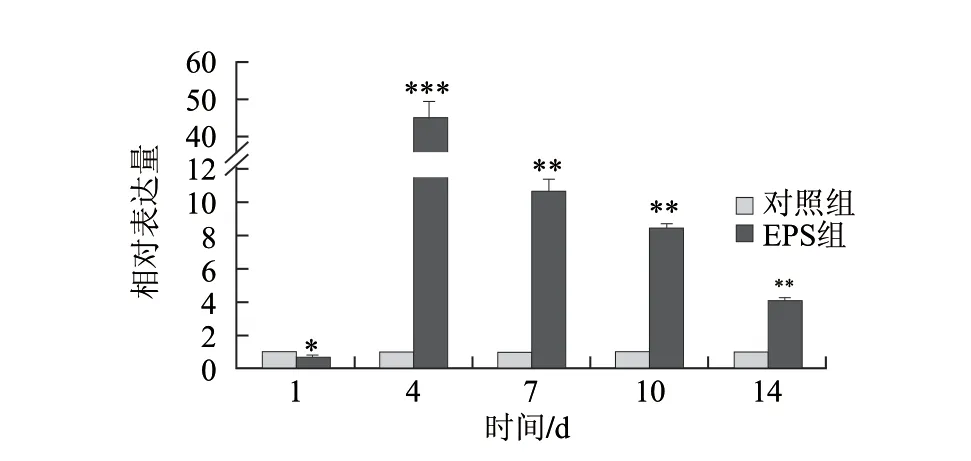
图 4 CCL2基因的相对表达量Fig.4 Relative expression of CCL2 gene
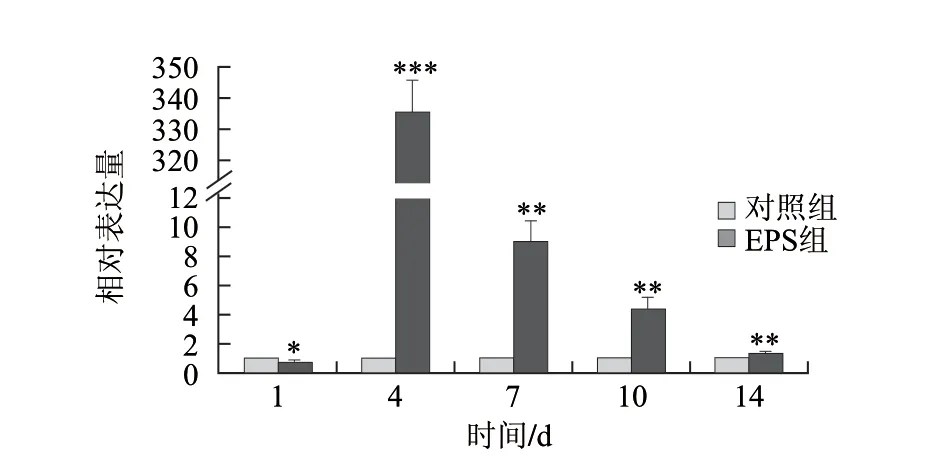
图 5 IL18基因的相对表达量Fig.5 Relative expression of IL18 gene
图2和图3是基因CCL2和IL18的Real-time RT-PCR的溶解曲线和扩增曲线。由此可知,溶解曲线单一,扩增曲线呈现标准的S型,表明扩增效果良好,所得到的数据可以用于计算。图4、5是灌胃小鼠14d,不同时间点处死小鼠,肠组织中免疫相关基因CCL2和IL18的表达量的变化情况。CCL2基因一直呈现上调表达,IL18基因除第1天下调表达外,其余时间点均呈现上调表达,且与对照组相比差异显著。随着时间的延长,CCL2和IL18基因的表达呈现出先迅速增加后减小的趋势,且均在第4天达到最大值,与对照组相比,差异极显著(P<0.001)。说明嗜酸乳杆菌NCFM胞外多糖对免疫相关基因具有明显的调控作用。
3 讨 论
目前,已有很多学者研究多糖的益生作用,发现不同的多糖具有不同的免疫调节作用,对于生理功能的发挥起到了重要作用[8]。已有大量研究表明,乳酸菌的部分生理功能与其分泌的胞外多糖紧密相关[9]。对于胞外多糖的提取方法目前比较成熟,但由于某些小分子肽类、油脂和蛋白等物质会与胞外多糖紧密结合,所以完全得到极高纯度的胞外多糖尚没有办法完成,只能制备相对纯度的胞外多糖。虽然如此,这些蛋白等杂质却并不会对胞外多糖与机体发挥免疫作用造成很大的影响,有些糖蛋白甚至会促进胞外多糖的活性[4,10-11]。实验室前期已经研究了嗜酸乳杆菌NCFM对Caco-2细胞免疫相关基因的调控,为了进一步研究嗜酸乳杆菌NCFM分泌物的重要作用,本实验围绕其所分泌的胞外多糖对小鼠肠组织的免疫相关基因的调节作用进行了研究。
白介素-18(IL-18),又称γ干扰素(IFN-γ)诱生因子,属白介素-1家族,是一种诱导IFN-γ合成的中介分子,在机体的免疫调节中起着重要的作用。它能刺激T细胞增殖,增强自然杀伤细胞活性,参与细胞因子的生成等,与白介素-12产生协同作用[10]。趋化因子是一类能够趋化细胞的迁移的小分子分泌蛋白,细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙,有些趋化因子在免疫监视过程中控制免疫细胞趋化。CCL2是趋化因子CC亚家族中的一员,能够趋化和激活T淋巴细胞和单核细胞,使免疫细胞向病变部位聚集[12],从而起到免疫调控作用。也有报道称,CCL2可以通过抑制单核细胞,同时刺激IL4的分泌,进而抑制肿瘤免疫[13]。有研究表明IL18和CCL2 mRNA水平的提高都会伴随着蛋白表达的提高,而且这些基因的表达也可以直接表明对DCs等免疫细胞具有影响。因此可以根据mRNA水平的变化间接反映蛋白水平的变化以及胞外多糖对相关免疫细胞的调节作用[14-17]。在本实验中,我们发现嗜酸乳杆菌NCFM胞外多糖可以使IL18和CCL2的表达量显著升高,也可表明胞外多糖可以使IL18和CCL2的蛋白表达量上调,验证了胞外多糖可以促进机体的免疫活性。
虽然免疫相关基因IL18和CCL2在机体免疫反应中起到非常重要的作用,但是长期的表达会对机体造成过免疫过度,导致组织受损[18-19]。从本实验的结果可知,CCL2和IL18随着实验时间的延长,表达量均趋向于未作用组的表达量(图4、5),表明嗜酸乳杆菌NCFM胞外多糖只是暂时性的诱导免疫相关基因的表达,这就使得胞外多糖既可以增强机体免疫功能,又不会引起免疫过度,造成机体损害。另外,CCL2和IL18的表达趋势虽然相似,但第4天达到最大表达量的值却相差甚远。有研究表明,免疫相关基因的表达依赖于机体免疫信号通路[20],添加信号通路抑制剂会导致免疫相关基因的表达量明显下降[21-22]。CCL2和IL18通过不同信号通路进行表达,再加上CCL2和IL18与其他细胞因子的相互作用不同,这可能是导致它们的表达量出现偏差的原因。
综上所述,嗜酸乳杆菌NCFM胞外多糖能够增强机体的免疫反应,具有一定的免疫调节作用,为今后利用这种物质开发新功能性食品提供了新的线索。
[1] PATEL A K, MICHAUD P, SINGHANIA R R. Polysaccharides from probiotics: new developments as food additives[J]. Food Technol Biotechnol, 2010, 48(4): 451-463.
[2] 牟光庆, 李霞, 李瑶喜, 等. 乳酸菌胞外多糖增强小鼠免疫功能的研究[J]. 食品科学, 2009, 30(5): 260-262.
[3] WU M H, PAN T M, WU Y J. Exopolysaccharide activities from probiotic bifidobacterium: immunomodulatory effects (on J774A.1 macrophages) and antimicrobial properties[J]. International Journal of Food Microbiology, 2010, 144: 104-110.
[4] 李伟欣, 陈倩, 李平兰, 等. 一种双歧杆菌胞外多糖免疫调节功能研究[J]. 微生物学通报, 2009, 36(6): 931-935.
[5] 邢书涵, 连正兴, 孙勇, 等. 藏灵菇源干酪乳杆菌KL1胞外多糖抑制人结肠癌细胞增殖的研究[J]. 食品科学, 2012, 33(7): 284-288.
[6] 赵圣国, 王加启, 张春刚, 等. 小鼠免疫刺激后乳腺plg rmRNA转录及乳特异性lgA含量的变化[J]. 华北农学报, 2010, 25(6): 19-24.
[7] 刘颖. 植物乳杆菌NDC75017对宿主免疫相关基因的调控及其作用机制研究[D]. 哈尔滨: 东北农业大学, 2012.
[8] FOLIGNE B, DEUTSCH S M, BRETO J. Promising Immunomodulatory effects of selected strains of dairy propionibacteria as evidenced in vitro and in vivo[J]. Applied and Environmental Microbiology, 2010, 76(24): 8259-8264.
[9] MARTA C L, BERNADETA N, MAŁGORZATA S. Immunoregulatory potential of exopolysaccharide from Lactobacillus rhamnosus KL37. Effects on the production of inflammatory mediators by mouse macrophages[J]. International Journal of Experimental Pathology, 2011, 92(12): 382-391.
[10] CHABOT S, YU H L, LÉSÉLEUC L D. Exopolysaccharides from Lactobacillus rhamnosus RW-9595M stimulate TNF, IL-6 and IL-12 in human and mouse cultured immunocompetent cells, and IFN-γ in mouse splenocytes[J]. EDP Sciences, 2001, 81: 683-697.
[11] 张利平, 陈彦, 王子尧, 等. 羊肚菌胞外多糖免疫活性研究[J]. 中国食用菌, 2009, 28(3): 47-49.
[12] 张闻宇, 黄文栋, 娄桂予. 胆汁酸G蛋白偶联受体通过p38 MAPK 通路诱导巨噬细胞IL1β、TNF-α和IL6的转录[J]. 第三军医大学学报, 2012, 34(7): 597-601.
[13] SHALLO H, PLACKETT T P, HEINRICH S A. Monocyt chemoattractant protein-1(MCP-1) and macrophage infitltration into the skin after bum injury in aged mice[J]. Burns, 2003, 29(7): 641-647.
[14] MALLAT Z, CORBAZ A, ALEXANDER Y. Scoazecexpression of interleukin-18 in human atherosclerotic plaques and relation to plaque instability[J]. Circulation, 2001, 104: 1598-1603.
[15] JAMES A H, ALEXANDRA G, JENNIFER L W. Interleukin 18 coexpression during respiratory syncytial virus infection results in enhanced disease mediated by natural killer cells[J]. J Virology, 2010, 84(4): 4073-4082.
[16] JENNIFER M L, LIANNE H, THUY T P. Coordination of early protective immunity to viral infection by regulatory T cells[J]. Science, 2008, 320: 1220-1224.
[17] KIRAN A, SCOTT P, SHOUKAT D. Role of epithelial integrinlinked kinase in promoting intestinal inflammation: effects on CCL2, fibronectin and the T cell repertoire[J]. BMC Immunology, 2011, 12: 42.
[18] HAN B, MURA M, ANDRADE C F, et al. TNF-α-induced long pentraxin PTX3 expression in human lung epithelial cells via jnk[J]. J Immunology, 2005, 175(12): 8303-8311.
[19] PEDRO A R, HOFFMANN M, SZCESNY S. Innate mechanisms for Bifi dobacterium lactis to activate transient pro-inflammatory host responses in intestinal epithelial cells after the colonization of germfree rats[J]. Immunol, 2005, 115: 441-450.
[20] HALLER D, BODE C, HAMMES W P. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures[J]. Gut, 2000, 47: 79-87.
[21] 吕学娜, 满朝新, 韩琳琳, 等. 嗜酸乳杆菌NCFM对Caco-2细胞中PTX3基因表达的影响[J]. 微生物学报, 2011, 51(4): 554-560.
[22] 张明生, 周云峰, 谢丛华, 等. 阻断细胞信号传导子和转录激活子6基因表达对人结肠癌细胞凋亡的影响[J]. 中华医学杂志, 2006, 86(2): 76-81.
