高产二十二碳六烯酸隐甲藻的选育及其发酵条件研究
2013-08-07孙中贯姚建铭朱素梅
孙中贯,刘 咏*,姚建铭,李 俊,朱素梅
(1.合肥工业大学生物与食品工程学院,安徽 合肥 230009;2.枣庄学院生命科学学院,山东 枣庄 277160;3.中国科学院等离子体物理研究所,安徽 合肥 230031;4.安徽科聚环保新能源有限公司,安徽 合肥 230031)
二十二碳六烯酸(docosahexaenoic acid,DHA),俗称脑黄金,是一种对人体非常重要的多不饱和脂肪酸(PUFA),属于Omega-3不饱和脂肪酸家族中的重要成员,是动物和人体不能自身合成,必须从外界摄入的一类必需脂肪酸[1]。DHA对于神经系统有重要的功能,具有健脑、提高记忆力和视力的作用,尤其可以促进胎儿脑细胞发育和婴幼儿脑细胞生长,防治老年性痴呆及动脉粥样硬化、脑血栓等心脑血管疾病,受到食品界和医疗界的广泛关注[2]。目前,DHA作为营养补充剂,已被运用到乳制品、食用油、藻油软胶囊、DHA冲剂等食品和营养品中。
利用隐甲藻(Crypthecodinium cohnii)ATCC30556发酵生产DHA具有发酵周期短、培养方式简单、产品质量稳定等优点,同时克服了传统的从鱼油中获取DHA受原料、气候、产地、生产周期等诸多限制因素的影响[3-4]。但原始藻种DHA产量较低,满足不了工业化生产的要求。为了进一步提高隐甲藻发酵生产DHA的能力,近年来国内外的专家学者做了大量的研究。Wang Jufang等[5]对隐甲藻ATCC30556发酵生产DHA的氮源进行优化,经优化后生物量及DHA的产量分别达到了2.98g/L、527.97mg/L。Jiang Yue等[6]研究温度对隐甲藻ATCC30556发酵的影响,发现将藻种先在25℃培养48h,然后在15℃继续培养24h,DHA的产率最高为1.47mg/(L·h)。任路静等[7]采用流加策略实现了隐甲藻ATCC30556生产DHA的高密度发酵。采用5d连续发酵多次流加策略,发酵结束后DHA含量仅为0.0641g/g干物质。荣辉等[8]利用紫外线对隐甲藻ATCC30556进行诱变处理,得到的目的藻株DHA含量与出发藻株相比仅提高了28.39%。但目前,利用隐甲藻ATCC30556发酵生产DHA的研究仍处于实验室阶段,且使用的藻种DHA含量普遍较低。本实验拟通过对超诱变剂亚硝基胍诱变及诱变后的发酵条件控制,旨在获得DHA含量高的优良藻株,并确定诱变后隐甲藻的最佳发酵条件。
1 材料与方法
1.1 菌种
隐甲藻(Crypthecodinium cohnii)ATCC30556,由武汉嘉吉烯王生物工程有限公司提供。
1.2 培养基
种子培养基:葡萄糖10g/L、酵母膏3g/L、海盐16g/L;发酵培养基:葡萄糖30g/L、酵母膏6g/L、海盐16g/L、MgSO4·7H2O 5.0g/L、KH2PO40.1g/L、KNO35g/L、VB16mg/L、VB121μg/L,采用蒸馏水定容,调整pH值为7.0。
1.3 仪器与设备
722s可见分光光度计 上海精密科学仪器有限公司;DZF-6030B真空干燥箱 东莞市豪邦工业设备有限公司;GC-14C气相色谱仪(配有氢火焰离子化检测器(FID)和N2000色谱工作站) 日本岛津公司。
1.4 菌种培养方法
液体种子培养:25℃、100r/min振荡培养72h;摇瓶发酵培养:500mL三角瓶,装液量10%,接种量10%,在25℃、120r/min条件下振荡培养240h。
1.5 诱变方法
取对数期生长的藻液分装入10mL离心管中,每管1mL。加入亚硝基胍溶液[9],使其最终质量浓度依次为250、200、150、100、50、0μg/mL,室温下处理30min后离心收集藻细胞,然后用磷酸缓冲液反复清洗3次,以除去诱变剂[10-12]。加入5mL无菌人工海水进行稀释后,取1mL接种于100mL三角瓶中,三角瓶装液量为10mL,置于往复式摇床100r/min,25℃培养,培养5d后经细胞计数测定各组的致死率。
1.6 筛选方法
大量研究[13]表明,致死率为80%左右的诱变处理有利于正突变的产生。选择此致死率条件下诱变处理后培养的藻液进行分瓶培养,30℃培养72h后取样测定培养液OD520nm值。根据测定结果选择OD520nm值较大的培养液作为种子液,进行下一轮的分瓶培养,如此反复直至测定的培养液的OD520nm值无显著差异为止。以此培养液为种子液进行发酵实验,以藻株的发酵生物量、总油脂产量及DHA产量为筛选指标,筛选出较出发藻株更优良的突变株。
1.7 分析方法
1.7.1 细胞计数取1mL藻液,加入5%冰醋酸,杀死藻细胞,于显微镜下用血球计数板计数。
1.7.2 致死率测定
参照Cafiavate等[14]的方法,将经过诱变处理培养5d后的藻细胞用血球计数板测定细胞密度。根据回归方程Y=aXb(其中Y为培养5d后的藻细胞密度,X为藻细胞的初始密度,此方程由设置不同初始密度的藻液培养5d后测定藻细胞密度,根据两者数据拟合所得)推算上述诱变处理后的活细胞密度。每个诱变处理浓度随机测3个样,取平均值,计算致死率并绘制致死曲线。

式中:X1为未诱变处理的对照藻细胞密度/(个/L);X2为诱变处理后的藻细胞密度/(个/L)。
1.7.3 生物量的测定取50mL样液装入预先称质量的离心管中,4000r/min 离心5min,沉淀用蒸馏水洗涤3次,50℃真空干燥,在干燥器内冷却后称质量,直至恒质量。
1.7.4 油脂提取
采用Soxhlet法[15]提取菌体中的总油脂。
1.7.5 油脂处理
取50mg油脂,加入1mg十七烷酸,置于100mL的磨口烧瓶中,加入0.5mol/L氢氧化钾的甲醇溶液2mL,于60℃水浴30min进行皂化,冷却后加入2mL三氟化硼-乙醚(体积比为1:1)溶液,60℃水浴10min,冷却后加入5mL正己烷振荡,然后加入5mL饱和食盐水,静置分层后取上层正己烷相,抽取上层可直接进样。
1.7.6 脂肪酸检测
气相色谱法,色谱条件为:毛细管色谱柱DB-23 (30m×0.32mm),载气为氮气。内标法定量,内标物为十七烷酸。采用程序升温,140℃保持3min,10℃/min升温,升温至250℃,保持15min。
1.8 高产藻株遗传稳定性测定
对挑选出的藻种连续传代5次,分别进行发酵实验,检测发酵生物量、总油脂产量及DHA的含量。
1.9 培养条件对目的藻株发酵的影响
1.9.1 起始pH值对目的藻株发酵的影响
配制不同pH值(5.5、6.0、6.5、7.0、7.5)的发酵培养基,作为起始培养pH值。在25℃、120r/min条件下振荡培养240h。比较起始pH值对发酵生物量、总油脂产量及DHA含量的影响。
1.9.2 培养温度对目的藻株发酵的影响
将接种的液体发酵培养基置于22、24、26、28、30℃环境中培养,在pH6.5、120r/min条件下振荡培养240h。比较温度对发酵生物量、总油脂产量及DHA含量的影响。
1.9.3 摇床转速对目的藻株发酵的影响
在pH6.5、26℃条件下振荡培养240h,调节摇床的转速分别为100、120、150、180r/min。比较摇床转速对发酵生物量、总油脂产量及DHA含量的影响。
1.9.4 培养时间对目的藻株发酵的影响
在pH6.5、26℃、120r/min的条件下,进行摇瓶发酵实验。从发酵72h开始,每隔48h测定一次发酵生物量、总油脂含量及DHA产量,直至264h发酵结束。比较不同发酵时间发酵生物量、总油脂产量及DHA含量的变化。
2 结果与分析
2.1 致死率的测定结果
采用上述诱变方法对隐甲藻ATCC30556进行诱变处理,根据回归方程Y=aXb推算处理后存活的藻细胞密度计算亚硝基胍对藻细胞的致死率,结果如图1所示。

图 1 亚硝基胍致死曲线Fig.1 Lethal curve of NTG
由图1可知,亚硝基胍的质量浓度在0~50μg/mL时,藻细胞死亡率逐渐上升至40%,当质量浓度超过50μg/mL时,曲线斜率增加明显,诱变剂量与藻细胞死亡率几乎呈线性关系。说明该藻株对质量浓度超过50μg/mL的亚硝基胍溶液较敏感,当诱变剂量由150μg/mL增至250μg/mL时,曲线斜率反而有所下降,说明该藻株对较高质量浓度的亚硝基胍溶液有一定的抵抗能力。致死率高于90%的诱变剂量会对藻细胞造成较大影响,导致藻株活力下降生长速度变慢,且负突变出现几率较大,而采用低诱变剂量时,藻细胞对诱变作用敏感性较低,突变株性状不稳定。因此,利用诱变剂进行目标性状的诱变育种时,选择合适的诱变剂量是实验成败的关键。大量研究表明,致死率为80%左右的诱变剂量有利于正突变的产生,且在此致死率下对藻株的比生长速率影响不大。因此根据致死曲线,综合考虑实验的诸多因素,选择致死率为79.4%的诱变剂量150μg/mL。
2.2 突变藻株的获得
对出发藻株进行上述诱变处理,共筛选出4株DHA含量高于出发藻株的突变株。用筛选出的4株突变藻株LS1011、LS1022、LS1042、LS1057及出发藻株在相同的发酵条件下进行摇瓶发酵实验,对各藻株发酵生物量、总油脂产量和DHA产量进行测定,复筛结果见表1。对实验结果进行比较,在初始藻细胞密度相同情况下(均为106个/mL),隐甲藻突变株LS1057 DHA含量明显高于其他3株藻株LS1011、LS1022和LS1042。因此隐甲藻突变藻株LS1057是目的藻株。
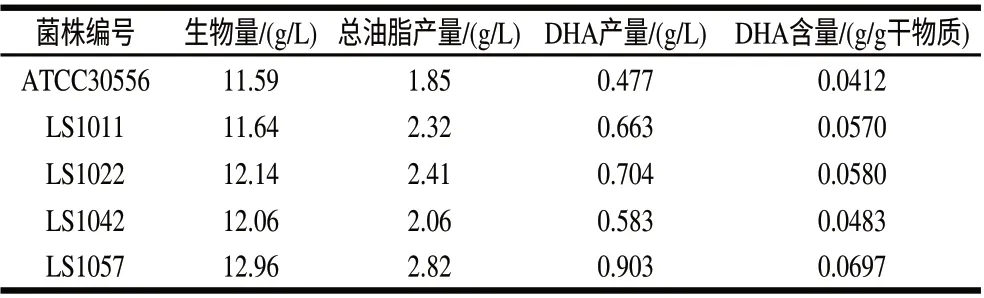
表 1 高产DHA的突变藻株Table 1 Production of docosahexaenoic acid in fermentation broth of mutant strains
2.3 高产藻株遗传稳定性实验
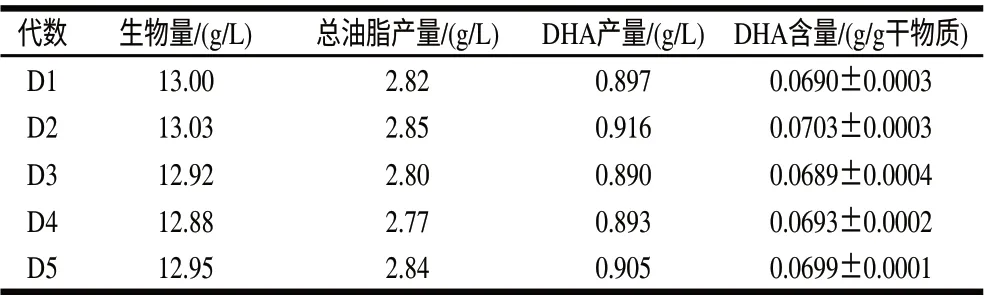
表 2 传代稳定性实验Table 2 Genetic stability of the mutant microalgae strains during subculture
作为生产菌株,其遗传稳定性对于生产具有非常重要的作用,为此将隐甲藻LS1057进行连续传代发酵培养,并测定DHA含量的变化,结果见表2。DHA的含量与传代前藻株相比无显著差异,结果表明隐甲藻LS1057具有良好的遗传稳定性,连续5次传代DHA的含量均维持在0.0697g/g干物质左右,未发生原位恢复突变等情况。
2.4 培养条件对目的藻株发酵的影响
2.4.1 起始pH值对目的藻株发酵的影响

表 3 初始pH值对隐甲藻LS1057生长及DHA产量的影响Table 3 Effect of initial pH on biomass and docosahexaenoic acid yield of C. cohnii LS1057
目的藻株在不同起始pH值培养基的生长情况,如表3所示。结果表明,突变株对培养基的起始pH有较好的适应性,既可以在弱酸性条件(pH5.5)下生长也可在弱碱性条件(pH7.5)下生长。但在偏酸性的初始条件(pH6.5)下,突变株生长情况最好,DHA的含量也是最高的。而王菊芳等[16]通过研究环境条件对隐甲藻ATCC30556生长及DHA产量的影响发现隐甲藻生长及DHA积累的最佳初始pH值为7.0,这可能是原始藻种经诱变后某些生长代谢途径发生变化的缘故。当pH值等于或大于7时,突变株在生长过程中可能会引起溶液的pH值持续升高,从而引起溶液的渗透压发生变化,导致藻细胞内外环境的渗透压平衡遭到破坏,进而对微生物的生长代谢产生抑制,严重的导致细胞死亡。以上结果表明,突变株产DHA的最佳初始pH值为6.5,过酸或过碱都会影响DHA的产量。
2.4.2 培养温度对目的藻株发酵的影响
温度是影响微生物生长繁殖的重要因素之一,温度的变化会对微生物的代谢过程产生影响,通过改变它们的生长速率,以适应温度的变化。培养温度对隐甲藻的生长繁殖以及DHA的产量都有重要的影响。培养温度高,隐甲藻代谢旺盛,生长繁殖较快,但不利于不饱和脂肪酸的积累。低温培养,隐甲藻生长速率较慢,但低温有利于不饱和脂肪酸的积累。对于不同的隐甲藻藻种,最佳的培养温度不同。

表 4 培养温度对隐甲藻LS1057生长及DHA产量的影响Table 4 Effect of culture temperature on biomass and docosahexaenoic acid yield of C. cohnii LS1057
由表4可知,培养温度越高越有利于突变株的生长繁殖因而生物量也就越高,总油脂和DHA的产量也相应升高;在温度为22~26℃的范围内,随着培养温度的升高,生物量、总油脂产量及DHA的产量逐渐增加,同时DHA的产量也逐渐升高。而在培养温度为26~30℃的范围内,随着培养温度的升高DHA的含量几乎呈直线下降,表明温度过高不利于藻体内DHA的产生和积累。这与Jiang Yue等[6]研究的温度对隐甲藻ATCC30556生长和DHA产量的影响的实验结果相一致,也进一步验证了温度对隐甲藻生长及DHA积累的影响情况。在发酵生产过程中,可采用梯度降温的方式,先将温度设为30℃,发酵一段时间后再将温度设为26℃,这将有利于提高DHA的最终产量。
2.4.3 摇床转速对目的藻株发酵的影响
摇床转速越高越有利于突变株的生长和DHA的积累,同时也表明突变株生长和积累DHA需要较高浓度的氧。但微生物对摇床转速都有一定的耐受性,转速过高可能会导致生长过程中菌体裂解,从而影响菌体的正常生长和产物的积累。

图 2 摇床转速对隐甲藻LS1057生长及DHA产量的影响Fig.2 Effect of shaking speed on biomass and docosahexaenoic acid yield of C. cohnii LS1057
由图2可知,在摇床转速为100~180r/min的范围内,培养突变株的最佳摇床转速为150r/min,与Jiang Yue等[6]的研究结果相吻合。
2.4.4 培养时间对目的藻株发酵的影响

图 3 培养时间对隐甲藻LS1057生长及DHA产量的影响Fig.3 Effect of cultivation time on biomass and docosahexaenoic acid yield of C. cohnii LS1057
由图3可知,随着时间的推移DHA产量先升高然后又下降。发酵216h时,生物量和DHA的产量达到最大,为缩短发酵周期提高发酵生产率,DHA的最佳收获时间定为216h。这与Ratledg[17]、de Swaaf[18]等以葡萄糖为碳源,研究分批补料培养隐甲藻ATCC30772生产DHA的发酵工艺,发现通过流加质量分数50%的乙酸来控制培养基的pH值,在210h时菌体生物量和DHA的积累达到最大值的研究结果相接近。
3 结 论
3.1 利用亚硝基胍作诱变剂,以隐甲藻ATCC30556为出发藻株,在150μg/mL的诱变剂量下处理30min,经过筛选得到一株高产DHA的突变藻株LS1057,且传代实验结果表明突变株遗传性状稳定。证明利用亚硝基胍诱变选育DHA高产的隐甲藻藻株是一种行之有效的方法。
3.2 采用高温摇瓶培养的方式对诱变后的藻株进行初筛,与随机挑选[8]的方式相比具有很强的针对性且增加了高产藻株筛选的概率。
3.3 在初始pH 6.5、温度26℃、转速150r/min、培养时间216h的发酵条件下,突变株的生物量达到14.06g/L,比出发藻株11.59g/L提高21.31%;总油脂产量达到3.14g/L,比出发藻株1.85g/L提高69.73%;DHA的产量达到了1.057g/L,比出发藻株0.477g/L提高121.59%;DHA的含量由出发藻株的0.0412g/g干物质提高到0.0752g/g干物质,提高了0.825倍,且发酵周期提前了24h,为利用该藻株进行DHA的大规模工业化生产提供参考。
[1] WARD O P, SINGH A. Omega-3/6 fatty acids: alternative sources of production[J]. Process Biochemistry, 2005, 40(12): 3627-3652.
[2] SIJTSMA L, de SWAAF M E. Biotechnological production and applications of the ω-3 polyunsaturated fatty acid docosahexaenoic acid[J]. Microbiol Biotechnol, 2004, 64(2): 146-153.
[3] MENDES A, REIS A, VASCONCELOS R, et al. Crypthecodinium cohnii with emphasis on DHA production: a review[J]. Journal of Applied Phycology, 2009, 21(2): 199-214.
[4] RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie, 2004, 86(11): 807-815.
[5] WANG Jufang, WU Haizhen, LIANG Shizhong, et al. Effect of nitrogen sources on the growth and docosahexaenoic acid accumulation in Crypthecodinium cohnii[J]. Marine Science Bulletin, 2002, 4(1): 87-92.
[6] JIANG Yue, CHEN Feng. Effects of temperature and temperature shift on docosahexaenoic acid production by the marine microalga Crypthecodinium cohnii[J]. Journal of the American Oil Chemist’s Society, 2000, 77(6): 613-617.
[7] 任路静, 金明杰, 纪晓俊, 等. 利用Crypthecodinium cohnii高密度发酵生产DHA的流加策略研究[J]. 食品与发酵工业, 2007, 33(1): 25-28.
[8] 荣辉. 隐甲藻藻种的选育及其发酵条件的优化[D]. 儋州: 华南热带农业大学, 2007.
[9] 张春玲. 紫外线与亚硝基胍复合诱变选育高产海藻糖菌株的研究[J]. 食品科学, 2009, 30(21): 118-191.
[10] 邹立红, 张学成. 诱变剂亚硝基胍对海洋微藻卡德藻细胞形态及生长的影响[J]. 海洋科学, 2003, 27(8): 47-51.
[11] 葛菁萍, 陈方博, 王海曼, 等. He-Ne激光和亚硝基胍复合诱变米曲霉提高其蛋白酶和淀粉酶酶活力[J]. 食品科学, 2011, 32(11): 243-247.
[12] 潘丽军, 付萍, 郑志, 等. 米根霉乙醇脱氢酶突变株的筛选及其锌镁离子的调控研究[J]. 微生物学报, 2006, 46(4): 586-590.
[13] 章明春. 工业微生物诱变育种[M]. 北京: 科学出版社, 1999: 206.
[14] CAFIAVATE J P, LUBIAN L M. Some aspects on the cryopreservation of microalgae used as food for marine species[J]. Aquaculture, 1995, 136(3/4): 277-290.
[15] 吴国锋, 李国全, 马永强. 工业发酵分析[M]. 北京: 化学工业出版社, 2006: 22-23.
[16] 王菊芳, 梁世中, 陈峰. 环境条件对隐甲藻生长及DHA产量的影响[J]. 海洋科学, 2002, 26(2): 62-65.
[17] RATLEDGE C, KANAGACHANDRAN K, ANDERSON A J, et al. Production of docosahexaenoic acid by Crypthecodinium cohnii grown in a pH-auxostat culture with acetic acid as principal carbon source[J]. Lipids, 2001, 36(11): 1241-1246.
[18] de SWAAF M E, SIJTSMA L, PRONK J T. High-cell-density fed batch cultivation of the docosahexaenoic acid producing marinealga Crypthecodinium cohnii[J]. Biotechnology and Bioengineering, 2003, 81(6): 666-672.
