大豆磷脂对大豆蛋白乳化体系的影响
2013-08-07张雅娜江连洲刘海英王中江
李 杨,王 妍,张雅娜,王 辰,王 欢,江连洲 ,刘海英,冯 丹,王中江
( 东北农业大学食品学院,黑龙江哈尔滨150030)
大豆分离蛋白不仅具有较高的营养价值,还表现出良好的加工特性,如乳化性、凝胶性、溶解性、起泡性等,这些加工特性在食品加工中起着重要作用[1]。蛋白质的乳化性是大豆蛋白的一个非常重要的物理性质,其既能降低水和油的表面张力,又能降低水和空气的表面张力,因此易于形成稳定的乳化液[2]。大豆磷脂是一种天然食品添加剂,在烘焙食品、糖果、人造奶油、速溶食品及面制品中得到广泛应用。磷脂添加于食品中,不仅起乳化、润湿、起酥、防止老化及抗氧化作用,而且还能与谷物淀粉、蛋白质相结合,改善食品的质地结构,对食品起营养强化作用。由于大豆蛋白质与磷脂均具有良好的乳化性能,使传统豆制品如豆腐、豆奶、豆浆等在加工中极易形成乳化体系,乳化体系界面特征直接关系到产品口感、货架期、应用等。研究表明大豆蛋白质与磷脂之间存在交互作用,这种交互作用对乳化体系结构有一定影响[3],而目前关于蛋白质与磷脂的交互作用机理尚不清楚,进而限制后续关于大豆蛋白-磷脂共建乳化体系的研究,致使乳化体系在传统豆制品加工及贮藏中难以调控。目前某些企业和小作坊违法使用劣质乳化剂、超量使用食品乳化剂的现象屡有发生,这些都使豆制品的质量安全存在较大隐患。大豆蛋白、磷脂作为安全、无毒副作用并具有治疗与保健功能的天然食品乳化剂日益受到青睐。目前市场上兴起的卵磷脂豆奶、磷脂馒头、大豆磷脂冰激凌等备受消费者喜爱,蛋白质及磷脂的加入不仅增强食品营养性,而且提高食品乳化体系的稳定性,因此,对解决传统豆制品中乳化问题有重要意义。本实验从大豆分离蛋白主要组分入手,分离纯化出大豆分离蛋白及其主要组分7S 及11S 球蛋白,考察磷脂的加入对三种球蛋白形成乳状液的影响,并探讨了相关作用机理,为研究大豆蛋白与磷脂交互作用对乳化体系形成的影响机制提供理论依据。
1 材料与方法
1.1 材料与仪器
脱脂豆粕 哈高科;大豆磷脂 深圳康之源生物有限公司;金龙鱼大豆调和油 超市购买;SDS、磷酸盐 分析纯。
pHS-25 型酸度计 上海伟业仪器厂;电子分析天平 梅勒特-托利多仪器(上海)有限公司;T18 basic 高速乳化均质机 英国IKA 公司;722S 分光光度计 上海精密科学仪器有限公司;微量取样器上海荣泰生化工程有限公司;磁力搅拌器、机械搅拌器 广州仪科实验仪器有限公司;流变仪 英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白的制备 采用Molina Ortiz 等的方法[4]。脱脂大豆粉→搅拌( 料液比1 ∶20,提取时间2h,25℃) →离心→上清液(2mol/L HCl 调至pH 4.5 在4℃静置2h) →离心20min(400 ×g) →沉淀( 复溶于5 倍蒸馏水) →冷冻干燥→SPI
1.2.2 7S 和11S 的提取 7S 和11S 的提取参考Nagano 的实验方法[10]。脱脂豆粉→提取(15 倍水,2mol/L NaoH 调pH7.5,室温提取1h) →离心(9000 ×g 20min) →上清液→加NaHSO3,2mol/L HCl 调至pH6.4,4℃过夜→离心(6500 ×g,20min,4℃) →沉淀(11S) →上清液→用NaCl 调离子浓度0.25mol/L,2mol/L HCl 调pH 至5.0,静置1h→离心9000 ×g,30min,4℃) →上清液→用水稀释两倍,2mol/L HCl调至pH4.8→离心(6500 ×g,20min,4℃) →沉淀(7S)
1.2.3 7S/11S 的确定 采用不连续十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法[5],浓缩胶和分离胶中SDS 浓度为0.1%、过硫酸铵浓度为0.075%、四甲基乙二胺(TEMED)浓度为0.075%,聚丙烯酰胺浓度分别为2.5%和10%,浓缩胶中缓冲液浓度为0.125 mol/L Tris-HCl(pH6.8),分离胶中缓冲液浓度为0.375mol/L Tris-HCl(pH8.8),贮液槽中缓冲液浓度为0.025mol/L Tris-HCl/0.192mol/L 甘氨酸(pH8.3)。用0.0625mol/L Tris-HCl(pH6.8)样品缓冲液(该缓冲液同时含有2%SDS、5% 2-巯基乙醇、10%甘油、0.002%溴酚蓝)溶解一定量分离蛋白粉,配成浓度为1mg/mL 的溶液。超声波水浴处理45min,在沸水中加热3min。点样量为15μL,稳压电压50V 进行电泳。电泳结束后,进行固定、染色、脱色。电泳谱图采用CS910 型薄层扫描仪进行扫描后,用ScionImage 软件进行处理分析。
1.2.4 乳状液的制备 精确称取1g 样品,溶解于100mL 0.1mol/L 磷酸钠缓冲溶液中,室温下1000r/min搅拌1h 制备蛋白溶液,取0.1g 磷脂溶解于大豆油中,室温下1000r/min 搅拌1h。取15mL 搅拌均匀的蛋白溶液与5mL 溶有磷脂的大豆油混合,在高速乳化均质机下13500r/min 乳化2min 后倒入25mL 烧杯中。
1.2.5 乳状液Zeta 的测定 根据CRUDDEN 的测定方法[6]。用pH7 的磷酸缓冲液将乳状液稀释至蛋白浓度0.125mg/mL,用Zeta 电位分析仪测定乳状液的Zeta 电位。
1.2.6 粒径的测定 采用Malvern 激光粒度分析仪测定粒度分布,测定温度25℃。
1.2.7 乳状液黏度的测定 采用Bohlin-CVO 流变仪,4/40 椎板,测定温度25℃,剪切速率0.01 ~100s-1,测定表观粘度。
1.2.8 表面疏水性的测定 参考KATO 等人的测定方法[7]。用浓度为0.01mol/L(pH 为7)的磷酸缓冲液将乳状液稀释,使蛋白质量分数为0.0125%,取3mL 稀释后的乳状液,加入60μL ANS(浓度为8mmol/L)荧光探针,混匀,避光1min,于荧光分光光度计下比色测定荧光强度,激发波长390nm,发射波长470nm。
1.2.9 数据分析 乳液均质后立即进行各指标测定,所有数据均进行三组平行样测定。
2 结果与讨论
2.1 凝胶电泳图谱分析
大豆7S、11S 球蛋白及SPI 凝胶电泳图谱见图1。通过对SDS- PAGE 谱图中的谱带进行Scion Image 扫描分析,7S 的纯度达到78.2%,11S 的纯度达到88.7%。
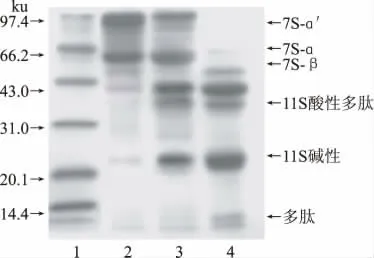
图1 7S、11S 球蛋白及SPI 电泳图谱Fig.1 SDS-polyacrylamide gel electrophoresis of 7S,11S globulin and SPI fractions
2.2 粒径分析
乳化体系形成后,乳化剂吸附在油水界面,稳定液滴使其不发生聚集,通过峰变化范围及峰面积观察乳液中液滴大小分布情况。从图2 可以看出,乳液出现双峰现象,Brygida 研究牛乳蛋白乳液时也发现双峰现象,指出第一个峰为连续相中蛋白的粒径分布峰[8]。蛋白乳液加入磷脂后,第一个峰面积均变大,第一个峰说明在乳化层界面磷脂与蛋白发生了相互作用,而使乳化层中的一部分蛋白被磷脂取代而进入连续相水相中,Dickinson 的研究也发现磷脂的加入减少乳化层蛋白量[9]。蛋白乳液加入磷脂后三种乳液平均粒径均变小,可能是磷脂的加入提高了蛋白的乳化性,高乳化性促进乳液小液滴的生成。7S 乳液粒径分布变化最明显,说明磷脂与7S 作用最强。
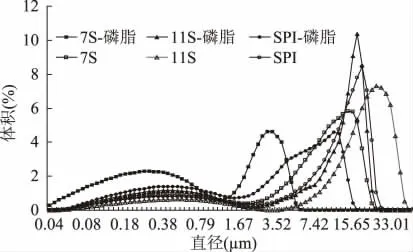
图2 乳液添加磷脂前后的粒径分布Fig.2 The particle size distribution of soybean protein emulsions before and after adding lecithin
2.3 乳液粘度的测定
由图3 可看出,大豆蛋白乳液在剪切速率0~1s-1的范围内,乳液的黏度随着剪切速率的增加而降低,表现为剪切变稀,呈现假塑性流体特性。然而在高剪切速率下,由于聚集液滴被打破,黏度下降,出现牛顿流体性质。添加磷脂后,乳液粘度下降,三种乳液黏度下降幅度相近,黏度下降可能是添加磷脂后,乳化性粒径变小,根据Dougherty-Krieger 公式,由于液滴聚集产生大液滴增加了剪切黏度。
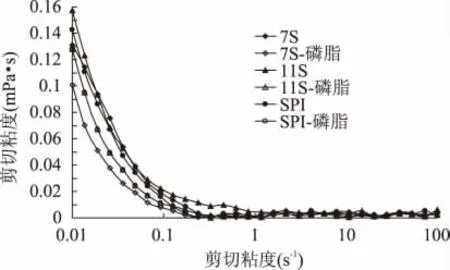
图3 乳液添加磷脂前后的黏度曲线Fig.3 The flow curves of soybean protein emulsions before and after adding lecithin
2.4 乳液Zeta 的测定
由图4 可看出,未添加磷脂的对照乳液Zeta 值均在-10~-13 之间,添加磷脂后,乳液的负Zeta 电位增加,均在-12~-16 之间,相差较小。7S 乳液的Zeta电位增加最大,SPI 乳液的Zeta 电位增加最小。说明添加磷脂后能增加乳状液的负Zeta 电位,使蛋白颗粒之间的斥力增大,从而提高乳液的稳定性,研究也表明7S-磷脂乳液的稳定性最好[10]。磷脂能增加乳液的负Zeta 电位可能是磷脂与蛋白发生疏水相互作用,使蛋白结构改变,从而引起Zeta 电位的改变。
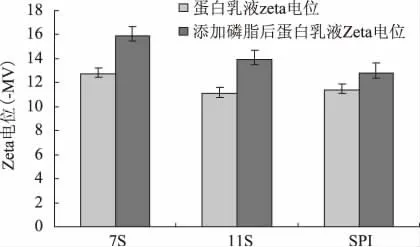
图4 乳液添加磷脂前后的Zeta 电位Fig.4 The zeta potential of soybean protein emulsions before and after adding lecithin
2.5 表面疏水性的测定
一般来说,多数构成蛋白质的非极性氨基酸侧链分布在分子内部形成疏水内核,而极性氨基酸分布在表面的亲水环境中。对于一些已知结构的蛋白质表面性质的分析表明,一些疏水基团也会出现在蛋白质表面,使蛋白质表面也具有一定的疏水性。ANS 法测定表面疏水性的原理是ANS 荧光团与蛋白质的表面疏水区域结合,通过测定结合前后的荧光变化计算蛋白质的表面疏水性[11]。Ohtsuru 曾研究发现磷脂在蛋白疏水区与其作用,磷脂与蛋白有疏水作用发生[12],为了研究大豆磷脂对不同球蛋白表面疏水性的影响,测定添加磷脂前后乳液的表面疏水性,结果如图5 所示。由图5 可看出,当添加磷脂后,三种乳液的疏水性均下降。
大豆球蛋白分子中含有的非极性氨基酸残基可以和其他疏水物质相互作用,如与油-水界面的作用。磷脂能降低球蛋白的表面疏水性,可能是由于具有较强疏水性的磷脂与球蛋白发生疏水相互作用使蛋白质的构象发生改变,降低了疏水基团的暴露,荧光探针结合不到疏水部位。在表面疏水性的测定中可看出7S 与磷脂作用前后表面疏水性降低的最多,这与粒径测定结果相一致,都说明了磷脂与7S作用强度最大。
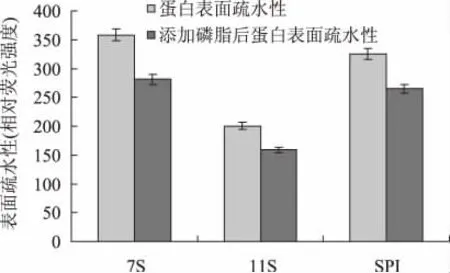
图5 添加磷脂前后乳状液表面疏水性Fig.5 The surface hydrophobicity of soybean protein emulsions before and after adding lecithin
3 结论
磷脂与球蛋白有疏水作用发生,这种相互作用导致球蛋白构象发生一定改变,影响其功能性,进而改变乳液性质。添加大豆磷脂降低了蛋白乳状液的粒径,使乳状液体系更加均一稳定;三种蛋白乳液添加磷脂后黏度变小,Zeta 电位变大。磷脂与7S 球蛋白作用强度大于11S。本课题建立大豆蛋白-磷脂复合乳化体系,从大豆分离蛋白主要组分7S、11S 入手,研究了磷脂与SPI 主要组分作用机制及作用强度,为进一步更好阐明磷脂对大豆分离蛋白乳化体系影响提供理论基础,为生产加工中大豆分离蛋白种类的选择提供理论指导。
[1]Renkema JMS,Gruppen H,van Vliet T.Influence of ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their proteins compositions[J].Journal of Agricultural and Food Chemistry,2002,50:6064-6071.
[2]Rodriguez PJM,Molina OSE,Carrera SC,et al.Dynamic properties of soy globulin adsorbed films at the air-water interface[J].Journal of Colloid and Interface Science,2003,268:50-57.
[3]Catharina H,McCrae.Heat stability of milk emulsions:phospholipid-protein interactions[J].International Dairy Journal,1999,9(3) :227-231.
[4]Molina Ortiz S E,Puppo M C,Wagner J R.Relationship between structural changes and functional properties of soybean protein isolates- carrageenan systems[J].Food Hydrocolloids,2004,18:1045-1053.
[5]B D.哈密斯.蛋白质的凝胶电泳实践方法[M].科学出版社,1994.
[6]Crudden A.Effect of hydrolysis of casein by plasmin on the heat stability of milk[J].International Dairy Journal,2005,15:1017-1025.
[7]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J].Biochimica of Biophysica Acta,1980,624:13.
[8]Brygida E.Properties of milk protein concentrate stabilized oil-in-water emulsions[J].Journal of Food Engineering,2008,88:507-513.
[9]Dickinson E,Golding M.Rheology of sodium caseinate stabilized oil-in- water emulsions[J].Journal of Colloid and Interface Science,1997,191:166-176.
[10]王妍,李杨.水相组分差异对大豆蛋白-磷脂复合乳化体系的影响[J].食品工业科技,2013(4) :122-124.
[11]张涛,江波,王璋.鹰嘴豆分离蛋白质的特性[J].食品与生物技术学报,2005,24(3) :66-71.
[12]Ohtsuru M,Kito M.Association of phosphatidylcholine with soybean 11S globulin[J].Agricultural and Biological Chemistry,1983,47:1907-1908.
