热打击致大鼠肠上皮IEC-6细胞钙超载损伤的初步研究
2013-08-07耿焱刘亚楠付炜彭娜潘志国雷玉梅苏磊
耿焱,刘亚楠,付炜,彭娜,潘志国,雷玉梅,苏磊
·基础研究·
热打击致大鼠肠上皮IEC-6细胞钙超载损伤的初步研究
耿焱,刘亚楠,付炜,彭娜,潘志国,雷玉梅,苏磊
目的研究不同程度热打击对体外培养大鼠肠黏膜上皮细胞IEC-6的钙超载及钙超载相关的损伤。方法设置培养IEC-6细胞的温度梯度,Fluo-3Am探针加荧光显微镜及流式细胞术观察细胞内钙离子水平的改变,相差显微镜观察细胞形态学改变,考马斯亮蓝染色法观察细胞骨架变化,CCK-8法观察细胞活性改变,黏附实验观察基底膜黏附性改变。结果与正常对照组比较,热打击组细胞内钙水平上升(P<0.01),呈温度依赖性。热打击组细胞形态变圆,伪足变短,细胞间隙增大,45℃较43℃改变更为明显。考马斯亮蓝染色显示,热打击组细胞骨架增粗、紊乱,出现应力性纤维,45℃较43℃改变更为明显。CCK-8法显示,热打击组细胞活性下降(P<0.01),呈温度依赖性。基底膜黏附实验显示,热打击组基底膜黏附性显著下降(P<0.01),呈温度依赖性。结论热打击可造成IEC-6细胞钙超载,并造成与钙超载相关的一系列细胞损伤,热打击对于肠黏膜上皮钙超载的影响及其机制的进一步研究将有助于了解热射病的发病机制。
热打击;肠黏膜;细胞黏附;细胞骨架
脂多糖(lipopolysaccharide,LPS)又称内毒素,热射病患者血浆中LPS浓度远高于其常规致死浓度(1ng/m l)[1]。肠道是体内最大的“储菌库”和“内毒素库”,正常情况下,肠黏膜上皮细胞具有屏障作用,可防止肠道内细菌和内毒素侵入血液循环[2]。已有直接证据表明,热应激及高强度运动可增加肠道黏膜通透性,促进内毒素进入血液循环,导致内毒素血症,触发热射病[3-4]。然而,热射病条件下肠道黏膜通透性增高的机制目前尚不清楚。基于此,本研究模拟热射病情况下肠黏膜上皮细胞所处的病理环境,研究热打击对肠黏膜上皮细胞内钙离子含量的影响,以及与钙超载相联系的细胞形态、活性、骨架及基底膜黏附性变化,为进一步研究热打击条件下肠黏膜上皮细胞病变在肠道细菌和内毒素移位中的作用机制提供实验依据和理论基础。
1 材料与方法
1.1主要材料及试剂 大鼠肠黏膜上皮细胞株IEC-6为南方医科大学中医药学实验室提供,钙离子浓度检测试剂Fluo-3Am探针购自美国ENZO公司,CCK-8试剂盒购自日本同仁公司,人工基底膜matrigel购自美国BD公司。
1.2方法
1.2.1细胞培养 IEC-6细胞复苏后,1000r/min离心10min,弃上清,用高糖DMEM培养液(含10%胎牛血清,10万U/L青霉素、100mg/L链霉素)混匀细胞,转入25m l玻璃培养瓶中,在37℃、5%CO2浓度及饱和湿度条件下培养,次日换液,以后根据细胞生长情况每48~72h更换培养液1次,每周传代1~2次。
1.2.2实验分组及检测指标 细胞按热打击处理方式分为3组,分别为:对照组(将细胞置于标准37℃、5%CO 2浓度培养箱中同其余各组等时间培养),43℃热打击组(将细胞置于43℃细胞培养箱中培养30m in),45℃热打击组(将细胞置于45℃细胞培养箱中培养30m in)。热打击结束后,进行下述指标的检测。
1.2.3细胞内钙离子水平检测 各组按实验设计给予相应刺激后,更换无血清高糖DMEM培养液,加入fluo-3Am探针(浓度1μmol/L),置于标准37℃、5%CO2浓度培养箱中避光孵育60m in进行荧光探针装载,分别进行荧光显微镜和流式细胞仪检测荧光强度,代表细胞内钙离子水平。荧光显微镜检查方法:用D-Hank's液漂洗3次,再加入适量D-Hank's液,避光孵育15m in;确定Fluo-3Am在细胞内完全转变成Fluo-3后进行荧光显微镜检测。流式细胞仪检测方法:弃上清,用2.5g/L胰蛋白酶消化贴壁细胞后,用D-Hank's液制备成单细胞悬液,进行流式细胞仪检测。每个独立实验均重复3次。
1.2.4CCK-8法检测细胞活性 取对数生长期细胞,按5×105个/孔铺入可拆卸96孔板,培养24h后,更换无血清高糖DMEM(100μl/孔)培养过夜,按实验分组进行相应刺激,每组设4个复孔。刺激完毕,更换培养上清为无血清高糖DMEM(90μl/孔),加入10μl CCK-8,置于标准37℃、5%CO2浓度培养箱中孵育2h,用酶联免疫检测仪在450nm处读取光密度(A)值,计算细胞活性,细胞活性=实验组A值/对照组A值×100%。每个独立实验均重复3次。
1.2.5细胞基底膜黏附实验 1×PBS配制10μg/m l matrigel溶液,于96孔板中每孔加入75μl,置37℃铺板1h;1×PBS配制10g/L BSA,煮沸13min变性,每孔加100μl封闭1h;用1×PBS冲洗2次。取对数生长期细胞,无血清高糖DMEM培养过夜,按实验分组进行相应刺激;用2.5g/L胰蛋白酶消化细胞,1×PBS洗涤,800r/m in离心5m in沉淀,弃上清;将细胞重悬于含氯化钙1mmol/L、氯化镁1mmol/L、氯化锰0.2mmol/L及5g/L BSA的高糖DMEM中,调整细胞浓度为1×108/L;按100μl/孔加入细胞悬液,每组设4个复孔,37℃温育1h。取出96孔板,1×PBS冲洗3次;每孔加入90μl无血清高糖DMEM和10μl CCK-8,置于37℃、5%CO2浓度培养箱中孵育2h;采用酶联免疫检测仪读取450nm处A值,代表每孔的细胞数。每个独立实验均重复3次。
1.2.6细胞骨架染色 细胞占爬片面积40%时,按分组给予相应刺激,弃上清,1×PBS冲洗2次;1.5% TritonX-100震荡洗涤,8m in×3次;M缓冲液(含60mmol/L咪唑、50mmol/L KCl、0.5mmol/L MgCl2、1mmol/L EGTA、0.1mmol/L EDTA、lmmol/ L巯基乙醇,pH 7.2)震荡洗涤,4min×3次;3%戊二醛固定10m in;M缓冲液清洗,3m in×3次;0.2%考马斯亮蓝R250染色40m in;ddH2O充分洗涤,烤干脱水;二甲苯透明,5m in×2次;中性树胶封固,加盖玻片封固,置于1000倍高倍镜下观察。
1.3统计学处理 采用SPSS 13.0软件包进行统计学分析。计量资料以表示,在方差齐性基础上应用单因素方差分析(one-way ANOVA),组间进一步两两比较采用LSD-t法进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1热打击对IEC-6细胞内钙离子含量的影响 梯度热打击后,装载钙离子探针Fluo-3Am,荧光显微镜观察显示,从对照组、43℃热打击组到45℃热打击组,荧光强度逐渐增强,表明细胞内钙离子浓度逐渐升高(图1A)。流式细胞仪检测结果显示,对照组Fluo-3荧光强度为1.75±0.21,43℃热打击组为2.02±0.34,45℃热打击组为2.75±0.52(图1B,P<0.01),即热打击可导致IEC-6细胞内钙离子水平升高,且呈温度依赖性。
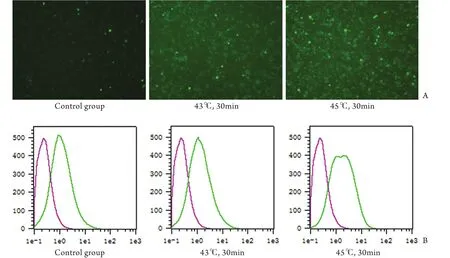
图1 梯度热打击对IEC-6细胞内钙含量的影响Fig.1 Effect of gradient heat stress on intracellular Ca2+ concentration of IEC-6 cells
2.2热打击对IEC-6细胞形态及活性的影响 光镜下观察,与对照组相比,43℃和45℃热打击30m in均可使细胞轮廓变圆,伪足变短,细胞间隙增大,以45℃最为明显(图2A)。CCK-8试验显示,与对照组对比,热打击组IEC-6细胞活性均显著下降(P<0.01),同时,45℃组细胞活性较43℃组显著下降(图2C,P<0.01)。
2.3热打击对IEC-6细胞骨架的影响 不同程度热打击后,相差显微镜高倍镜(1000×)下可见,对照组细胞骨架分布均匀,热打击后细胞骨架发生重组,细胞周边骨架减少,细胞内出现应力纤维,细胞骨架增粗、紊乱,排列呈明显的非极性单向分布,45℃热打击组上述现象更为明显(图2B)。
2.4热打击对IEC-6细胞基底膜黏附性的影响 如图2D所示,与对照组相比,43℃和45℃热打击组细胞基底膜黏附性均显著下降(P<0.01),与43℃比较,45℃热打击组细胞基底膜黏附性下降更为明显(P<0.01)。
3 讨 论
热射病是一种继发于热损伤后的系统性炎症反应综合征(system ic inflammatory response syndrome,SIRS),进而发展为脓毒症(sepsis),引发多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的过程[5-6],目前认为肠黏膜的通透性增高在此过程中起重要作用。肠黏膜通透性增高会导致大量LPS进入门脉循环,超过肝脏及免疫系统的清除能力而进入体循环,产生内毒素血症,导致急性炎症性反应,进而引起坏死、弥散性血管内凝血(DIC)、MODS以及其他常见的热射病症状[7]。
肠道是MODS的枢纽器官,是炎症介质的扩增器[8]。肠黏膜屏障主要由机械性屏障、生物学屏障和免疫屏障组成,其中最重要的是机械性屏障,其结构基础是肠上皮细胞的完整性及其相邻肠上皮细胞间的连接[9]。肠上皮细胞需黏附于细胞外基质才能生长,称为锚着依赖型细胞。如果细胞从黏附的基质处脱落即会激活自杀性程序,破坏肠黏膜屏障的完整性[10]。正常情况下,完整的上皮细胞和基底膜间的黏附结构为基底膜-整合素-细胞骨架[11]。细胞内钙超载是整合素改变的始动因素,钙通道阻断剂可以抑制整合素的分布变化[12]。细胞骨架蛋白是钙超载的主要作用靶点,已有大量研究证实钙超载可导致细胞骨架破坏,而细胞骨架蛋白在细胞黏附中发挥着重要作用,细胞骨架结构的破坏可以影响整合素的分布、表达及信号传导,并导致细胞黏附性减弱,引起细胞脱落,破坏肠黏膜屏障的完整性,促进肠道细菌和内毒素移位[13]。目前已有较多关于在缺血缺氧等情况下肠上皮细胞发生钙超载,以及钙超载对于肠上皮细胞损伤的研究报道,但对于热射病条件下肠黏膜上皮细胞内钙含量的变化,及其与肠上皮细胞损伤的关系,尚无切实可靠的实验依据。

图2 热打击对IEC-6细胞的损伤Fig.2 Impairment of IEC-6 cells by heat stress
根据本研究结果,热打击可以导致IEC-6细胞内钙超载,且呈温度依赖性。与IEC-6细胞内钙超载水平相对应的,IEC-6细胞形态和活性也发生改变,表现为细胞轮廓变圆,伪足变短、变粗,细胞间隙变大,细胞活性下降,钙超载水平高的IEC-6细胞,上述形态改变更为明显。热打击对于IEC-6细胞骨架和基底膜黏附性影响的实验结果也有类似现象,钙超载水平高的IEC-6细胞,其细胞骨架改变更为明显,表现为细胞骨架增粗、紊乱,细胞周边骨架减少,应力纤维出现,同时基底膜黏附性更低。目前对于钙超载引起细胞骨架改变的机制还不是十分清楚,Kuhne等[14]报道钙超载可以通过激活gelsolin对内皮细胞肌动蛋白产生切割破坏,而Kulkami等[15]报道细胞内钙超载可以通过激活calpain水解F-actin及talin、α-actin等结合蛋白。IEC-6细胞钙超载水平与细胞形态、活性、细胞骨架及基底膜黏附性改变的对应关系的存在,也从另一个侧面证明了在热打击条件下,IEC-6细胞内钙超载的存在。目前对于热打击导致细胞钙超载的机制尚不清楚,有研究认为可能是钙离子通道及细胞膜通透性所致,但具体机制仍需进一步探索研究。
综上所述,本实验结果初步证明,热打击可以造成肠黏膜上皮细胞钙超载,并呈温度依赖性,在细胞内钙超载的同时,细胞形态、活力、细胞骨架和基底膜黏附性均发生了相应改变,这为理解热射病发生发展过程中,肠黏膜屏障通透性增加,进而引发肠道细菌和内毒素移位的作用机制提供了直观的实验依据,对其机制的进一步研究,将有助于了解热射病发生及发展的机制。
[1] Camus G, Deby-Dupont G, Duchateau J,etal. Are sim ilar in flammatory factors invo lved in strenuous exercise and sepsis[J]? Intensive Care Med, 1994, 20(8): 602-610.
[2] Bouchama A, Parhar RS, el-Yazigi A,etal. Endotoxem ia andrelease of tumor necrosis factor and interleukin 1 alpha in acute heatstroke[J]. J Appl Physiol, 1991, 70(6): 2640-2644.
[3] Shi XP, Gao YJ. Immunological function of intestinal mucosa epithelial cells[J]. Inter J Immuno, 1999,4(2): 203-206. [石辛甫, 高杰英. 肠黏膜上皮细胞的免疫学功能[J]. 国外医学免疫学分册, 1999, 4(2): 203-206.]
[4] Liu H, Song Q, Zhou FH. Application of m ild hypotherm ia in the treatment of exertion heat stroke[J]. Med J Chin PLA, 2010, 35(9): 1148-1150. [刘辉, 宋青, 周飞虎, 等. 亚低温在劳力型热射病治疗中的应用[J]. 解放军医学杂志, 2010, 35(9): 1148-1150.]
[5] Huisse MG, Pease S, Hurtado-Nedelec M,etal. Leukocyte activation: the link between in flammation and coagulation during heatstroke. A study of patients during the 2003 heat wave in Paris[J]. Crit Care Med, 2008, 36(8): 2288-2295.
[6] Ji J, Song Q, Yue H,etal. The protective role of Xuebijing injection to heat stroke in rats[J]. Med J Chin PLA, 2011, 36(6): 578-581. [纪筠, 宋青, 岳慧, 等. 血必净注射液对热射病大鼠保护机制的研究[J]. 解放军医学杂志, 2011, 36(6): 578-581.]
[7] Leon LR, Blaha MD, Dubose DA. Time course of cytokine, corticosterone, and tissue injury responses in m ice during heat strain recovery[J]. J Appl Physiol, 2006, 100(4): 1400-1409.
[8] O lden KW. D iagnosis of irritab le bowel synd rom e[J]. Gastroenterology, 2002, 122(6): 1701-1714.
[9] Dong J, Zhang SW, Wang BE. Intestinal dysfunction and multiple organ dysfunction synd rom e[J]. Chi Cri Car Med, 2005, 17(12): 764-767. [董军, 张淑文, 王宝恩. 肠功能障碍与多器官功能障碍综合征[J]. 中国危重病急救医学, 2005, 17(12): 764-767.]
[10] Qin HL, Gao Q. Protective effect of glutam ine on the intestinal mucosal antioxidation in endotoxem ic rats[J]. Chin J Bases Clin General Surg, 2001, 8(1): 5-7. [秦环龙, 高奇. 谷氨酰胺对内毒素血症大鼠小肠粘膜抗氧化损伤的保护作用[J]. 中国普外基础与临床杂志, 2001, 8(1): 5-7.]
[11] Nishihaha H, Kizaka-Kondoh S, Insel PA,etal. Inhibition of apoptosis in normal and transformed intestinal epithelial cells by cAMP through induction of inhibitor of apoptosis protein (IAP)-2[J]. Proc Natl Acad Sci, 2003, 100(15): 8921-8926.
[12] Liu YW, Sanders MA, Basson MD. Loss of matrix-dependent cytoskeletal tyrosine kinase signals may regulate intestinal epithelial differentiation during mucosal healing[J]. Gastrointest Surg, 1999, 3(1): 82-94.
[13] Chen Q, Q in HL. In fluence of ischem ia and anoxia on distribution and po larity of integrin in intestine epithelial cells[J]. World Chin J Digestol, 2005, 13(40): 456-459. [陈前,秦环龙. 缺血缺氧损伤对肠上皮细胞整合素极性及细胞凋亡的影响[J]. 世界华人消化杂志, 2005, 13(4): 456-459.]
[14] Kuhne W, Besselmann M, No ll T,etal. D isintegration of cytoskeletal structure of actin filaments in energy-depleted endothelial cells[J]. Am J Physiol, 1993, 264(5): 1599-1608.
[15] Kulkarni S, Goll DE, Fox JE. Calpain cleaves RhoiA generation a dom inant-negative form that inhibits integrin-induced actin filament assembly and cell spreading[J]. J Biol Chem, 2002, 277(27): 24435-24441.
Calcium overload injury of rats’ enterocy te IEC-6 by heat stress in vitro
GENG Yan1, LIU Ya-nan2, FU Wei2, PENG Na1, PAN Zhi-guo1, LEI Yu-mei3, SU Lei1*
1Department of ICU, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
2Postgraduate School of Nanfang Medical University, Guangzhou 510515, China
3Department of Emergency, 157 Hospital of PLA, Affiliated Hospital of Guangzhou General Hospital of Guangzhou Command,Guangzhou 510515, China
*
, E-mail: gytools@sina.com
This work was supported by the National Natural Science Foundation of China (81071529, 81101406), and Postdoctoral Foundationof China (2012M512181)
ObjectiveTo investigate the effect of gradient heat stress on calcium overload of rats' enterocyte IEC-6 and calcium overload-related cell injuryinvitro.MethodsThermal gradient was set in culturing IEC-6 cellsinvitro. After thermal stimulation, Fluo-3Am probe with fluorescence microscope or flow cytometry was used to detect the change in intracellular Ca2+concentration of IEC-6 cells. Phase contrast microscope was used to observe the morphological change in IEC-6. Coomassie blue dying method was employed to test the change in IEC-6 cytoskeleton. CCK-8 assay was used to assess cellular viability. Adhesion assay was applied to test the change in basilar membrane adhesiveness of IEC-6 cells.ResultsCompared with normal control group, cells of heat stress groups showed a thermal-dependent increase in intracellular Ca2+concentration (P<0.01). Cells of heat stress groups were rounded in shape, the pseudopod was shorter, and cell space was enlarged. These phenomena were more obvious in 45℃ culture than in that of 43℃. Coomassie blue dying showed that the cytoskeleton of cells in heat stress groups became thickened and disordered, and stress fibers appeared. These phenomena were also more obvious in 45℃ culture than in that of 43℃. A thermal-dependant decline of cell viability in heat stress groups was observedviaCCK-8 assay (P<0.01), and a thermal-dependant decline of basilar membrane adhesiveness in heat stress groups was observedviaadhesion assay (P<0.01).ConclusionHeat stress may cause calcium overload of IEC-6 cells, and thus resulting in a series of calcium overload-related cell injury. Further investigation of the effect and mechanism of heat stress on calcium overload of intestinal mucosa endothelial cells may help further understand the mechanism of the pathogenesis of heat stroke.
heat stress; intestinal mucosa; cell adhesion; cytoskeleton
R594.12
A
0577-7402(2013)07-0535-05
2012-12-26;
2013-05-17)
(责任编辑:熊晓然)
国家自然科学基金(81071529,81101406);中国博士后科学基金(2012M 512181)
耿焱,医学博士,主治医师。主要从事重症中暑诊治方面的研究
510010 广州 广州军区广州总医院重症医学科(耿焱、彭娜、潘志国、苏磊);510515 南方医科大学研究生学院(刘亚楠、付炜);510515 广州 广州军区广州总医院附属157医院急诊科(雷玉梅)
苏磊,E-mail: gytools@sina.com
