SD大鼠超排及TALEN质粒显微注射构建基因敲除大鼠
2013-08-02卞洲艳张洁钰廖海含唐其柱
卞洲艳,杨 政,徐 蔓,张洁钰,廖海含,唐其柱
(武汉大学人民医院心内科 武汉大学心血管病研究所,湖北 武汉 430060)
实验动物和人类疾病动物模型是生命科学、医学、药学等相关领域进行科学研究的重要支撑条件。大鼠是最重要的实验动物之一,由于大鼠和人类的同源基因数更高,在解剖结构、循环系统、神经系统以及药物代谢等方面和小鼠相比与人类更接近,使大鼠成为心脑血管病、认知科学、分子影像学、器官移植及中医药学等领域进行研究更好的实验动物[1]。随着大鼠基因工程技术的建立,大鼠将成为生命科学和医药研究的主要模型。
目前主要发展的基因修饰技术包括:慢病毒载体技术、PiggyBac转座子系统、锌指核酶(Zinc-finger nucleases,ZFNs)以及最新发展的转录激活因子样效应蛋白核酸酶(Transcription activator-like effector nuclease,TALEN)技术。TALEN 由 TALE(Transcription activator-like effector)结构域和Fok I核酸内切酶结构域人工融合而成,能够特异性的识别目的DNA序列,并通过Fok I核酸内切酶形成二聚体对双链DNA进行切割,断裂的DNA可以启动修复功能,从而实现靶位点的基因敲除、敲入及基因修复等[2]。相对上述其他基因修饰技术,TALEN技术因其可对基因组定点改造,且设计简单、实验周期短、打靶效率高等优势而被广泛应用于植物、哺乳动物细胞、人类细胞、斑马鱼、果蝇、爪蟾等物种。应用TALEN技术构建基因敲除大鼠也已逐渐开展,然而目前国内外有关报道较少,应用该技术构建基因敲除大鼠时的TALEN质粒注射浓度、注射后的阳性率等均有待进一步研究。本研究就TALEN技术构建基因敲除大鼠过程中超数排卵、显微注射、胚胎移植以及出生率、阳性率等问题分别进行了探讨,为广泛有效地开展大鼠基因敲除提供了参考依据,为促进基因工程大鼠动物模型在心血管疾病、神经系统疾病等研究中的应用提供了基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD大鼠,购自上海斯莱克实验动物有限责任公司,8~10周龄雄性大鼠,用作种公鼠和结扎公鼠;4~6周龄雌性大鼠,用作超数排卵,8~10周龄雌性大鼠,用作受体。饲养条件为温度(24±2)℃,湿度为(50±10)%,光照周期为6:00~18:00,12 h昼夜交替。
1.1.2 主要试剂 孕马血清促性腺激素(PMSG),人绒毛膜促性腺激素(hCG),购自宁波市三生药业有限公司,M2培养液(M7167,Sigma),M16培养液(M7292,Sigma),透明质酸酶(H4272,Sigma),矿物油(M8410,Sigma),体外转录试剂盒(Ambion),PCR试剂盒(Takara)。
1.1.3 主要仪器耗材 体式显微镜(Olympus),显微注射系统,超净工作台,培养皿(BD Falcon),一次性注射器,无菌手术器械(剪刀、镊子、血管夹、持针器、手术缝线等)。
1.2 实验方法
1.2.1 供体与受体准备 供体雌鼠超数排卵:选择4~6周龄的雌鼠,于腹腔注射PMSG 20 IU/只,48 h后注射hCG 20 IU/只,按1:1的比例与成年雄鼠合笼,于次日早上观察雌鼠阴栓,见栓雌鼠取卵用于显微注射。雄鼠结扎:参考文献方法[3],选8~10周龄雄性大鼠,腹腔注射戊巴比妥钠(40 mg/kg体重)麻醉后剪毛,75%酒精消毒,腹中线下方距阴茎2~3 cm处剪开皮肤肌肉,分别分离出两侧输精管,将镊子在酒精灯上加热后烧断输精管,关闭腹腔,待恢复2周后用于和雌鼠交配准备受体。受体假孕鼠制备:于取卵前1 d选择成年雌鼠与结扎雄鼠合笼,次日早上观察雌鼠阴栓,见栓雌鼠即作为假孕鼠用作受精卵移植。
1.2.2 TALEN质粒的准备 将构建的TALEN质粒对分别取10µg酶切线性化,酚氯仿抽提、纯化后取1µg作模板,按照体外转录试剂盒的说明依次加入NTP/CAP、10×Buffer及Enzyme Mix,最后加水至20µl转录体系,于37℃水浴2 h。转录后纯化、鉴定,分装保存于-80℃冰箱。
1.2.3 胚胎收集 将见栓雌鼠颈椎脱臼处死,75%酒精消毒后迅速剪开腹腔,分离卵巢输卵管和子宫,剪下输卵管置于37℃预热的M2液滴中,在体式镜下将输卵管膨大部划开,释放出卵丘-卵母细胞复合体。透明质酸酶消化去除颗粒细胞后,于M2培养液滴中洗3~5次后,移入覆盖有矿物油的M16培养液中培养以备显微注射。
1.2.4 显微注射 显微镜下观察可见清晰原核的卵细胞为受精卵,挑选出用于显微注射(图1)。将TALEN质粒对转录的mRNA中放入注射针虹吸,注射针尖端充满液体后安装于注射仪上,根据注射针的出液量多少调节注射压力,注射后可见胞质有明显膨胀表明成功注射入胞质。质粒注射终浓度分别为 5 ng/µl、10 ng/µl、20 ng/µl和 30 ng/µl,共四组。将成功注射且存活的受精卵用于输卵管移植。

图1 显微注射
1.2.5 输卵管移植 将见栓的假孕鼠戊巴比妥钠腹腔注射麻醉(40 mg/kg体重),背部脊柱两侧肋骨下方剃毛,75%酒精消毒后依次剪开皮肤肌肉,可见白色脂肪体,用镊子夹住脂肪体向外牵拉出卵巢、输卵管、子宫,在体视镜下找到输卵管膨大部,用血管夹夹住脂肪体以固定输卵管在镜下合适的位置,在输卵管膨大部前方避开血管走形剪开一小口,将移卵管插入开口吹入胚胎,液体后方吹入一气泡防止液体反流。将脂肪体、卵巢、输卵管及子宫还纳入腹腔,缝合肌肉皮肤。
1.2.6 出生大鼠鉴定 将受精卵移植的假孕鼠单笼饲养22 d左右后观察乳鼠出生情况。新生鼠生长至1周以上即剪脚趾,消化液55℃水浴消化过夜后,常规方法提基因组。对目的基因进行PCR扩增后送测序鉴定。
1.3 统计学方法 应用统计软件SPSS13.0进行统计学处理,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 超数排卵结果 购回的雌鼠分为4~5周和5~6周,两组注射PMSG和hCG超数排卵,两组雌鼠用相同的雄鼠交配,次日见栓率均在70%以上,从见栓雌鼠收集胚胎受精率均在80%以上,两组的见栓率(P=0.820)、取卵数量(P=0.611)以及取卵的受精率(P=0.053)差异均无统计学意义,见表1。
表1 不同周龄对SD大鼠超数排卵的影响(±s)

表1 不同周龄对SD大鼠超数排卵的影响(±s)
周龄(周)供体数量(只)超排见栓数量(只)见栓率(%)取卵数量(枚)受精率(%)4~5 5~6 60 76 44 57 0.74±0.09 0.77±0.06 25±2 23±2 0.85±0.02 0.93±0.02
2.2 受体准备 购买8~10周龄的公鼠结扎后作为结扎公鼠可在后续实验循环使用。本研究观察了不同周龄结扎公鼠和受体雌鼠合笼后的见栓情况(见表2),发现结扎公鼠和受体雌鼠均在8~10周龄时,见栓率最高[(23.02±5.26)%];随着使用时间的增加,结扎公鼠11~13周龄时,见栓率开始下降[(17.06±2.24)%],但差异无统计学意义(P=0.320);当结扎公鼠使用到20~22周,受体雌鼠 16~18周时,见栓率明显下降[(11.66±2.40)%],与结扎公鼠和受体雌鼠均为8~10周龄组比较,差异有统计学意义(P=0.046<0.05)。
表2 不同周龄结扎公鼠对受体见栓率的影响(±s)

表2 不同周龄结扎公鼠对受体见栓率的影响(±s)
注:a表示与结扎公鼠和受体雌鼠均为8~10周龄组比较,P<0.05。
结扎公鼠周龄(周)见栓率(%)受体周龄(周)受体数量(只)8~10 11~13 20~22 23.02±5.26 17.06±2.24 11.66±2.40a 8~10 8~10 16~18 30 40 20
2.3 不同质粒浓度对大鼠出生率和阳性率的影响 在本研究中将质粒浓度分为四个组(5 ng/µl、10 ng/µl、20 ng/µl和 30 ng/µl)进行显微注射,注射后输卵管移植,每组浓度均移植100枚以上显微注射后存活的受精卵。移植成功的大鼠在质粒注射浓度为 5 ng/µl、10 ng/µl、20 ng/µl组的出生率分别为35.42%、42.21%、37.74%,差异无统计学意义(P=0.230,0.706);而质粒注射浓度为30 ng/µl组的出生率为18.95%,显著低于质粒注射浓度为5 ng/µl组(P=0.0014<0.05)。出生的大鼠经测序鉴定,阳性敲除大鼠从靶位点开始有明显的套峰出现(图2)。在5 ng/µl、10 ng/µl组未见目的基因敲除大鼠,在20 ng/µl、30 ng/µl组分别有3只和2只目的基因敲除的阳性大鼠,阳性率分别为7.5%、6.9%(表3)。该结果表明,质粒注射浓度偏低时(5 ng/µl、10 ng/µl),TALEN质粒未能充分发挥敲除效力,但注射浓度偏高(30 ng/µl)时,显著降低了大鼠的出生率。
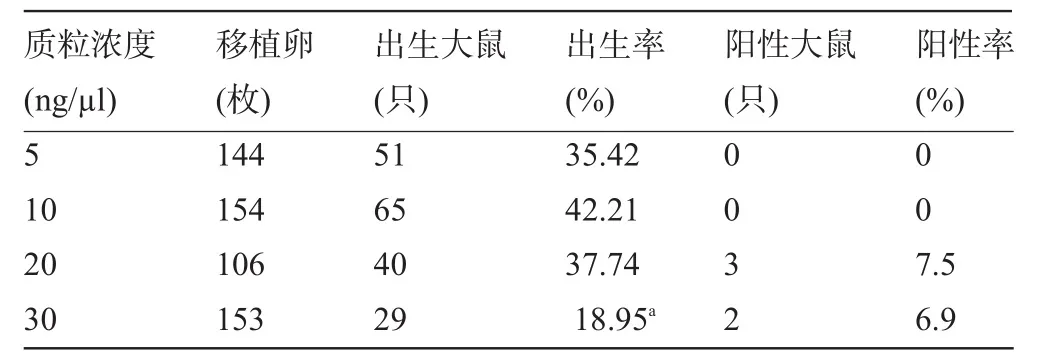
表3 不同质粒浓度对大鼠出生率和阳性率的影响
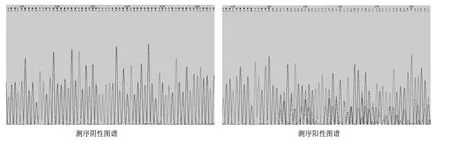
图2 测序图谱及序列比对
2.4 不同移植方式对大鼠出生率、存活率的影响 根据受体雌鼠见栓的情况,在当日超排受精卵数量较多而受体数量不足时,采取双侧移植(17~19枚/侧)和/或留作次日进行双细胞移植。在本研究中,单侧和双侧移植大鼠的出生率差异无统计学意义(P=0.865),但双侧移植出生大鼠的存活率明显下降(P=0.021<0.05),见表4。显微注射相同浓度质粒的双细胞较单细胞移植后大鼠的出生率显著降低(P=0.028<0.05,P=0.041<0.05),见表5。

表4 单侧与双侧移植对大鼠出生率及存活率的影响

表5 单细胞与2细胞移植对大鼠出生率的影响
3 讨论
随着TALEN技术的兴起和在各个领域的应用,运用TALEN技术构建基因敲除大鼠已成为目前高效、快捷地构建基因工程大鼠的方法之一,但由于该技术刚刚兴起,尚有许多不成熟的地方。本研究就TALEN技术构建基因敲除大鼠中的超数排卵、显微注射、胚胎移植以及移植后出生率、阳性率等具体问题逐一进行了初步探讨,为优化TALEN技术构建基因敲除大鼠奠定了基础。研究发现,4~5周和5~6周的雌鼠超数排卵见栓率、取卵数量以及取卵的受精率差异均无统计学意义;结扎公鼠和受体雌鼠在8~10周龄时见栓率最高,随着使用时间的增加,见栓率明显下降;单侧移植和单细胞移植有利于提高大鼠的出生率和存活率。在本研究中质粒注射浓度在20 ng/µl时既不会影响大鼠出生率,又有较高的基因敲除阳性率。
超数排卵获得大量优质胚胎是进行显微注射的前提和基础。超排的效果受动物的成熟度、品系和激素注射量和注射时间的影响。研究表明,随着周龄的增加,动物内源激素的表达,动物对外源激素的反应性降低[4-5]。因此,本研究中依据参考文献[6]给予注射激素剂量20/20 IU,观察不同周龄成熟度大鼠的超排效果。研究发现4~5周龄和5~6周龄的雌鼠超排见栓率均可达到70%以上,取卵的受精率均在80%以上,两组之间见栓率、取卵数量以及取卵的受精率差异无统计学意义。因此选用4~6周龄的雌性SD大鼠均能达到较理想的超排效果。
受体雌鼠的见栓数量直接影响了移植胚胎的数量。而大鼠发情周期不同于小鼠,可以通过阴道口的变化来准确判断其是否发情,因此提高大鼠的见栓率尤为重要。本研究发现随着结扎公鼠周龄的增加以及使用频率的增加,见栓率明显下降。因此,结扎公鼠使用3个月以上时应根据合笼后的见栓情况淘汰更新结扎公鼠,以提高受体见栓率。在受体见栓率较低时,我们在研究中采取了双侧移植和/或次日进行2细胞移植的补救措施。虽然双侧移植不影响大鼠的出生率,但存活率显著下降,这可能与双侧移植导致移植胚胎总数较多,使单个胚胎发育不良,出生后状态较差有关。而显微注射相同浓度质粒,移植2细胞较单细胞大鼠的出生率显著降低,这表明胚胎在体外的培养环境影响了胚胎生长发育,因此显微注射后应尽快移植到大鼠体内,不宜在体外放置太久。
TALEN质粒浓度的高低是决定敲除效率的重要因素。在本研究中设置四个浓度组,发现低浓度组(5 ng/µl、10 ng/µl)的敲除效率为0,高浓度组(20 ng/µl、30 ng/µl)敲除效率可达到7%左右,但注射浓度偏高(30 ng/µl)时,显著降低了大鼠的出生率。该结果与国外研究报道结论一致[7],增加质粒浓度过高时,不会增加质粒的敲除效率,反而降低了大鼠的出生率。分析原因可能是质粒浓度偏低,显微注射过程中尚存在一定浓度的降解,注射到胚胎后,表达蛋白量更少,不足以发挥敲除功能;而高浓度的质粒对胚胎具有一定的毒性作用,影响胚胎的生长发育。因此,选择合适的质粒浓度进行显微注射,对于提高大鼠的出生率和阳性率尤为重要。在本研究中20 ng/µl的浓度既有较高的出生率,又可以达到一定的敲除效率。
综上所述,本研究就应用TALEN技术构建基因敲除大鼠中的问题初步探讨,建议选用4~6周龄雌性SD大鼠超排,定期更新淘汰结扎公鼠,选择合适的显微注射质粒浓度,采取单侧输卵管早期单细胞移植的方式,以提高TALEN技术构建基因敲除大鼠的成功率和效率。本研究为有效的应用TALEN技术构建基因敲除大鼠提供了理论基础和参考依据;由于本研究对该方法首次探索,还有未完善的地方,比如研究样本数量虽足以进行统计学分析,但还没有足够大;通过该方法首次得到的是嵌合体大鼠,需进一步繁殖获得纯合子大鼠;尚只针对一种目的基因进行探讨,而TALEN质粒对不同基因不同外显子的靶向敲除效率不尽相同等问题有待进一步研究解决。
[1]张连峰.我国常用实验动物资源的现状及对未来发展的思考[J].中国比较医学杂志,2011,21(10):39-44.
[2]张金脉,任兆瑞.TALENs:一种新的基因定点修饰技术[J].生命科学,2013,25(1):126-132.
[3]左 琴,岳秉飞,刘双环,等.Wistar大鼠超数排卵及胚胎移植[J].实验动物科学与管理,2003,20:70-72.
[4]Popova E,Krivokhar chenko A,Ganten D,et al.Comparison between PMSG and FSH induced superovulation for the generation of transgenic rats[J].Mol Reprod Dev,2002,63(2):177-182.
[5]Hirabayashi M,Takchashi R,Ito K,et al.A comparative study on the integration of exogenous DNA into mouse,rat,rabbit,and pig genomes[J].ExpAnim,2001,50(2):125-131.
[6]卫晓鸾,章 蓉,金宇娟,等.转基因SD大鼠构建技术的研究[J].扬州大学学报(农业与生命科学版),2009,30(1):26-30.
[7]Tesson L,Usal C,Ménoret S,et al.Knockout rats generated by embryo microinjection of TALENs[J].Nat Biotechnol,2011,29(8):695-696.
