他克莫司治疗类固醇抗性自身免疫性肝炎的临床疗效分析
2013-08-02黄志杰许正锯曾翠萍
黄志杰,许正锯,曾翠萍
(中国人民解放军第180医院肝病中心,福建 泉州 362000)
自身免疫性肝炎(Autoimmune hepatitis,AIH)是一种免疫介导的慢性肝炎,高加索人种的发病率约为17/10万[1],国内发病率尚未有大规模的统计,但就文献报道与临床实践来看,国内发病率比欧美要低很多[1-2]。在我国,AIH多见于中老年女性,以血清转氨酶升高、循环中存在自身抗体、高γ-球蛋白血症、肝组织学特征学改变(界面性肝炎、汇管区淋巴浆细胞浸润和玫瑰花结样变)以及对免疫抑制治疗应答为特点[2]。目前的标准疗法是泼尼松联合硫唑嘌呤[1-8],但是国外文献报道有15%~20%的患者对此疗法不能耐受或应答不完全[1,4-7,9]。而对此类患者的治疗尚无公认的标准可依[2,3,5-9]。
他克莫司是高度亲脂的大环内酯类抗生素,与环孢霉素具有相同的靶点。国外已有少量报道提示了它在治疗高加索人种AIH患者(包括类固醇抗性AIH患者)时的疗效[10-14],但国内尚无相关研究和报道。本文旨在通过分析我院使用他克莫司治疗类固醇抗性AIH患者的临床资料,对其安全性和有效性进行评估。
1 资料与方法
1.1 研究对象 选取2007年1月至2012年12月间12例于我科使用他克莫司治疗的类固醇抗性AIH病例。
1.2 纳入标准 (1)根据1999年国际自身免疫性肝炎组织(IAIHG)制定的指南[15],所有患者均确诊为AIH;(2)均具有泼尼松联合硫唑嘌呤的治疗史,但应用此方案治疗至少6个月后,仍出现2次以上的转氨酶异常升高;(3)均因为对泼尼松不耐受而减少药物使用量或停药,导致应答不完全。所有患者在使用类固醇治疗时,泼尼松的起始剂量为30 mg/d,4周内逐渐减量至10 mg/d时仍不耐受,随后根据临床和生物化学反应对剂量作出调整,在达到最高耐受剂量或停药时出现病情反复。
1.3 排除标准 (1)合并其他免疫性疾病(类风湿关节炎、桥本病、干燥综合征等);(2)合并肝硬化失代偿;(3)合并病毒性肝炎、药物性肝炎、脂肪性肝病、酒精性肝病等;(4)有除类固醇和硫唑嘌呤以外药物治疗史者;(5)伴有明显心、肺、肾、内分泌及血液系统疾病。
1.4 治疗方法 他克莫司的起始剂量为1 mg/d,根据治疗反应随时调整剂量,并维持他克莫司的血药浓度在3.0 ng/ml(±0.5 ng/ml),上限为5.0 ng/ml。
1.5 观察项目 所有患者在接受他克莫司治疗前均接受肝脏活检(评估肝纤维化和肝炎活动情况)及相关实验室检测[包括血清转氨酶、总胆红素(TBil)、免疫球蛋白G(IgG)、白蛋白、肌酐、电解质、他克莫司血药浓度等]。在治疗开始后实验室检测项目每个月执行1次。在患者出现他克莫司不良反应的征兆或症状时,即刻检测上述实验室项目并记录不良反应类型。
1.6 疗效判定 (1)缓解:症状消失,血清转氨酶、总胆红素和IgG恢复正常水平,肝组织学复常或处于非活动性肝硬化状态;(2)应答不完全:经过2~3年治疗,考虑存在治疗相关并发症的同时,临床表现、实验室指标和肝组织学亦无或仅轻微改善;(3)治疗失败:考虑存在治疗相关并发症的同时,临床表现、实验室指标和组织学仍进一步恶化;黄疸、腹水或肝性脑病等进行性升高[15]。
1.7 统计学方法 所有资料统计、分析采用SPSS19.0软件完成,治疗前后的计量资料比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 12例患者中8例为女性,4例为男性,年龄为44~63岁,平均(55.3±7.6)岁。患者AIH病程1~8年,平均(2.1±1.4)年。在接受他克莫司治疗前和随访结束时的实验室检测结果见表1,肝组织病理结果见图1、图2。

图1 治疗前后肝纤维化评分变化(t=2.369,P<0.05)

图2 治疗前后肝炎活动性的变化(t=4.869,P<0.01)
表1 治疗前后ALT、AST、TBil、IgG的变化(±s)
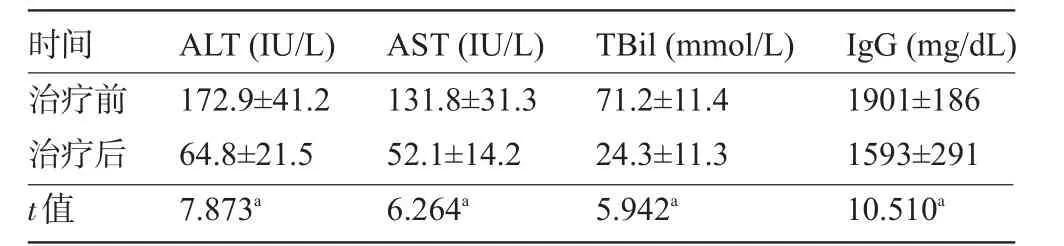
表1 治疗前后ALT、AST、TBil、IgG的变化(±s)
注:a表示治疗前后P值均<0.01。
时间治疗前治疗后t值A L T(I U/L)1 7 2.9±4 1.2 6 4.8±2 1.5 7.8 7 3 a A S T(I U/L)1 3 1.8±3 1.3 5 2.1±1 4.2 6.2 6 4 a T B i l(m m o l/L)7 1.2±1 1.4 2 4.3±1 1.3 5.9 4 2 a I g G(m g/d L)1 9 0 1±1 8 6 1 5 9 3±2 9 1 1 0.5 1 0 a
2.2 治疗结果 所有患者的平均治疗时间为(25.1±9.3)个月,治疗或随访结束时,他克莫司的平均血药浓度在(3.3±0.2)ng/ml。10例(83.33%)患者达到临床缓解;2例(16.67%)患者应答不完全,无患者发生治疗失败。
2.3 不良反应及并发症 7例患者出现轻度头痛或腹痛,但通过调整剂量或其他药物治疗可缓解。1例患者在调整剂量时出现恶心、呕吐。1例患者主诉出现脱发,但由于缺乏治疗前后的客观比对,未能证实。
3 讨论
自身免疫性肝炎(AIH)患者如果不接受治疗,将具有极其严重的自然病程和极高的死亡率[1-2]。类固醇联合硫唑嘌呤是目前国内外公认的一线治疗方案,虽然成功的治疗可以阻止AIH的肝硬化或肝功能失代偿的进程,无需肝移植便能挽救患者的生命,但由于长期使用类固醇激素,不良反应甚多,治愈或缓解病情的代价是患者生存质量的极大下降[1,4]。因此,极有必要选择副作用更小的药物替代类固醇,在维持或提高疗效的同时,保障患者的生存质量。免疫抑制剂便是类固醇的良好替代品。其研究与应用随着器官移植技术的成熟与完善,而得到飞速发展。临床上,通过适当的监控血药浓度,已能在不降低药物疗效的同时,避免绝大多数药物不良反应的发生。他克莫司即为此类药物之一[1,3,5,9]。
1995年,Van Thiel等[14]首次报道了应用他克莫司治疗AIH的临床经验,在他们的研究中,21例患者接受了他克莫司治疗,起始剂量为0.075 mg/kg,口服2次/d,每2周调整一次剂量,目标血药浓度为0.6~1.0 ng/ml,在治疗(3.0±0.5)周后达到靶剂量,研究结束时,75%的患者的肝转移酶得到了改善,所有患者均能耐受该药物剂量,并未出现严重副作用。初步显示了他克莫司治疗AIH的潜力[14]。随后又有几个国外的研究组对该领域进行了系列病例的临床报道[10-13]。Larsen等[12]对9例类固醇抗性AIH患者施行他克莫司治疗,在治疗18个月(12~37个月)后,血药浓度维持在6 ng/ml以下,所有患者的转氨酶水平、肝纤维化程度均得到改善,其病理检查见大部分患者的肝炎特征也得到改善,并且所有患者均能耐受治疗而无严重并发症;Tannous等[11]则对13例AIH患者使用了他克莫司治疗,剂量为2~6 mg/d,维持血药浓度6.0 ng/ml,在治疗1~65个月后,12例患者的转氨酶恢复正常,1例患者在治疗4周后出现尿毒症退出治疗,显示了他克莫司治疗AIH的极佳有效性及较好的安全性。考虑国人到与欧美人的体质差异,我们选择了较低剂量的治疗方案,维持血药浓度0.5 ng/ml,取得了良好的治疗效果。
我们的研究证实,在谨慎监测血药浓度的情况下,使用低剂量的他克莫司治疗国人类固醇抗性AIH时,能有效缓解临床症状,恢复转氨酶正常水平,且能较大程度地改善肝纤维化及肝炎活动程度,有效率超过80%。同时,所有患者均未出现肾损害、高血压、糖尿病等严重并发症,但不能避免轻微或可使用其他药物控制的不良反应。不过,与长期使用类固醇相比,他克莫司在改善患者生存质量方面还是具有绝对优势。
近年来,美国肝病学会(AASLD)[6-7]、英国胃肠病学会(BSG)[8]以及我国的中华医学会风湿病学分会[2]的指南均已将他克莫司列入类固醇治疗失败的AIH患者的推荐用药,但由于缺乏足够的临床证据,对其个体治疗方案、药物剂量、联合疗法的选择和对轻型患者的治疗是否完全适用,仍存在诸多疑问。本研究虽然显示了他克莫司较类固醇在治疗AIH时的一些优势,但由于病例数量有限,且为回顾性的病例分析,不能准确推断药物的最佳应用方案,其远期疗效和后果也未能详细观察记录,因此也不能完全回答上述疑问。
总之,他克莫司治疗国人类固醇抗性AIH患者安全有效,但其具体应用剂量和适用范围,以及能否替代类固醇作为一线用药等,仍需进一步的研究,尤其是大型的随机双盲临床实验以明确和证实。
[1]Czaja AJ.Advances in the current treatment of autoimmune hepatitis[J].Dig Dis Sci,2012,57(8):1996-2010.
[2]中华医学会风湿病学分会.自身免疫性肝病诊断和治疗指南[J].中华风湿病学杂志,2011,15(8):556-558.
[3]Czaja AJ.Drug choices in autoimmune hepatitis:part B-Nonsteroids[J].Expert Rev Gastroenterol Hepatol,2012,6(5):617-635.
[4]Czaja AJ.Drug choices in autoimmune hepatitis:part A-Steroids[J].Expert Rev Gastroenterol Hepatol,2012,6(5):603-615.
[5]Parker R,Oo YH,Adams DH.Management of patients with difficult autoimmune hepatitis[J].Therap Adv Gastroenterol,2012,5(6):421-437.
[6]王绮夏,邱德凯,马 雄.2010年美国肝病学会自身免疫性肝炎指南解读[J].中国肝脏病杂志(电子版),2011,3(3):23-28.
[7]张玉波,段维佳,贾继东.2010年美国肝病学会自身免疫性肝炎诊治指南要点[J].肝脏,2010,15(5):367-368,371.
[8]王绮夏,邱德凯,马 雄.英国胃肠病学会2011年自身免疫性肝炎指南解读[J].肝脏,2012,17(7):512-516.
[9]Selvarajah V,Montano-Loza AJ,Czaja AJ.Systematic review:managing suboptimal treatment responses in autoimmune hepatitis with conventional and nonstandard drugs[J].Aliment Pharmacol Ther,2012,36(8):691-707.
[10]Marlaka JR,Papadogiannakis N,Fischler B,et al.Tacrolimus without or with the addition of conventional immunosuppressive treatment in juvenile autoimmune hepatitis[J].Acta Paediatr,2012,101(9):993-999.
[11]Tannous MM,Cheng J,Muniyappa K,et al.Use of tacrolimus in the treatment of autoimmune hepatitis:a single centre experience[J].Aliment Pharmacol Ther,2011,34(3):405-407.
[12]Larsen FS,Vainer B,Eefsen M,et al.Low-dose tacrolimus ameliorates liver inflammation and fibrosis in steroid refractory autoimmune hepatitis[J].World J Gastroenterol,2007,13(23):3232-3236.[13]Aqel BA,Machicao V,Rosser B,et al.Efficacy of tacrolimus in the treatment of steroid refractory autoimmune hepatitis[J].J Clin Gastroenterol,2004,38(9):805-809.
[14]Van Thiel DH,Wright H,Carroll P,et al.Tacrolimus:a potential new treatment for autoimmune chronic active hepatitis:results of an open-label preliminary trial[J].Am J Gastroenterol,1995,90(5):771-776.
[15]Alvarez F,Berg PA,Bianchi FB,et al.International Autoimmune Hepatitis Group Report:review of criteria for diagnosis of autoimmune hepatitis[J].J Hepatol,1999,31(5):929-938.
